Introduction
v Historique :
Entre 1800 et 1840 : Recherche sur les éléments fondamentaux des
tissus et organes (entités globulaires) : les cellules.
o
Jan Evangelista
Purkinje (1832 – 1845) :
Il est le 1er
à observer et décrire les cellules de Purkinje (= cellules du cervelet)
Ses travaux se
sont axés sur le SNC où l’on rencontre deux problèmes :
-
Problème
d’accès (boîte crânienne)
-
Problème
de la dégradation rapide des tissus.
" Il a donc
développé des techniques de fixations de ces tissus.
o
Camilio Golgi (1873) :
Il a utilisé des
agents chimiques pour durcir et colorer le tissu nerveux et spécifiquement les
neurones (marquage en noir, dérivé du nitrate d’argent)
o
Cajal (1887) :
Il a étudié les
réseaux de neurones (connexions)
" Les neurones sont des unités anatomiques et
fonctionnelles distinctes. Les dendrites sont aussi impliquées dans les
transmissions du message nerveux.
o
Claude Bernard
(1900) :
Il a mis en
évidence d’une communication chimique (neurotransmetteur) entre 2 neurones, qui
peut être bloquée par le curare.
o
Charles Scoot
Sherrington :
Il propose le
terme de synapse du grec Synapsis (=
jonction)
John
C. Eccles, physiologiste : « Toutes
les synapses sont électriques »
Henry
Dales, pharmacologiste : « Toutes
les synapses sont chimiques »
v Rappel :
Schéma classique d’un neurone :
-
2
types de prolongement :
-
Les
dendrites qui recueillent et acheminent les informations vers le corps
cellulaire,
-
L’axone
(unique) qui part du corps cellulaire et envoie l’information vers d’autres
cellules via une zone de connexions appelée synapse. Les cellules
post–synaptiques peuvent être des neurones, des muscles ou des cellules
glandulaires.
-
Le
corps cellulaire = « unité centrale »
Il y a une
grande variabilité de forme : étoilée, fusiforme, conique, polyandrique,
sphérique, pyramidaux (rôle important dans l’hippocampe : mémoire)
Il existe 200
types différents de neurones.
Autre particularité du neurone :
Il a acquis un
potentiel transmembranaire, c’est–à–dire une différence de polarité entre les
milieux extracellulaire et intracellulaire.
L’épine
dendritique est un petit bourgeon au niveau des grandes branches dendritiques,
elle permet d’augmenter la surface d’acquisition des informations.
La synapse
v Généralités :
Le terme a été
proposé en 1897 et la définit comme la zone de contact spécialisée dans la
transmission de l’information entre neurones.
Ensuite, on
découvre que les synapses ne sont pas que interneuronales, mais qu’elles
peuvent aussi se faire avec une cellule musculaire ou une cellule glandulaire.
2 grands types de synapses :
-
La
synapse chimique : Il y a un espace
entre la membrane pré–synaptique et la membrane post–synaptique qui constitue
la fente synaptique.
La
transmission de l’information se fait par des molécules chimiques.
-
La
synapse électrique (= jonction communicante = gap jonction) :
Il
y a un accolement des 2 membranes plasmiques reliées entre elles par des canaux
jonctionnels.
Avantage : La propagation
du PA est rapide.
-
La
synapse mixte : Elle utilise
les 2 modes de transmission.
v Synapses chimiques
neuro–neuronales :
-
Le
mode de communication intercellulaire et peu rapide (0,3 à 5 ms)
-
La
fente synaptique est de 30 à 50 nm.
-
Il
n’y a pas de passage direct d’ions ou de molécules d’une cellule à l’autre.
-
Il
y a l’intervention d’un neurotransmetteur qui est transmis de manière
unidirectionnel.
-
Ces
synapses sont plus fréquentes chez l’homme.
-
Elles
sont plus complexes : elles sont responsables des processus de mémoire,
d’apprentissage, et de plasticité.
Elle est définit
par 3 parties :

Microtubules
Elément pré–synaptique
Vésicules
Fente synaptique
Elément post–synaptique Récepteurs
o
L’élément
pré–synaptique :
Il possède de
nombreuses mitochondries.
Sous la membrane
plasmique, il y a la présence d’un réseau sous–membranaire (ou grille
synaptique) ; il s’agit d’une organisation particulière du cytosquelette
liée à l’exocytose des vésicules synaptiques.
" Lorsqu’il y a fusion d’une vésicule avec la
membrane, il y a une formation d’un synaptopore qui permet la libération du
neurotransmetteur.
o
L’élément post–synaptique :
Il y a un
épaississement de la membrane plasmique qui correspond à une région sous
membranaire dense en électrons qui reflète une organisation particulière du
cytosquelette liée à l’ancrage des récepteurs post–synaptiques.
Þ Le cytosquelette a un rôle important tant
dans la libération du neurotransmetteur que dans l’organisation des récepteurs
post–synaptique.
Ø Asymétrie
de structure :
§ Synapse de type S :
Ce sont les plus
répandues. Leur fente synaptique est assez large : 30 nm.
Les vésicules
synaptiques sont sphériques avec des tailles différentes. On distingue 2 types
de vésicules :
-
Les petites
vésicules sphériques : elles ont un contenu clair ou dense selon le
neurotransmetteur. Elles sont directement libérées dans la fente synaptique.
Les plus
répandues sont celles qui contiennent l’acetylcholine.
-
Les grandes
vésicules sphériques : elles ont un coeur dense séparé par un halo clair
périphérique. Elles contiennent préférentiellement des neuropeptides (dont la
chromogramine) Elles sont exocytées latéralement et non directement dans la
fente synaptique.
§ Synapse de type F :
Leur fente
synaptique est plus étroite : 20 nm.
Leurs vésicules
synaptiques sont aplaties qui contiennent un neurotransmetteur inhibiteur
(comme le GABA)
Elles
correspondent aux synapses inhibitrices : elle mettent une opposition à la
création d’un PA.

Rétrocontrôle
via un interneurone
Ø Asymétrie
fonctionnelle :
Le
neurotransmetteur est stocké dans des vésicules synaptiques des éléments
pré–synaptiques.
L’arrivée d’un
PA dans l’élément pré–synaptique entraîne une dépolarisation qui conduit à
l’activation de canaux calcique voltage–dépendants et par conséquent une entrée
de Ca2+.
Ce Ca2+ va induire la
fusion de vésicules synaptiques avec la membrane plasmique.
La durée du PA
va déterminer l’ouverture des canaux Ca2+ et donc la
quantité de neurotransmetteur libéré.
La vésicule
libère son contenu par phénomène d’exocytose. On appelle zone active, l’ensemble
formé par les vésicules pré–synaptiques et la membrane axonale où se situe
l’exocytose.
Les molécules de
neurotransmetteur libérées peuvent se fixer sur la membrane post–synaptique sur
des récepteurs spécifiques. Cette fixation entraîne un passage d’ions à travers
de la membrane post–synaptique : c’est la transmission synaptique.
En même temps,
les neurotransmetteurs dans la fente synaptique sont recaptés par la membrane
pré–synaptique. La membrane est également recyclée.
L’élément
pré–synaptique renferme la machinerie nécessaire à la synthèse, stockage,
libération et à l’inactivation du neurotransmetteur.
L’élément
post–synaptique est spécialisé dans la réception de l’information : il
enferme dans sa membrane plasmique les protéines réceptrices du
neurotransmetteur :
-
Récepteurs
canaux
-
Récepteurs
couplés à des protéines G.
Ø Classification
:
§ Au niveau du soma :
Au niveau du soma :
-
Synapse axo–somatique simple,
-
Synapse
axo–somatique invaginée,
-
Synapse
axo–somatique épineuse.
Au niveau du soma :
-
Synapse
axo–dendritique simple, (accolement des 2 membranes),
-
Synapse axo–dendritique épineuse (synapse sur le bourgeon des
épines dendritiques),
-
Synapse
à crête (sur le coté du bourgeon dendritique),
-
Synapse
épineuse ramifiée,
-
Synapse
axo–dendritique « en passant »,
-
Synapse
axo–dendritique réciproque,
-
Terminaison
poly–synaptique,
-
Synapse
épineuse interdigité.
Au niveau du cône d’implantation et de
l’axone :
-
Synapse axo–axonique proximale,
-
Synapse
axo–axonique inhibitrice,
-
Synapse
axo–axonique distale,
-
Synapse
axo–axonique « en passant »,
Les terminaisons
dendritiques sont super mobiles.
Ø Arrangement
synaptique : exemple du cervelet :
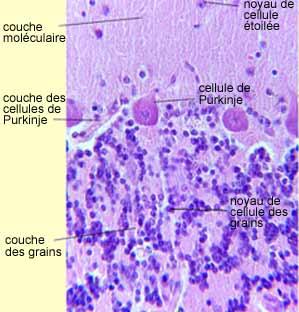 Le cervelet,
notamment le cortex cérébelleux, est constitué de 3 couches :
Le cervelet,
notamment le cortex cérébelleux, est constitué de 3 couches :
De la plus externe à la plus interne
-
La
couche moléculaire,
-
La
couche des cellules de Purkinje,
-
La
couche des cellules granulaire
(ou
couche des grains)

§ La couche moléculaire :
Il s’agit d’une
couche d’interneurones inhibiteurs nommés cellules étoilées et cellules en
corbeille (ou en panier)
-
Les cellules
étoilées
sont situées dans la partie superficielle de la couche moléculaire (à
l’horizontale)
-
Les cellules en
corbeille
sont en profondeur. Cette position plus basse permet de faire des synapses sur
les cellules des couches inférieures, notamment sur les cellules de Purkinje.
Au même niveau,
les axones des cellules granulaires se divisent en 2 pour devenir les fibres
parallèles.
§ La couche de cellules de
Purkinje :
Elle est constituée essentiellement de
l’alignement des corps cellulaires des cellules du Purkinje.
Le réseau
dendritique élaboré par ces cellules va se déployer dans la couche moléculaire
et va former des contacts synaptiques très particuliers avec les fibres ascendantes et les fibres parallèles (qui sont
les 2 afférences principales du cervelet)
Les axones des
cellules de Purkinje sont la sortie principale de l’information traitée par le
cortex cérébelleux vers d’autres structures du cervelet.
§ La couche granulaire :
Elle contient
les cellules inhibitrices de Golgi
et les cellules granulaires excitatrices
(dont leur prolongement devient la fibre
parallèle au niveau de la couche moléculaire)
Elles reçoivent
l’information venant du cortex cérébral et de la moelle épinière. Cette
information leur parvient par 2 types de fibres nerveuses :
-
Les fibres
ascendantes (ou grimpantes) qui amènent l’information en provenance de la
moelle épinière (information entre autre sur l’état des muscles)
Elle
s’enroule autour des dendrites des cellules de Purkinje.
-
Les fibres moussues qui sont les
axones excitateurs provenant du cortex moteur.

Les neurones les plus caractéristiques du cortex cérébelleux sont
les cellules de Purkinje :
" Leur axone fait
des synapses sur les neurones du noyau
dentelé, d’où part ensuite les informations vers le cortex cérébral et le thalamus
stratum.
" Leurs dendrites
présentent une disposition très particulière :
Elles
forment un éventail dans un seul plan. Chaque éventail dendritique est
parallèle à ceux des autres cellules de Purkinje et distant d’eux de
Leur
déploiement se fait dans la couche moléculaire.
Sur
chaque éventail dendritique, vient s’arboriser la terminaison d’une seule fibre ascendante. Chaque fibre
ascendante (qui apporte une information en provenance des propriorécepteurs musculaires) va épouser intimement les dendrites
des cellules de Purkinje de sorte que son information provoque une excitation
massive de la cellule de Purkinje.
Une
2nde source afférente, la fibre
moussue, agit de manière très dispersée. Des axones en provenance du cortex
cérébral vont établir des connexions dans la couche granulaire.
Ces cellules
sont très nombreuses (environ la moitié des neurones du cerveau)
Les
axones des cellules granulaires remontent vers le cortex superficiel et se
divisent en 2 perpendiculairement pour former les fibres parallèles. Ces axones
cheminent perpendiculairement aux arbres dendritiques des cellules de Purkinje.
Bien que chaque
fibre parallèle n’ait q’un seul contact avec chacune des cellules de Purkinje
qu’elle rencontre, elle va en rencontrer un grand nombre sur son parcours.
Chaque cellule
de Purkinje reçoit plus de 100 000 synapses issues des fibres parallèles.

Cette
configuration a d’abord été considérée comme la base de l’horloge cérébelleuse.
Le message afférent des fibres parallèles traversant les paliers successifs
avec un retard croissant, il se crée un décalage que le cervelet pourrait
utiliser pour coordonner l’enchaînement de mouvement successif.
Cependant,
l’interprétation la plus admise est d’y voir une structure idéale de la base
d’un mécanisme d’apprentissage élémentaire, appelé dépression à long terme.
Cette dépression
survient lors de l’activation simultanée de l’arbre dendritique de la cellule
de Purkinje par la fibre ascendante et la fibre parallèle.
Elle se manifeste alors par une
diminution durable de l’efficacité de la synapse entre les fibres parallèles et
les dendrites de la cellule de Purkinje.
v Synapses chimiques de type
neuro–musculaires :
Le PA déclenche
l’ouverture et l’activation des canaux Ca2+
voltage–dépendants. Ces derniers entraînent l’exocytose et donc la libération
de neurotransmetteurs dans la fente synaptique. Ces neurotransmetteurs sont
ensuite recaptés par l’élément pré–synaptique et les astrocytes.
Du cerveau au
muscle, il n’y a que 2 types de neurones qui vont passer la commande d’un geste
volontaire :
-
Le 1er type : les neurones
pyramidaux du cortex moteur, dont les axones se regroupent pour former
différents faisceaux qui vont descendre dans la moelle épinière jusqu’aux motoneurones.
-
Le 2ème
type :
les motoneurones, dont les axones sortent de la moelle épinière et vont former
des nerfs et produire le mouvement.
 Quand les axones
arrivent à proximité du muscle, il se divise en plusieurs branches et chacune
établit une jonction musculaire avec
une fibre musculaire.
Quand les axones
arrivent à proximité du muscle, il se divise en plusieurs branches et chacune
établit une jonction musculaire avec
une fibre musculaire.
Le PA en
provenance d’un motoneurone va provoquer une contraction d’un ensemble de
fibres musculaires, formant ce que l’on appelle une unité motrice.

Le
neurotransmetteur utilisé est l’acétylcholine :
Quand le PA
arrive à une jonction musculaire, il provoque la libération d’acétylcholine qui
se fixe sur les récepteurs nicotiniques
situés sur la plaque motrice (= région spécifique de la membrane
post–synaptique de la fibre musculaire où sont concentrés les récepteurs
nicotiniques)
Cette fixation
provoque l’ouverture de récepteurs canaux qui font entrer le Na+ dans les fibres
musculaires.
Si cette entrée
est suffisante pour passer le potentiel de repos de la fibre musculaire de –95
à –50 mV, elle va provoquer un PA musculaire qui va se répandre dans toute la
fibre. Celui–ci voyage d’abord à la surface du sarcolemme (= membrane excitable qui entoure les structures
cylindres contractiles des myofibrilles)
Pour atteindre
ces myofibrilles, souvent en profondeur, un réseau de tubules T (transverses) s’est formé à partir du sarcolemme et qui
s’enfonce au cœur de la fibre. C’est dans cette structure clé qu’une cascade de
réactions, menant à la contraction, va se produire.
Le REG stocke le
Ca2+ nécessaire à la contraction
musculaire.
Or, il existe un
couplage physiologique direct entre une protéine sensible au potentiel interne
des tubules T et le canal Ca2+ du RE, de sorte
que l’arrivée du PA musculaire provoque l’expulsion du Ca2+ du RE vers le
milieu cytosolique.
 Cette expulsion
rend ainsi le Ca2+ disponible pour
la suite de la cascade biochimique impliquant les protéines contractiles (=
myofibrilles)
Cette expulsion
rend ainsi le Ca2+ disponible pour
la suite de la cascade biochimique impliquant les protéines contractiles (=
myofibrilles)
ê
Une fibre musculaire est activée par
une seule synapse.
En revanche, un motoneurone peut activer plusieurs fibres musculaires.
Ø Formation
:
Quand les
neuroblastes ont terminé leur migration (et parfois pendant celle–ci), ils
émettent des prolongements (= neurites)
qui s’allongent par leur extrémité.
L’un d’eux va
croître sur de longues sur de longues distances avant d’atteindre sa cible. Il
s’agit du futur axone. L’allongement est possible grâce à la structure en
extrémité : le cône de croissance.
Celui du
motoneurone émet de l’acétylcholine spontanément avant d’atteindre une fibre
musculaire.
D’autre part,
des récepteurs nicotiniques sont répartis uniformément sur la membrane de la
fibre musculaire.
Peu de temps après da formation du
contact entre l’axone et la fibre musculaire, les récepteurs nicotiniques
s’accumulent rapidement à l’endroit de la future synapse ; alors que la
population de récepteurs extra–synaptiques diminue de manière importante.
Mais on pense
qu’ils gardent tout de même un rôle majeur, notamment dans le SNC.
L’un des indice
qui guide l’information de ces connexions, si précisément ajustées l’une à
l’autre, est une molécule appelée agrine.
Elle est synthétisée par les corps cellulaires du neurone pré–synaptique,
transportée le long de l’axone et libérée par la fibre neuronale en croissance.
L’agrine se lie
à un récepteur post–synaptique dont l’activation provoque le regroupement des
récepteurs à acétylcholine.
En plus de cette redistribution des
récepteurs à l’acétylcholine, de nouveaux récepteurs sont insérés dans la
membrane, synthétisés par l’élément post–synaptique dans la zone en vis–à–vis
de la synapse.
Sur une fibre
musculaire, plusieurs synapses sont mises en place : une active et
d’autres inactives qui vont par la suite régresser. Un processus de sélection
est donc nécessaire pour baisser le nombre de ces synapses et raffiner les
circuits nerveux.
v Synapses électriques :

-
Elle
est extrêmement rare dans le SN de mammifères.
-
Elle
se rapproche de très près de l’organisation des jonctions communicantes.
-
Elle
correspond à un accolement de membrane plasmique avec des connexons qui forment
des canaux laissant passer les ions et les petites molécules.
L’information
électrique circule plus rapidement que l’information chimique, sans délai
synaptique. Elle est aussi beaucoup moins modulable et contrôlable.
v Synapses mixtes :
Elle
correspond à la juxtaposition d’une synapse chimique et d’une synapse
électrique.
Elle
est plus fréquente chez les mammifères que la synapse électrique seule.
Neurotransmetteurs
v Les critères de définition :
Définition :
Les signaux chimiques
sont libérés dans la fente synaptique par la terminaison nerveuse
pré–synaptique et se lient avec un récepteur spécifique appartenant à l’élément
post–synaptique.
Le récepteur
provoque de brèves modifications des modifications des propriétés électriques
de la cellule cible et donne naissance à une variété d’effets post–synaptiques.
Les
neurotransmetteurs sont définis par 3 critères :
j La substance doit être présente dans
l’élément pré–synaptique. Par conséquent, il faut que les acteurs (enzymes et
précurseurs) nécessaires à la synthèse du neurotransmetteur soient présents au
niveau de la structure pré–synaptique.
Ceci n’est pas
une preuve suffisante pour dire qu’une molécule soit un neurotransmetteur.
Par exemple,
le glutamate et l’ATP sont des neurotransmetteurs mais ont aussi d’autres rôles
dans les autres types cellulaires.
k La libération de la substance doit se faire
en réponse à une dépolarisation pré–synaptique et doit être dépendant du Ca2+.
Associé à cette libération, il faut que
le neurotransmetteur soit objet, dans la fente synaptique, d’une élimination
rapide par une enzyme de dégradation ou par un transporteur.
l Il faut qu’il y ait dans l’élément
post–synaptique des récepteurs spécialisés à ce neurotransmetteur.
Un petit
bémol :
Tous les
neurotransmetteurs ne répondent pas à l’ensemble de ces critères.

v L’acétylcholine :
Le rôle de
l’acétylcholine comme neurotransmetteur a été mis en évidence grâce à une
expérience sur le cœur de grenouille (1921)
Ø Voie
de synthèse :

L’acétylcholine
est synthétisée dans les terminaisons nerveuses à partir de l’acétyl_CoA et de
la choline par une enzyme :
La présence de
CAT dans le neurone est une forte indication que l’acétylcholine y est utilisée
comme neurotransmetteur.
-
L’enzyme
CAT est synthétisée dans le soma du neurone et transportée vers les
terminaisons nerveuses par le transport antérograde.
-
L’acétyl_CoA
est synthétisé dans les mitochondries puis transféré dans le cytoplasme.
-
La
choline est issue de la dégradation de la phosphatidylcholine puis apportée
jusqu’au neurone par 2 mécanismes :
-
Le
transport lent de faible affinité avec une constante de 40 à
-
Le
transport rapide de haute affinité avec une constante de 1 à
" La synthèse d’acétylcholine est corrélée avec
le transport de la choline, facteur limitant de cette réaction.
v Les monoamines :
Ø Catécholamines :
On
retrouve :
-
La
dopamine,
-
La
noradrénaline,
-
L’adrénaline
Leur origine chimique est un noyau
catéchol issu du même précurseur :

-
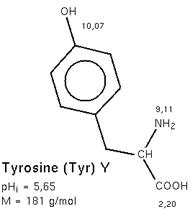
La synthèse se fait par une 1ère étape
commune :
" La tyrosine est transformée en DOPA (= Dihydrophénylalanine)
Elle
est catalysée par la tyrosine_hydroxylase
dans une réaction qui nécessite de l’O2 et de la tétrahydro(bio)ptérine comme
cofacteurs.
Il
s’agit de l’étape limitante pour la synthèse des 3 neurotransmetteurs, de sorte
que la présence de tyrosine_hydroxylase (TH) est un critère important pour
identifier les neurones catécholinéargique.
La
tyrosine n’est pas limitante, c’est la tétrahydrobioptérine qui est limitante. Ce
cofacteur doit être sous sa forme réduite, réduction faite par
-
La 2ème étape consiste en la
décarboxylation de
" Formation de la dopamine.
L’enzyme
est la dopa_décarboxylase qui
nécessite le cofacteur le pyridoxal
phosphate.
Pour
les neurones produisant la dopamine, la synthèse s’arrête ici.
-
La 3ème étape consiste en la
décarboxylation de
" Formation de la noradrénaline.
L’enzyme
est la dopamine_b_hydroxylase qui nécessite un
certain nombre de cofacteurs : l’ascorbate,
l’O2, le Cuivre.
Pour
les neurones produisant la noradrénaline, la synthèse s’arrête ici.
-
La 4ème étape :
" Formation de l’adrénaline.
L’enzyme
est la phényl_éthanolamine_N_méthyl_transférase
(PENM) qui nécessite le cofacteur :
L’étape limite
dans cette synthèse en cascade est la 1ère étape.
La
dopamine est synthétisée au niveau
du corps cellulaire et est transporté dans les vésicules jusqu’aux terminaisons
pré–synaptiques.
Pour
la noradrénaline, l’enzyme dopamine_b_hydroxylase est recaptée
dans les vésicules et la réaction se fait dans la vésicule.
Pour
l’adrénaline, l’enzyme PENM_transférase est également pompée
dans les vésicules et la réaction se fait dans la vésicule.
Ø Indolamines :

Exemple de
Elle a été mise
en évidence au niveau :
-
Des
plaquettes 8%,
-
 Des cellules
chromafine 90%,
Des cellules
chromafine 90%,
-
Des
neurones 2%,
Elle
est synthétisée à partir de tryptophane (acide aminé essentiel, dont l’apport
se fait par l’alimentation) Il est capté à partir du sang par un transporteur
non spécifique : il y a une compétition avec d’autres acides aminés.
-
1ère
étape : Hydrolyse du tryptophane :
![]()
Cette enzyme
permet de marquer des neurones sérotoninergiques.
-
2ème étape :
Décarboxylation :
Elle se fait par
une décarboxylase spécifique des
acides aminés aromatiques. Cette enzyme n’est pas spécifique des neurones
sérotoninergiques.
Þ Cela donne la sérotonine.
Ø Imidazole :
Exemple de l’Histamine :
Il n’y a qu’une
seule étape, catalysée par une enzyme cytosolique :

v Acides aminés :
Ø Acides
aminés excitateurs :
Les principaux
excitateurs du SNC sont le glutamate et l’aspartate. Ils interviennent dans 50%
des synapses. Ils ont la qualité d’excitateur en raison de leur capacité de
dépolarisation des cellules.
Ce sont des
neurotransmetteurs très différents des autres car ils sont impliqués dans le
métabolisme des protéines et dans le métabolisme énergétique.
Ils sont également les précurseurs d’un
autre acide aminé (inhibiteur) : le GABA.
De part leur
fonction dans le métabolisme énergétique, il est très difficile de différencier
le glutamate comme métabolique ou comme neurotransmetteur.
§ Glutamate :
-
La
voie principale de synthèse se fait à partir de glutamine, transformée en
glutamate par les mitochondries.
-
Une
autre voie de synthèse se fait à partir de l’a_cétoglutarate
et l’aspartate, au niveau du cycle de Krebs, lors de la dégradation du glucose.
Compte tenu de
son importance dans le SNC, le glutamate est impliqué dans nombreuses maladies
neurodégénératrices. Mais pour la même raison, il est difficile de trouver une
alternative thérapeutique sans dérégler le reste.
Ø Acides
aminés inhibiteurs :
Les principaux
excitateurs du SNC sont le GABA et la glycine. Presque tous les neurones
inhibiteurs du SNC et de la moelle utilisent le GABA ou la glycine comme
neurotransmetteurs. Ils ont la qualité d’inhibiteur en raison de leur capacité
d’hyperpolariser des cellules.
§ GABA :
Il est présent
dans € des synapses,
ne dérive pas d’acides aminés essentiels et ne rentre pas dans une composition
des protéines.
Þ La présence de
GABA est l’indice de son utilisation comme neurotransmetteur.
-
Le
principal précurseur du GABA est le glucose métabolisé en glutamate par le
cycle de Krebs. Toute fois, le pyruvate ou la glutamine sont de bons
précurseurs.
-
La
conversion du glutamate en GABA est réalisée par une enzyme qui se trouve
exclusivement dans les neurones GABAnergiques :
" L’acide glutamique décarboxylase (ou glutamate
décarboxylase)
Elle
nécessite la présence du cofacteur phosphate de pyridoxal (dérivé de vitamine
B6)
Exemple :
L’épilepsie infantile
est due à un déficit de vitamine B6.
§ Glycine :
C’est un acide
aminé neutre dont la localisation est extrêmement ponctuelle. En effet, la
glycine inhibe les décharges des motoneurones de la moelle épinière.
50% des synapses
inhibitrices de la moelle sont glycinergiques.
La synthèse se
fait à partir de l’acide aminé sérine par une enzyme mitochondriale :
" La sérine hydroxy_méthyltransférase
Ø Neuropeptides
:
Il en existe
plus d’une centaine. Ils sont présents dans les neurones et ont très vite été
supposés avoir un rôle dans la neurotransmission.
Problème :
On n’a pas pu
déterminé les 3 critères :
" Ils sont présents dans les neurones et sont
libérés dans la fente synaptique.
Contrairement
aux autres neurotransmetteurs, leur rôle n’est pas toujours bien établi.
Certains d’entre eux sont notamment trouvés dans l’intestin.
Nombre d’entre eux ont été découvert
dans l’extraction de la peau de grenouille et ont un rôle dans la modulation
des neurotransmetteurs.
La synthèse est
bien connue, surtout dans le cas des endorphines (famille des eupyoïdes),
substances endogènes qui agissent sur le même récepteur que les opiacés (comme
la morphine)
Synthèse :
Un polypeptide
précurseur est synthétisé dans le soma. Il existe ensuite une maturation
post–traductionnelle qui se réalise en plusieurs étapes, notamment par des
protéases (qui agissent pendant le transport axonal antérograde rapide.
Lorsque la
vésicule arrive au niveau de la terminaison, la maturation est terminée et le
neuropeptide est près à être libéré.
v Les vésicules :
Ø Libération
vésiculaire :
Le
stockage peut se faire dans 2 compartiments :
-
Dans une
fraction cytoplasmique :
Ce cas est peu
important quantitativement. Le turn–over du neurotransmetteur est rapide car
les molécules sont exposées aux enzymes cytoplasmiques de dégradations.
" Dans le cytoplasme, les molécules sont soit
néosynthétisées, soit recaptées.
-
Dans une
fraction vésiculaire :
Elle est issue
d’un mécanisme de pompage du neurotransmetteur (ou neuropeptide) par échange
ionique.
Les
concentrations sont 100 à 1000 fois plus importantes que dans le cytoplasme.
Les neurotransmetteurs sont très stables car ils sont protégés des enzymes
cytoplamiques.
Ø Synthèse
vésiculaire :
-
Les
vésicules sont des constituants de membrane dans le RE. Elles passent ensuite
dans l’appareil de Golgi.
-
La
migration se fait le flux axonal jusqu’à la membrane plasmique. Souvent cette
étape est accompagnée d’une étape de charge en neurotransmetteur.
-
Suite
à une stimulation (entrée de Ca2+), il y a fusion
avec la membrane : exocytose
(=
libération du neurotransmetteur dans la fente)
-
Après,
les vésicules sont recyclées par un processus d’endocytose. La vésicule est
recouverte de protéines, notamment de clathrine.
-
Les
vésicules sont soit rechargées, soit dégradées.
-
La
dégradation se déroule en 2 étapes :
-
Le
transport rétrograde vers le soma,
-
La
fusion des vésicules avec les lysosomes.
Ø Facteurs
impliqués dans la libération vésiculaire :
-
Le
Ca2+,
-
Le
potentiel de membrane.
La libération en
grande quantité du neurotransmetteur nécessite d’une dépolarisation
pré–synaptique, provoquée par l’arrivée du PA. Le Ca2+ est toujours
indispensable car s’il y une déplétion en Ca2+, il n’y a pas
de libération.
Il
existe une libération dite non synaptique produite au niveau des dendrites,
soma et cellules gliales :
-
Cette
libération non synaptique quantique n’intervient pas directement dans la
neurotransmission.
-
Elle
intervient dans la régulation des concentrations intracellulaires des
neurotransmetteurs. Elle est provoquée grâce aux transporteurs bidirectionnels
(libération et réception)
-
Elle
est surtout libérée au niveau de la jonction neuromusculaire pour la libération
d’acétylcholine.
La
libération de neurotransmetteur dite quantique est mise en évidence par
l’enregistrement post–synaptique en absence de stimulation.
" Des
potentiels miniatures, sans conséquence sur l’élément post–synaptique (pas de
PA) apparaissent de façon aléatoire et toujours de même amplitude.
Þ Mise en
évidence d’une dépolarisation aléatoire et de même amplitude correspondant à la
libération d’une quantité fixe de neurotransmetteur appelée quantum.
Lorsqu’une
réelle dépolarisation se produit, la quantité libérée est toujours un multiple
de ce quantum.
-
Quand
l’élément pré–synaptique n’est pas stimulé, il y a une libération spontanée
dont la quantité de neurotransmetteur libéré correspond au quantum.
-
Quand
l’élément pré–synaptique est stimulé, il y a une libération de
neurotransmetteur correspond à un multiple du quantum.
La libération du
neurotransmetteur se fait par fusion de la membrane vésiculaire avec la
membrane plasmique.
Il existe une
protéine dont le rôle est crucial dans la libération : la synaptotiming qui fixe le Ca2+. La
modification moléculaire générée par la fixation entraîne l’ouverture de la
vésicule dans la fente synaptique.
v Destinée du
neurotransmetteur :
-
Le
neurotransmetteur qui n’a pas été libéré peut être dégradé dans le cytoplasme.
Il existe alors un équilibre entre la dégradation et la synthèse.
-
Lorsqu’il
est libéré, il peut agir sur les récepteurs. Il s’agit d’une fraction très
faible du pool libéré : » 1/1000) Ceci est dû à la faible
affinité entre le neurotransmetteur et le récepteur.
" Cela implique que, pour avoir une conséquence
physiologique sur l’élément post–synaptique, il faut avoir une concentration
élevée de neurotransmetteur dans la fente synaptique.
La libération du
neurotransmetteur est essentiellement dépendante de la fréquence des PA ;
c’est–à–dire que plus cette fréquence est élevée, plus la quantité du
neurotransmetteur est importante.
Toute fois, il faut
éliminer très vite ce neurotransmetteur de la fente pour maintenir
l’information par le PA.

Elément pré–synaptique :
Elément pré–synaptique :
(Si l’élimination est lente)
Il y a donc 2 systèmes actifs
d’élimination des neurotransmetteurs pour assurer une fugacité d’action :
-
Un système
d’inactivation par des enzymes de dégradation dans la fente
synaptique :
Les produits de dégradation sont ensuite
recaptés par l’élément pré–synaptique ou par les astrocytes pour être
métabolisés ou recyclés.
-
Un système de
recapture :
Il s’agit d’un
système de transport spécifique situé soit au niveau de l’élément
pré–synaptique, soit au niveau des cellules gliales (en contact direct avec la
synapse)
Exemple de
l’acétylcholine :
Elle est
inactivée dans la fente synaptique par une enzyme appelée acétylcholine estérase (AchE)
qui va métaboliser l’acétylcholine (dans la fente) en choline et l’acétate.
C’est une enzyme très efficace :
elle dégrade 5000 molécules d’acétylcholine par seconde.
Le produit de
dégradation (choline) est pompé par l’élément pré–synaptique pour être
réutilisé dans la synthèse d’acétylcholine.
L’acétylcholine
estérase (impliquée dans la maladie d’Alzheimer) est acheminée du soma par le
transport antérograde rapide.
Elle
comporte une sone globulaire catalytique : c’est une protéine asymétrique
car elle a une structure globulaire reliée à une triple hélice de collagène qui
va permettre l’ancrage de cette enzyme dans la lame basale présente au niveau
de la jonction neuromusculaire.
Elle est :
-
Soit
ancrée,
-
Soit
insérée dans la membrane plasmique pré–synaptique,
-
Soit
soluble dans la fente synaptique.
Exemple du
glutamate :
Il
est recapté soit par l’élément pré–synaptique, soit par les cellules gliales,
par un système de recapture de haute affinité électrogénique :
-
1
glutamate + 3 Na+ entrant dans la
cellule,
-
1
K+ sortant.
L’activation de
ces transporteurs exige un maintient des différences de concentration de Na+ et K+. Si cette
différence de concentration change, il n’y a plus de recapture mais plutôt une
libération.
Récepteurs
" Etude sur les
récepteurs et conséquence de l’activation des récepteurs.
Le récepteur est une protéine qui
reconnaît un message chimique, soit le neurotransmetteur, soit un message
artificiel (agent pharmacologique) et qui va exécuter un ordre biologique par
l’intermédiaire d’un système de transduction.
Il est figé (ou
ancré) dans la membrane.
Il possède un
pôle de reconnaissance situé vers la fente synaptique et un pôle effecteur
situé à l’intérieur de la cellule.
Il répond à 2
propriétés fondamentales :
-
Affinité
-
Activité
Il existe 2 types de récepteurs de
neurotransmetteur :
-
Le récepteur
ionotropique :
c’est un polymère qui présente un canal central permettant le passage des ions.
-
Le récepteur métabotropique : c’est un
monomère lié à des protéines membranaire de transduction (protéines G)
Pour un
neurotransmetteur, il peut exister plusieurs récepteurs. Ils sont exprimés dans
des structures différentes, mais ils peuvent également être observés dans une
même synapse.
L’activation de
plusieurs types de récepteurs peut être nécessaire pour des effets
physiologiques, notamment dans les processus de mémoire.
En revanche, 2
neurotransmetteurs différents de peuvent agir sur le même récepteur, à
l’exception du glutamate et de l’aspartate sur un même récepteur, ainsi que
l’adrénaline et la noradrénaline sur un autre.
v Structure
des récepteurs :
Ils ont une
caractéristique commune :
-
Chaque
protéine comporte des domaines intracellulaires et des domaines
extracellulaires qui sont alternés par des hélices a composées
d’environ 20 acides aminés, généralement situées dans la membrane.
-
Le
segment externe possède des sites de glycosylation, importants pour la
reconnaissance du neurotransmetteur, et des sites de reconnaissance du
neurotransmetteur.
-
Le
segment interne possède des sites de phosphorylation (= groupement hydroxyle de
résidu sérine, tyrosine ou thréonine) permettant la modulation de l’activité du
récepteur.
" En fonction de son état de phosphorylation, il y a différentes conséquences au niveau du
récepteur.
v Récepteur
ionotropique :
Il présente
plusieurs sous–unités différentes : il s’agit d’un récepteur hétéro
polymérique. Même s’il existe une forme d’homologie entre les sous–unités, il
reste tout de même des différences responsables des propriétés pharmacologiques
du récepteur.
Les sous–unités
sont formées d’un petit nombre de domaines (entre 4 et 8) Chaque sous–unité
possède un site de fixation du ligand, des sites de modulation et des sites spécifiques
de certains agents pharmacologiques.
 Le canal est
situé au milieu et est fermé par juxtaposition des sous–unités. Chaque
sous–unité va participer à la formation du canal, via leurs domaines
transmembranaires.
Le canal est
situé au milieu et est fermé par juxtaposition des sous–unités. Chaque
sous–unité va participer à la formation du canal, via leurs domaines
transmembranaires.
Le tout forme un
récepteur–canal.
Sa particularité
physiologique est de fournir une réponse extrêmement rapide.
Exemple de la jonction
neuromusculaire :
Elle est très
bien connue grâce à des travaux sur la torpille, un poisson électrique capable
de lancer des pulsions électriques. Il possède donc un organe électrique
présentant de beaucoup de récepteurs à l’acétylcholine.
Le
récepteur nicotinique à acétylcholine est formé de 4 types de sous–unité
différents :
-
2
sous–unités a : a1 et a2 (fixation de
l’acétylcholine),
-
1
sous–unité b,
-
1
sous–unité g,
-
1
sous–unité d.
Les sous–unités
vont à la fois apporter des éléments de fixation à l’acétylcholine et former un
canal ionique.
Le
rôle des sous–unités est de transformer l’arrivée du neurotransmetteur en
dépolarisation (= potentiel post–synaptique excitateur = PPSE) Le seuil à
dépasser est –50 mV.
En microscopie électronique, on perçoit
la structure métamérique dont la taille est de 8 à 9 nm.
Les
gènes codant pour ces sous–unités et leur ARNM ont été isolés.
On a donc pu injecté les gènes dans des ovocytes de xénope (grenouille) et
observé l’expression du récepteur fonctionnel.
La connaissance
de la séquence en acides aminés permet la modélisation du récepteur :
-
Via
une 1ère étape informatique,
-
Puis
via une étape de cristallisation consistant en la production massive de la
protéine, sa cristallisation, et une diffraction aux UV.
Le récepteur à l’acétylcholine est une
référence pour ses structures transmembranaires fréquentes.
Pour ouvrir le
canal, il faut la fixation de 2 molécules d’acétylcholine. Une fois ouvert, il
laisse passer les cations et plus particulièrement l’entrée importante de Na+ et une sortie
moindre de K+.
" Il est plus
perméable au Na+ qu’au K+.
La conséquence
de cette ouverture est la génération d’un PPSE.
Exemple des récepteurs glutamatergiques :
La structure
complète n’a pas encore été établie.
v Récepteur
métabotropique :
Il est constitué d’une seule sous–unité
qui a la particularité de posséder 7 segments transmembranaires. Il
présente aussi :
-
Un
site extracellulaire de fixation du ligand,
-
Un
site intracellulaire de fixation de la protéine G.
L’activation de
ces récepteurs peut modifier la perméabilité ionique par des effets indirects,
ce qui va permettre d’activer des récepteurs ionotropiques plus distants.
v Site
de fixation du ligand :
Généralement, la
fixation se fait liaison de type : Hydrogène,
Hydrophobe,
Electrostatique,
Interaction
de Van der Waals.
Elle ne se fait pas par des liaisons
covalente (= liaison irréversible)
Il existe des
récepteurs à protéases qui le clive : l’activation est irréversible et le
blocage se fait par d’autres protéines.
Le ligand
est : – soit endogène : c’est le ligand du
récepteur,
– soit exogène : il s’agit d’un ligand
pharmacologique qui agit sur le récepteur.
Petit
bémol : Les agents pharmacologiques sont souvent décrits
pour modifier
l’activité d’un type de récepteur.
Ø Agoniste :
Il
se fixe sur le récepteur et mime les mêmes effets physiologiques du
neurotransmetteur.
Il
s’agit souvent d’analogues structuraux naturels ou artificiels.
" Action par
compétition avec le ligand endogène.
Il peut déplacer
soit un autre agoniste, soit le neurotransmetteur (ligand endogène)
Son efficacité dépend de son
affinité avec le récepteur et de sa concentration.
Le neurotransmetteur
est l’agoniste endogène du récepteur.
Ø Antagoniste :
Il s’oppose à
l’effet de l’agoniste. Souvent, il n’a pas d’effet propre : il empêche
juste l’action de l’agoniste.
Il n’existe pas d’antagonistes physiologiques ou
endogènes.
Il
existe 2 types :
-
Antagoniste
compétitif :
Il
se fixe sur le site de reconnaissance du ligand endogène. Sa concentration et
son affinité sont importantes pour la compétition.
-
Antagoniste non
compétitif :
Il se fixe sur
un site différent du site de reconnaissance et empêche l’activation du
récepteur.
L’antagoniste
est soit réversible, soit irréversible.
Mais il est
complexe de le définir.
Les affinités de
l’agoniste et de l’antagoniste sont différentes d’un récepteur à un autre, mais
elles sont surtout à dépendantes des sous–unités.
Exemple :
Les récepteurs
glutamatergiques présentent 3 types différents selon leur affinité avec
l’antagoniste.
Phénomène
post–synaptique généré par le neurotransmetteur
v Effet du neurotransmetteur
sur le récepteur métabotropique :
Ces
récepteurs sont présents SNC, mais aussi dans d’autres structures (dont SNP)
Une
protéine G est associée à ces récepteurs. Elle est composée de 3
sous–unités : a, b et g.
Elle hydrolyse
un GTP en GDP.
Au repos, la
protéine G et le récepteur sont séparés et le GTP est fixé à la sous–unité a.
ß
L’agoniste
(neurotransmetteur ou agent pharmacologique) se fixe sur le récepteur.
ß
Augmentation de
l’affinité du récepteur actif (sous–unité a) pour la
protéine G.
ß
Echange du GTP
en GDP.
-
Quand
la sous–unité a lie le GTP, elle possède une
faible affinité pour le récepteur et pour les sous–unités b et g.
-
Quand
le neurotransmetteur est fixé, la sous–unité a a une forte
affinité pour son effecteur :
-
Soit
une enzyme " Activation de 2nd
messager,
-
Soit
des canaux ioniques " Ouverture.
Þ Hydrolyse du GTP
Þ Formation du
complexe a–GDP
qui a une forte affinité pour les sous–unités b et g.
Þ Retour au
repos avec la formation du complexe a–b–g–GTP.
Le
système est plus lent car il y a beaucoup d’intermédiaires (réaction en
cascade)
Avantages :
-
Quand
l’agoniste fixe le récepteur : la protéine G échange rapidement son GTP et
se détache aussi rapidement de son complexe actif. Le récepteur est toujours
actif et peut alors activer d’autres protéines G.
" Amplification du signal.
-
Le
complexe a–GTP
peut se fixer sur plusieurs effecteurs avant que l’activité ATPasique ne se
manifeste.
Il existe différents types de protéines
G :
-
Protéines GS : Elle est couplée positivement à l’adénylate
cyclase :
" Augmentation de la synthèse de l’AMPc,
" Activation de
-
Protéines GI : Elle est couplée négativement à l’adénylate
cyclase :
" Diminution de la synthèse de l’AMPc,
" Inactivation de
-
Protéines GP :
Elle est couplée positivement à phospholipase C (PL C) :
" Augmentation de l’activité de la phospholipase
C,
" Hydrolyse de
-
En
DAG " Activation de
la protéine kinase C
-
Et
en IP3 " Libération du
stockage intracellulaire de Ca2+ contenu dans le
RE.
L’activation
de la protéine G par l’action de 2nd messagers qui peuvent modifier
l’état de phosphorylation de récepteurs ionotropiques et modifient les
caractéristiques électrophysiologiques de ces récepteurs.
v Effet du neurotransmetteur
sur le récepteur ionotropique :
Lorsque l’on a 2
compartiments, chacun est dit électriquement neutre quand la somme des charges
est nulle.
Il
existe des concentrations des ions positifs ou négatifs différentes dans chaque
compartiment. L’ion va diffuser dans le compartiment le moins concentré.
Il
existe néanmoins un déséquilibre de charges : il y a plus de charges
positives à l’extérieur qu’à l’intérieur :
-
Les
charges en excès vont chercher leur complément et se plaquent à la membrane.
-
La
membrane présente donc une face positive et une face négative.
" Capacité de
la membrane
Les
ions positifs, qui ont une tendance à vouloir entrer dans la cellule, sont
également repoussés par l’excès de charges positivement sur la face extérieure.
Pour
chaque ion, on cherche à atteindre un équilibre de forces :
-
Force
électrique
-
Force
chimique
" Force électrostatique d’un ion.
Le potentiel
d’équilibre de chaque ion peut être calculé par l’équation de Nernst :
-
Ion
K+ : –84 mV,
-
Ion
Na+ : +58 mV,
-
Ion
Cl– : –58 mV,
-
Ion
Ca2+ : +116 mV.
Si la différence
de charges correspond au potentiel d’équilibre de l’ion, il n’y a pas de
passage de cet ion.
Le potentiel d’équilibre régit les
passages ioniques dépendants du potentiel membranaire.
On définit le
gradient électrochimique (= driving
force = Vm – EION), il traduit la
force qui fait bouger l’ion.
Plus le Vm est
éloigné de EION, plus la force est importante.
Au repos :
-
Chaque
ion a un flux continuel qui est fonction du gradient électrochimique et de la
résistance : c’est la conductance de l’ion gIon.
-
La
conductance tient compte du degré d’ouverture de la membrane pour l’ion. Il
dépend de la perméabilité élémentaire du canal et du nombre de canaux ouverts.
-
Il
existe un état stationnaire quand la somme des flux est nulle : le
potentiel membranaire ne varie pas (Vm » –60 à –78 mV
selon le type cellulaire)
PPSE et
PPSI :
-
Si
le neurotransmetteur ouvre les canaux Na+ et Ca2+ :
" Augmentation de la conductance de ces canaux,
" Vm se rapproche de l'EION,
" Dépolarisation de la membrane.
Þ PPSE
-
Si
le neurotransmetteur ouvre les canaux Cl– et K+ :
" Augmentation de la conductance de ces canaux,
" Vm se rapproche de l'EION,
" Hyperpolarisation de la membrane.
Þ PPSI
La
durée, donc la quantité d’ions qui passent, et l’amplitude des PPS vont être
fonction du temps de présence du neurotransmetteur sur le récepteur.
Intégration des
messages au niveau post–synaptique :
-
Quand
on regarde au niveau d’une synapse : on a la formation d’un PPS miniature.
-
Un
neurone afférent va créer plusieurs synapse sur un autre neurone : on
obtient un PPS unitaire.
-
Plusieurs
neurones afférents vont vers UN neurone : on obtient un PPS composé.
Conduction du
PPS :
-
C’est
une conduction passive et, par contre, décrémentielle.
-
Les
PPS générés s’écoulent le long des dendrites.
-
Plus
on s’éloigne de la zone initiale d’arrivée du signal, plus il y a de pertes de
charges qui sont dues à l’existence de canaux ouverts au potentiel de repos où
l’on a des fuites d’ions.
L’objectif du
PPS est de rejoindre la zone d’intégration des signaux au niveau du corps
cellulaire : le segment initial
du neurone par des phénomènes passifs et décrémentiels.
Plus la synapse
est éloignée du segment initial, moins elle aura d’effets sur ce segment
initial (dépolarisation plus faible)
Rappel :
L’information
qui arrive à l’élément post–synaptique entraîne soit une dépolarisation, soit
une hyperpolarisation.
Sommation des
PPS :
-
Un
PPS miniature ou unitaire est insuffisant pour déclencher un PA au niveau du
segment initial.
-
Si
plusieurs synapses excitatrices sont activées, issues de plusieurs neurones, et
dont les excitations sont rapprochées dans le temps :
Þ Augmentation de la probabilité de déclencher
un PA par additivité des PPS.
-
Il
existe une somation dite linéaire si
les PPSE unitaires sont émis à des distances éloignées les uns des
autres :
" Il n’y a pas d’interaction entre les
potentiels post–synaptique.
Þ Somme algébrique des PPS.
-
Il
existe une somation dite non linéaire
si les PPSE unitaires sont émis par la même synapse ou sur des sites rapprochés :
" La synapse j est active et
va dépolariser la cellule (PPSE)
Quand
ce PPS va passer a niveau de la synapse k, le potentiel
membrane est plus positif que le membrane de repos.
Þ Effet de cette synapse k est moindre.
-
Il
existe une somation entre les PPSE et
les PPSI qui peut être linéaire ou non et qui dépend du lieu d’émission.
Cas particulier : Inhibition
silencieuse :
Quand le
potentiel d’équilibre EION est très proche
du potentiel de membrane Vm.
Exemple : Les récepteurs GABA perméables aux ions
Cl– :
S’il y a une dépolarisation membranaire,
le PPSE entraîne :
-
L’augmentation
du gradient électrochimique des ions Cl–,
-
Donc
une importante entrée de Cl– dans la
membrane,
-
Et
donc une hyperpolarisation importante de la membrane.
Il existe des
canaux ioniques non synaptiques voltage–dépendants. Ils sont capables de
s’ouvrir à partir d’un certain seuil de dépolarisation. Ils laissent donc
passer du Ca2+, du Na+ ou du K+ et donc vont
être capable de modifier le Vm.
Avec l’intégration :
-
de
l’ensemble des PPSE et PPSI, de l’ensemble synaptique de l’arborescence
dendritique et du soma,
-
et
de la somme des courants non synaptiques,
il va arriver un
degré de dépolarisation au niveau du segment initial, avec une durée plus ou
moins longue.
Le PA va naître
de la dépolarisation qui se produit au niveau du segment initial où il existe
des canaux Na+ et K+
voltage–dépendants. Ces canaux sont fermés au potentiel de repos.
-
Les
canaux Na+ vont s’ouvrir quand le Vm = –50
- –40 mV.
-
Les
canaux K+ vont s’ouvrir quand le Vm = –60
mV.
-
Si
la somme des PPSE et PPSI et des réponses des canaux non synaptiques est
inférieure à –50mV
" Il ne se passe pas de réponse.
-
Si
la dépolarisation générée par cette intégration est supérieure à –50mV
" Les canaux Na+ s’ouvrent et
créent une dépolarisation supplémentaire :
-
Cette
dépolarisation rapproche Vm de ENa+,
-
La
probabilité que les canaux Na+ s’ouvrent
augmente,
-
Puis,
les canaux Na+ s’inactivent ; les canaux K+ s’ouvrent plus
lentement,
-
Il
y a un retour à la normale.
Plus la durée de
la dépolarisation liée à l’intégration de la somme des PPSE et PPSI est, plus
le nombre de PA créés va être augmenté.

