
Retour au sommaire des cours |

Une version pdf est à votre disposition ici. |
Le système
nerveux somatique " volontaire
Le système
nerveux autonome (ou végétatif) " involontaire
Les
mouvements des muscles sont gérés par le système nerveux somatique, alors que
le maintien de l’homéostasie (équilibre) des systèmes viscéraux et la défense
contre les agressions s’effectuent principalement grâce et sous contrôle du
système nerveux autonome. Le contrôle de l’homéostasie se fait de façon
inconsciente.
« Comme si
la nature avait trouvé prudent d’éloigner ses fonctions importantes des
caprices d’une volonté imprudente. »
Claude Bernard
Le SNA ne
fonctionne pas de façon complètement autonome parce que des centres situés dans
le cerveau sont capables de réguler la fonction du SNA (dont l’hypothalamus)
Exemple : La mixion (= envie d’uriner), la défécation " On peut se retenir par la volonté.
On subdivise le
SNA en 2 parties :
-
Le
système nerveux sympathique (ou orthosympathique),
-
Le
système nerveux parasympathique.
L’activation du
système nerveux sympathique entraîne la réponse dite « combat » ou
« fuite » avec :
-
La
redistribution du débit sanguin des viscères vers les muscles squelettiques,
-
L’augmentation
de la fréquence cardiaque,
-
La
sudation,
-
La
mydriase (= dilatation de la pupille),
-
Etc.
Le
système nerveux parasympathique est plus impliqué dans la maintenance des
fonctions, en particulier la fonction gastro–intestinale. Il est activé dans
des situations relativement neutres, comme après un repas avec la sieste
digestive.
Certains auteurs individualisent le système
intestinal comme un 3ème composant du SNA. En effet, ce système
contient autant de neurone que la moelle épinière.
Sur le plan
structural, le SNA comprend des neurones organisés en nerfs, ganglions et
plexus.
Le nerf :
C’est
un amas de fibres nerveuses situé en dehors du SNC, dans lequel acheminent les
axones de neurones efférents (ou moteurs) et de neurones afférents (ou
sensitifs)
Nerf efférent (moteur) : SNC
" Effecteurs
Nerf afférent
(sensitif) : Effecteurs " SNC

Le ganglion :
C’est un amas de
somas (corps cellulaires) situés en dehors du SNC. Dans le SNA, les ganglions
sont les lieux de synapses entre 2 neurones moteurs (efférents)
Ganglion
sympathique



Le ganglion
autonome est à différencier du ganglion spinal : dans ce dernier, on
trouve le soma d’un neurone sensitif (pas de synapse)
Dans
le SNA, on trouve un plexus (= réseau de neurones) Après émergence du SNC (par
exemple : la moelle épinière) les neurones du SNA vont s’associer entre
eux et former des réseaux, appelés plexus :
-
A partir desquels émergent des
fibres, des nerfs, qui se projettent vers des effecteurs pour contrôler
leurs fonctions.
![]() Plexus cervical,
Plexus cervical,
-
Plexus
brachial,
-
Plexus
lombaire,
-
Plexus
sacré.
v Différences majeures entre
le SNA et le SNS :
j
-
Dans
le SNS, un seul neurone efférent qui le SNC et fait synapse directement avec un
muscle squelettique.
-
 Dans le SNA, il
y a 2 neurones moteurs séparés par un ganglion. Le 1er neurone
moteur quitte le SNC (neurone pré–ganglionnaire) et fait synapse avec le 2nd
motoneurone au niveau du ganglion. C’est ce dernier qui fait synapse avec un
effecteur viscéral.
Dans le SNA, il
y a 2 neurones moteurs séparés par un ganglion. Le 1er neurone
moteur quitte le SNC (neurone pré–ganglionnaire) et fait synapse avec le 2nd
motoneurone au niveau du ganglion. C’est ce dernier qui fait synapse avec un
effecteur viscéral.
k
Une
autre différence réside dans les neuromédiateurs mis en jeu. En effet, les
fibres motrices du SNS libèrent de l’acétylcholine ; alors que dans le SNA,
2 neurotransmetteurs majeurs sont mis en jeu : acétylocholine et/ou
noradrénaline (+ quelques autres neuromodulateurs)
l
-
Dans
le SNS, la transmission du signal est rapide, sur des fibres myélinisées :
conduction saltatoire et existe de canaux ioniques.
-
Dans
le SNA, la transmission est moins rapide du fait de l’existence de fibres non
myélinisées et l’existence de processus métabotropiques (= système de
transduction mettant en jeu des 2nds messagers)
m
La
plupart des organes innervés par le SNA reçoivent des neurones efférents des 2
systèmes du SNA (sympathique et parasympathique)
En règle générale, les influx transmis
par les fibres d’un des 2 systèmes stimulent l’organe alors que l’influx de
l’autre système inhibe l’activité organique.
Ainsi, dans le SNA,
on peut trouver une action excitatrice et une action inhibitrice. Ce–ci
s’oppose au SNS où l’on trouve qu’une action excitatrice (acétylcholine)
Le SNA peut
s’activer néanmoins très rapidement. Exemple : Multiplication (ou
division) par 2 de la pression artérielle en 4 secondes ; Perte de
connaissance lors d’un choc émotionnel.
v Anatomie fonctionnelle du SNA :
Ø Le
système nerveux sympathique :
Il prend son
origine dans la moelle épinière entre le 1er segment thoracique
(dorsal) et le 2ème segment lombaire (moelle thoraco–lombaire)

Rappel :
La
moelle épinière est composée de : – 8 segments cervicaux,
– 12 segments
thoraciques,
– 5 segments lombaires,
– 5 segments sacrés,
– 1 segment coccygien.
Les somas des
neurones sympathiques pré–ganglionnaires sont situés dans la substance grise au
niveau de la corne intermédio–latérale. Ces neurones se dirigent vers 2 types
de ganglions.
-
Ganglions sympathiques
latéraux vertébraux :
Ils
sont aussi appelés ganglions para–vertébraux. Ils consistent en une série de
ganglions disposés sur une rangée verticale de chaque coté de la colonne
vertébrale. Elle va de la base du crâne jusqu’au coccyx.
Cet ensemble de ganglions forme la
chaîne sympathique (ou tronc sympathique) qui ne reçoit que des neurones du
système nerveux sympathique.
La
taille, la situation et le nombre de ganglions peuvent varier mais, en général,
on trouve 23 ganglions dans chaque chaîne sympathique.
Comme les
ganglions de la chaîne sympathique sont proches de la moelle épinière, les
fibres pré–ganglionnaires sympathiques sont plutôt courtes.
-
Ganglions
sympathiques pré–vertébraux :
Ils
sont aussi appelés ganglions collatéraux. Ils se trouvent devant la moelle
épinière, près des grosses artères abdominales. Exemple : le ganglion
mésentérique supérieur, près de l’artère mésentérique supérieure.
Contrairement à
la chaîne sympathique, les ganglions pré–vertébraux ne sont pas disposés ni en
chaîne et ni en paires (exemple : ganglion splanchnique)
Après leur
émergence de la moelle épinière, les axones des neurones pré–ganglionnaires
passent dans les ganglions latéraux–vertébraux. Ils peuvent faire synapse ou
poursuivre leur chemin à travers la chaîne sympathique et aboutir dans un
ganglion pré–vertébral où ils vont faire synapse avec un 2ème
neurone post–ganglionnaire.
La
caractéristique majeure du SNA est sa distribution diffuse et capable
d’amplification. En effet, les fibres pré–ganglionnaires peuvent passer dans
plusieurs ganglions avant de faire synapse. Chacune des fibres
pré–ganglionnaires sympathiques fait synapse avec plusieurs fibres
post–ganglionnaires sympathiques. Celles–ci se rendent vers plusieurs
effecteurs viscéraux.
Les
nerfs sympathiques ne font pas synapse uniquement dans leur ganglion d’origine,
mais également dans des ganglions sub– ou sus–jacents de la chaîne sympathique.
Ainsi, la réponse du système nerveux sympathique n’est pas confinée au segment d’où
provient le stimulus.
Ce schéma de distribution permet une
réponse plus importante avec une décharge diffuse du système nerveux
sympathique.
Les
axones pré–ganglionnaires du système nerveux sympathique sont myélinisés et
quittent la moelle épinière par la racine antérieure d’un nerf rachidien avec
les fibres motrices somatiques. Après leur sortie, ces fibres pénètrent dans
une courte voie que l’on appelle le rameau
blanc (ou rameau communicant blanc) avant de passer dans le plus proche
ganglion sympathique.
Une fois que le neurone
pré–ganglionnaire fait synapse avec un neurone post–ganglionnaire, ce dernier
(non myélinisé) rejoint le nerf par la voie appelée le rameau gris (ou rameau communicant gris) et va innerver un organe
effecteur.
Ø Le
système nerveux parasympathique :
Les
fibres pré–ganglionnaires proviennent de 2 régions du SNC, notamment le tronc
cérébral et la moelle sacrée.
Le tronc cérébral est aussi appelé
mésencéphale, protubérance (ou pont) ou encore bulbe rachidien (ou médulla
oblongata) Il présente des noyaux d’où émergent 4 paires de nerfs
crâniens :
-
Les
nerfs occulomoteurs (= Nerfs III),
-
Les
nerfs faciaux (= Nerfs VII),
-
Les
nerfs glossopharyngiens (= Nerfs IX),
-
Les
nerfs vagues (= Nerfs X)
Au niveau de la
moelle sacrée, (et plus précisément à partir de la 2ème vertèbre
jusqu’à la 5ème) des neurones du système nerveux parasympathique
prennent origine et passent dans les racines antérieures des nerfs rachidiens.
-
Ganglions parasympathiques :
Ce
sont les ganglions terminaux situés à proximité de l’organe cible, ou dans la
paroi de celui–ci. Cette localisation indique que les neurones
pré–ganglionnaires parasympathiques sont plutôt longs (à l’opposé du système
sympathique)
Dans ces
ganglions terminaux, le neurone pré–synaptique fait habituellement synapse avec
4 ou 5 neurones post–ganglionnaires qui innervent généralement un seul organe.
Ainsi, les effecteurs du système parasympathique ont tendance à être plutôt
localisés.
-
Les
fibres parasympathiques des nerfs III innervent les sphincters de la pupille
ainsi que les muscles ciliaires. Ces fibres font synapse au niveau du ganglion
ciliaire.
-
Les
fibres des nerfs V innervent les glandes lacrimales, nasales et salivaires
(sub–mandibulaires)
-
Les
fibres des nerfs VII font synapse au niveau de 2 ganglions principaux : le
ganglion ptérygo–palatin et le ganglion sub–mandibulaire.
-
Les
fibres des nerfs IV innervent essentiellement la glande parotide et le ganglion
mis en jeu : le ganglion optique.
-
Les
fibres des nerfs X (dont leur origine est le bulbe rachidien) sont les plus
importantes du système nerveux parasympathique. Elles assurent • du trafic de
l’innervation parasympathique (cœur, rate, rein, tube digestif, foie, etc.)
Elles se projettent sur des ganglions terminaux au sein de l’organe.
-
Les
fibres parasympathiques de la moelle sacrée se ressemblent pour former les
nerfs pelviens qui se projettent au niveau du colon, du rectum, de la vessie,
des uretères et des organes génitaux.
Ø Le
système nerveux sympathique VS le système nerveux parasympathique :
Le système
sympathique :
Il est
thoraco–lombaire.
Les ganglions sont près de la moelle
épinière.
Les fibres
pré–ganglionnaires sont courtes.
Il y a une amplification du signal.
Le système parasympathique :
Il est
crânio–sacré.
Les ganglions
sont terminaux.
Les fibres
pré–ganglionnaires sont longues.
Le signal est localisé.
v Transmission nerveuse du
SNA :
Le SNA met en
jeu des messagers chimiques (= neurotransmetteurs) dont l’acétylcholine et la
noradrénaline.
-
Les
neurones cholinergiques comprennent :
-
tous
les neurones pré–ganglionnaires du système sympathique et parasympathique,
-
tous
les neurones post–ganglionnaires parasympathiques
-
et
quelques neurones post–ganglionnaires qui innervent notamment les glandes
sudoripares ainsi que certains vaisseaux sanguins au niveau des organes
génitaux et certains muscles squelettiques.
-
Les
neurones noradrénergiques sont des neurones post–ganglionnaires sympathiques.
L’acétylcholine
et la noradrénaline n’ont pas toujours le même effet excitateur ou inhibiteur.
En effet, la réaction des effecteurs dépend non seulement du neurotransmetteur
mis en jeu, mais aussi des récepteurs présents (2 types de récepteurs pour
chaque neurotransmetteur)
L’effet va dépendre de la présence
(degré d’expression) de tel ou tel récepteur.
Ø Le
système nerveux cholinergique :
L’acétylcholine
est synthétisée par le biais d’une réaction catalysée par
La libération d’acétylcholine
se fait par une dépolarisation pré–synatique. Elle est dépendante du Ca2+. Une fois dans
la fente, l’acétylcholine se lie à ses récepteurs ou est dégradée par une
enzyme : l’acétylcholine_estérase.
Il existe 2
classes de récepteurs : les récepteurs cholinergiques (choline) et les
récepteurs muscariniques (muscarine)
-
Les récepteurs
nicotiniques :
Ils appartiennent à la famille des
récepteurs canaux ioniques sensibles aux cations. Ces récepteurs canaux sont
composés de 2 sous–unités : a et b.
Ils sont
présents dans les neurones post–ganglionnaires et les cellules de la
médullo–surrénale et relaient toujours une excitation de l’acétylcholine.
-
Les récepteurs
nicotiniques :
Ils sont de type métabotropique. La
transduction est plus lente que pour le récepteur canal. Ils sont localisés
dans tous les effecteurs qui sont innervés par des neurones post–ganglionnaires
parasympathiques. Il existe plusieurs classes dont 5 clonées (M1 à M5,
avec une prédominance de M2)
Ils sont
présents dans les viscères et peuvent relayer une stimulation ou une inhibition
de l’acétylcholine selon l’organe. Exemple : stimulation de l’iris,
inhibition du cœur.
Ø Le
système nerveux noradrénergique :
La noradrénaline
est synthétisée à partir de la tyrosine captée activement par les neurones
catécholaminergiques. La libération se fait par une dépolarisation neuronale
via un mécanisme Ca2+–dépendant. Une
fois dans la fente synaptique, l’adrénaline ou la noradrénaline se fixe à ses
récepteurs ou est recaptée au niveau pré–synaptique ou bien est dégradée par
une monoamine oxydase.
Il existe 2
types de récepteurs adrénergiques a et b, classés en a1, a2, b1, b2 et b3. Ce sont des
récepteurs métabotropiques.
-
Les
récepteurs a2 sont
pré–synaptiques mais également dans des tissus non nerveux.
-
Les
récepteurs b1 sont des
récepteurs cardiaques.
-
Les
récepteurs b2 sont situés au
niveau de l’arbre bronchique et les cellulaires musculaires lisses de certains
vaisseaux.
![]()
Le système de
transmission n’implique pas que l’acétylcholine et la noradrénaline, mais aussi
des neuromodulateurs qui vont réguler finement la transmission.
Exemple :
ATP, VIP
(Vasoactive Intestinal Peptide), substance P, sérotonine (5_HT), neuropeptide
Y, GABA, dopamine, monoxyde de carbone.
Plusieurs
neurotransmetteurs peuvent être localisés dans un même nerf. Les combinaisons
fréquentes sont ATP – Adrénaline – peptide Y (pour un nerf sympathique) et
Acétylcholine – VIP (pour un nerf parasympathique)
Elles ont une action dans le cadre d’une
cotransmission ou dans le cadre d’une neuromodulation.
Exemple :
La
noradrénaline et l’ATP sont des cotransmetteurs dans certains organes. Ils sont
libérés par les mêmes nerfs et agissent sur des récepteurs spécifiques
(récepteurs de type P2 pour l’ATP) Ils entraînent une vasoconstriction composée
de 2 phases :
-
Une
composante rapide induite par l’ATP (récepteurs liés à des canaux Ca2+–dépendants)
-
Une
composante plus lente relayée par la noradrénaline qui met en jeu des
récepteurs métabotropiques.
La
neurotransmission peut être modifiée par des neuromodulateurs (soir des
hormones, soit des neurotransmetteurs libérés par le neurone ou nerf voisin,
soit des produits de l’organisme) Ces neuromodulateurs peuvent
intervenir :
-
Soit
avant la synapse afin de modifier la quantité de neurotransmetteurs libérés,
-
Soit
après la synapse (compartiment post–synaptique) en modifiant l’ampleur ou la
durée de l’effet du neurotransmetteur.
Exemple :
Le neuropeptide
Y (NPY) coexiste avec la noradrénaline et l’ATP. Cependant sur certains
vaisseaux, le NPY ne possède que peu d’effet propre. En effet, il agit au
niveau pré–synaptique pour inhiber la libération de la noradrénaline. Il peut
aussi agir au niveau post–synaptique pour amplifier l’effet de la
noradrénaline. Il n’a pas d’effet propre
et agit sur la réponse.
Le
SNA (sympathique ou parasympathique) est mis en jeu dans certaines conditions
comme le stress :
-
Le
SNA sympathique fait augmenter la fréquence cardiaque et la pression
artérielle, dilate l’arbre bronchique et détourne le sang depuis les viscères vers
les muscles squelettiques.
-
Le
SNA parasympathique conserve l’énergie, maintient la fonction des organes et
soutient les processus végétatifs.
La plupart des
organes possèdent une double innervation (sympathique et parasympathique) dont
les effets sont fréquemment opposés.
Exemple : L’œil :
-
Une
stimulation sympathique contracte les fibres radiaires de l’iris, entraînant la
dilatation de la pupille (lors d’un stress)
-
Une
stimulation parasympathique provoque une contraction des muscles circulaires de
l’iris, entraînant la fermeture de la pupille (lors d’une luminosité intense)
La médullo–surrénale :
C’est une glande
située au–dessus des reins. Elle produit une libération importante d’adrénaline
et de noradrénaline au niveau de la circulation sanguine systématique,
entraînant une action de l’adrénaline et de la noradrénaline sur l’ensemble de
l’organisme.
Une
stimulation sympathique provoque une augmentation de l’adrénaline et de la
noradrénaline. Les effets de ces 2 transmetteurs sont quais–identiques mais
présentent quelques différences :
" L’adrénaline (effet b) possède un
grand effet cardiaque, plus important par rapport à la noradrénaline.
L’adrénaline est un faible vasoconstricteur (par rapport à l’intense
vasoconstriction de la noradrénaline) et possède un effet métabolique plus
important que la noradrénaline. En effet, elle acive 5 à 10 fois plus le
métabolisme cellulaire par rapport à la noradrénaline.
Ces
effets différents ne vont pas dépendre uniquement de la concentration, mais
aussi des classes de récepteurs et de leurs sous–classes.
Ces effets sont
durables et plus intense par rapport à une stimulation parasympathique. Ceci
est dû à la disposition diffuse du ganglion du système nerveux
sympathique :
-
La
noradrénaline a une demi–vie (au niveau de la synapse) plus importante que
l’acétylcholine.
-
L’adrénaline
et la noradrénaline sécrétées par la médullo–surrénale vont intensifier
l’action de la noradrénaline libérée par le neurone post–ganglionnaire
sympathique.
v Tonus basal :
L’activité basale
su système sympathique et parasympathique est connue sous le nom de tonus sympathique ou parasympathique.
La modulation de ce tonus basal permet
d’augmenter ou de diminuer l’activité d’un organisme.
Exemple :
Le tonus
sympathique maintient le système artériolaire contracté à environ la moitié du
diamètre de base des artères. En augmentant la stimulation sympathique, ces
vaisseaux (artères) se contracte d’avantage. En diminuant le système
sympathique, ces vaisseaux se dilatent.
Selon
l’organe, on va avoir un tonus dominant (sympathique ou parasympathique) :
|
|
|
Tonus prédominant : |
|
Système vasculaire (artères et veines) |
" |
Tonus sympathique |
|
Tube digestif |
" |
Tonus parasympathique |
|
Utérus |
" |
Tonus parasympathique |
|
Vessie |
" |
Tonus parasympathique |
|
Glandes salivaires |
" |
Tonus parasympathique |
Le tonus
sympathique du système vasculaire est maintenu grâce à une innervation directe.
En plus, la présence de l’adrénaline et de la noradrénaline libérées par la
médullo–surrénale intervient dans le maintien du tonus sympathique basal.
Libération
basale : Adrénaline : 0,2 µg.kg–1.min–1
Noradrénaline :
0,05 µg.kg–1.min–1
" Il y existe un
maintien d’une pression artérielle assez élevée même en absence d’une
innervation sympathique directe.
Ø Caractérisation
du tonus de base du SNA :
§ Effet du tonus
parasympathique sur le tube digestif :
S’il y a une
destruction du nerf vague, cela entraîne une atonie importante et durable de
l’intestin (absence de mouvements intestinaux), ce qui provoque une baisse de
la vitesse de propulsion du bol alimentaire (= constipation sévère)
Si on procède à
une dénervation locale, l’organe innervé va perdre son tonus basal.
Pour la pression
artérielle, la section du système sympathique provoque immédiatement une
vasodilatation majeure. Cependant, quelques temps après la section sympathique,
le tonus intrinsèque du muscle lisse vasculaire augmente provoquant ainsi une
vasoconstriction : les vaisseaux retrouvent leur diamètre de base.
Ce mécanisme
compensatoire existe dans la plupart des organes effecteurs lorsque le tonus
basal a disparu. Cependant, au niveau parasympathique, cette compensation
nécessite plusieurs mois pour être efficace.
Exemple :
La
dénervation (chez le chien) au niveau cardiaque provoque une tachycardie (=
augmentation de la fréquence cardiaque) Le retour à une fréquence normale
s’effectue après 6 mois.
Après la
destruction du système sympathique ou parasympathique, l’organe innervé devient
de plus en plus sensible à l’injection de noradrénaline ou d’acétylcholine. Ce
phénomène est appelé hypersensibilité à
la dénervation. Elle est variable d’un organe à un autre, en terme
d’évolution temporelle, mais aussi en terme d’amplitude d’hypersensibilité.

400
200
1 2 3 4 5 6
7
Un des
mécanismes est la sur–expression des récepteurs à noradrénaline pour compenser
ces réductions du transmetteur.
v Notion de réflexe
autonome :
Le
SNA est un système bidirectionnel avec une composante motrice (du SNC vers
l’organe) et une composante sensorielle (de l’organe vers le SNC)
Le maintien de l’homéostasie de l’organe
nécessite un flux continuel des informations en provenance des effecteurs.
La
composante afférente est formée de neurones sensitifs dont la plupart est
associée à des intérocepteurs (chimiorécepteurs ou mécanorécepteurs) qui vont
transmettre l’information via un neurone sensitif vers le SNC.
Ces signaux
afférents ne sont pas reconnus consciemment, bien que l’action intense de ces
récepteurs puisse provoquer des sensations de douleur (= sensation consciente)
La
plupart des fonctions viscérales sont sous le contrôle de réflexes autonomes
qui réajustent l’activité de l’effecteur. Un réflexe autonome comprend 5
composantes (= Arc réflexe)
La plupart des réflexes n’atteignent pas
le cortex central (= non conscient)


Il
existe plusieurs réflexes au niveau cardiovasculaire qui permet le contrôle de
la pression vasculaire et la fréquence cardiaque.
Exemple : Le réflexe des barorécepteurs :
Ce sont des
mécanorécepteurs sensibles à l’étirement de la paroi vasculaire présents dans
l’aorte et les carotides. Quand la pression artérielle augmente, une
information remonte au SNC pour inhiber le système nerveux sympathique et ainsi
faire baisse la pression artérielle et la fréquence cardiaque.
C’est une
réaction inconsciente, mais le SNA n’est pas complètement isolé du système
nerveux volontaire (SNS)
v Contrôle du SNA par les
centres du SNC :
Sur
le plan anatomique, il existe plusieurs axones en provenance de plusieurs
centres du SNC (cerveau) qui exercent une régulation importante.
L’hypothalamus exerce la
principale régulation, c’est–à–dire qu’il est le principal centre de régulation
et d’intégration du SNA.
Les informations
en provenance de l’hypothalamus influence les centres autonomes situés au
niveau du tronc cérébral et de la moelle épinière.
L’hypothalamus
est une structure centrale parce qu’elle reçoit des informations des centres
supérieurs (comme le cortex cérébral) liées à l’émotion, au changement de
température, l’olfaction, etc. qu’elle intègre et envoie au tronc et le moelle
épinière.
Dans l’hypothalamus, l’émotion est
traduite en des signaux neuroniques ou hormonaux.
Sur
le plan anatomique, la partie postéro–latérale de l’hypothalamus est reliée au SNA
par les axones de neurones dont le corps cellulaire et les dendrites se
trouvent dans différents noyaux de l’hypothalamus.
Ces axones forment des faisceaux qui
relient l’hypothalamus aux noyaux sympathiques et parasympathiques du tronc
cérébral ainsi que de la moelle épinière par l’intermédiaire de relais situés
dans une structure appelée la formation
réticulée.
Exemple :
Les
parties postérieure et latérale de l’hypothalamus vont essentiellement moduler
le SNA :
-
Augmentation
de la fréquence cardiaque,
-
Augmentation
de la pression artérielle,
-
Augmentation
de la température,
-
Augmentation
de la température,
-
Dilatation
de la pupille et
-
Inhibition
du tube digestif.
Les
parties antérieure et médiane contrôle plutôt le système parasympathique :
-
Baisse
de la fréquence cardiaque,
-
Baisse
de la pression artérielle,
-
Constriction
de la pupille et
-
Augmentations
de la sécrétion et de la motilité des mouvements du tube digestif.
Þ L’hypothalamus régule les fonctions
sympathiques et parasympathiques.
La
régulation du SNA par le cortes cérébral (= couche extérieure du cerveau) se
produit essentiellement en cours d’un stress émotif (anxiété extrême)
Le cortex va stimuler l’hypothalamus en
tant que la structure en tant que structure du système limbique (= où les réponses sont liées à l’émotion ou la
mémoire) qui stimule à son tour les centres cardiaques (au niveau du bulbe
rachidien) et va entraîner, par exemple, l’augmentation de la fréquence, de la
force des battements ainsi qu’une augmentation de la pression artérielle.
Exemple :
L’utilisation du
yoga permet la capacité de contrôler du rythme cardiaque.
Il s’agit d’une
fonction végétative est régulée par le SNA mais également par le SNC.
v Rappel :
La
respiration est l’échange de gaz entre l’atmosphère, le sang et les cellules de
l’organisme. Elle comprend 3 phases :
-
La
ventilation pulmonaire qui
correspond aux échanges de gaz entre l’atmosphère et le poumon = Inspiration et expiration,
-
La
respiration pulmonaire externe qui
correspond aux échanges de gaz entre les poumons et le sang,
-
La
respiration interne qui correspond
aux échanges de gaz entre le sang et les cellules de l’organisme.
Sur le plan
anatomique, le système respiratoire comprend le nez (cavité nasale), le
pharynx, le larynx, la trachée, les bronches et les poumons.
Ø Les
bronches :
-
C’est
là où va s’exercer un contrôle nerveux. La trachée se subdivise en 2 bronches souches (droite et gauche)
-
A
l’endroit où les branches pénètrent dans les poumons, les bronches souches se
subdivisent en bronches plus petites : les bronches lobaires (ou secondaires)
-
Celles–ci
se ramifient à leur tour et forment des bronches encore plus petites : les
bronches segmentaires (ou tertiaires)
-
Celles–ci
se subdivisent encore pour forment les bronchioles.
-
Celles–ci
se subdivisent pour forment les bronchioles
terminales.
Plus les
bronches diminuent de diamètre, plus le nombre de muscles lisses augmente, ce
qui va permettre un contrôle plus fin des diamètres des bronches.
Ø Les
poumons :
Ils sont
enveloppés par 2 membranes (ou feuillets) appelés les membranes pleurales (ou
plèvres) :
-
La
membrane externe s’appelle la plèvre pariétale et est attachée au thorax,
-
La
membrane interne s’appelle la plèvre viscérale et recouvre les poumons.
-
Entre–deux
se situe la cavité pleurale qui joue un rôle important dans les mouvements des
poumons lors de la respiration.
En fait, les
poumons sont formés par un ensemble de lobules
qui apparaissent à la surface sous forme d’hexagone. Chacun est entouré de
tissu conjonctif et il y a un faisceau lymphatique, une artériole, une veinule
et une branche d’une bronchiole terminale.
En
effet, les bronchioles terminales se subdivisent encore une fois en bronchioles
microscopiques : les bronchioles
respiratoires. Celles–ci se subdivisent une dernière fois en canaux alvéolaires.
C’est à ce niveau là que l’on va trouver
des alvéoles regroupées en sacs alvéolaires et qui sont disposées
autour de la circonférence des canaux alvéolaires.
C’est au niveau
des alvéoles que les échanges gazeux entre les poumons et le sang s’effectuent
par diffusion à travers la paroi des alvéoles et des capillaires. Cette paroi
est appelée la paroi (ou membrane) alvéolo–capillaire, avec une épaisseur
moyenne de 0,5 µm. Cette minceur est importante dans l’efficacité des échanges
gazeux.
Il y a environ
300 millions d’alvéoles pulmonaires, soit environ
Ø L’apport
sanguin au niveau des poumons :
L’apport
artériel au poumon provient de l’artère pulmonaire qui se subdivise plusieurs
jusqu’à former des capillaires. Le retour veineux (avec du sang oxygéné) se
fait par les veines pulmonaires (supérieure et inférieur) L’ensemble de ces
veines se déverse dans l’oreillette gauche.
Ø L’innervation
des poumons :
Les poumons sont
richement innervés : riche innervation parasympathique et quelques fibres
sympathiques.
Ces
fibres nerveuses entrent dans chaque poumon par le plexus pulmonaire situé à la racine du poumon et cheminent le long
des conduits bronchiques, mais également le long des vaisseaux pulmonaires.
Les fibres parasympathiques produisent
essentiellement une constriction des bronches ; alors que les fibres
sympathiques provoquent plutôt une dilatation des bronches.
v L’inspiration :
L’inspiration
est induite par un mouvement musculaire et permet l’élimination du CO2 (produit au
cours d’une activité cellulaire) et l’alimentation de ces cellules en O2.
La circulation
d’air entre l’atmosphère et les poumons se fait selon un gradient de pression,
c’est–à–dire d’une haute pression vers une basse pression.
Le mouvement est subdivisé en 2
phases :
-
L’inspiration
qui correspond à la pénétration de l’air dans les poumons,
-
Juste
avant l’inspiration, la pression de l’air dans les poumons est égale à la
pression de l’air dans l’atmosphère (
Pour
que l’air puisse entrer dans les poumons, il faut générer un gradient de
pression : la pression dans les poumons doit devenir supérieure à celle de
l’atmosphère.
Cette différence
de pression est créée par une augmentation du volume des poumons suite à une
dilatation pulmonaire. Celle–ci nécessite la contraction des principaux muscles
inspiratoires (le diaphragme et les muscles intercostaux externes)
Le
diaphragme est une couche de muscles squelettiques qui forme le plancher de la
cavité thoracique. Lorsqu’il se contracte, il s’aplatit et son dôme s’abaisse.
Ce mouvement entraîne un agrandissement du diamètre vertical de la cavité
thoracique. Il est responsable de l’entrée de ’ de l’air dans
les poumons.
En même temps
que la contraction du diaphragme, les muscles intercostaux externes se
contractent également. Conséquences : il y a un soulèvement des côtes et
le sternum est poussé vers l’avant. Ce mouvement entraîne un agrandissement du
diamètre horizontal (ou antéro–postérieur) de la cavité pulmonaire.
Ces
muscles sont mis en jeu lors d’une inspiration normal (= eupnée) Au cours d’une inspiration forcée, les muscles
inspiratoires accessoires participent à une augmentation du volume pulmonaire.
Ces muscles sont
les muscles sterno–cléido–mastoïdiens
et les muscles scalènes. Quand ils
se contractent, les côtes supérieures sont tirées vers le haut. Cela entraîne
une augmentation supplémentaire du volume de la cage thoracique.
L’inspiration
est un phénomène actif, car elle est déclenchée par une contraction musculaire.
A l’opposé, l’expiration est un phénomène passif, car il est dû à un
relâchement des muscles inspiratoires.
Lorsque le
volume pulmonaire augmente, la pression intrapulmonaire passe de 760 à
v L’expiration :
Elle
est considérée comme étant un processus passif puisqu’il ne nécessite pas de
contraction musculaire.
En effet, l’expiration commence avec le
relâchement des muscles inspiratoires, ce qui entraîne une réduction du volume
vertical et horizontal de la cavité thoracique qui retrouve son volume
original.
L’expiration
peut devenir un processus actif. Lors d’un effort physique ou lorsque le
mouvement d’air est inhibé, cela provoque une expiration forcée avec la mise en
jeu de muscles squelettiques (les muscles
intercostaux internes) qui abaissent les côtes.
Il y a également la contraction les muscles abdominaux qui déplacent les
côtes inférieures vers le bas et compriment les viscères abdominales, ce qui
entraîne une élévation du diaphragme.
Après le
relâchement des muscles inspiratoires, la pression intrapulmonaire augmente
(762 –
v Régulation :
Il existe 2
types de régulation : une régulation nerveuse et une régulation
métabolique.
Ø Régulation
nerveuse :
Les
dimension du thorax sont effectuées par l’action des muscles respiratoires qui se
contractent et se relâchent sous l’effet d’influx nerveux issu de centres
situés en position bilatérale dans le tronc cérébral : les centres respiratoires. Ils sont
subdivisés en 3 régions :
-
Le
centre de rythmicité bulbaire,
-
Situés tous les 2 au niveau du pont
(= protubérance)![]()
Le
centre pneumotaxique,
-
Le
centre apneustique.
La
cartographie de ces centres respiratoires remonte au 2ème siècle.
Galien constata que la section sous–bulbaire entraîne l’arrêt respiratoire.
Depuis, plusieurs travaux précisent la cartographie des centres respiratoires.
2 approches ont
été utilisées :
-
La
destruction sélective de différentes régions, permettant l’étude de l’impact
des différentes structures,
-
La
mesure de l’activité des neurones dans telle ou telle structure.
En
1922, les travaux de Lumsden sont les plus complets pour localiser les centres
respiratoires. Il utilisa la 1ère approche en effectuant des
sections étagées au niveau du tronc cérébral :
-
Section
très haute (section sus–pontique)
" Aucune
altération du régime ventilatoire
-
Section
du nerf vague (= vagotomie)
" Respiration
plus ample et plus lente
Þ Le nerf vague
module le rythme respiratoire de base.
-
Section
médiopontique (avec le nerf vague intact)
" Léger
ralentissement de la fréquence respiratoire et augmentation du volume courant
-
Section
médiopontique avec le nerf sectionné
" Soit apnée en
phase inspiratoire, soit crampes respiratoire (= spasmes interrompus par de
brusques expirations)
-
Section
entre le pont et le bulbe rachidien
" Pas de
différence que le nerf vague soit intact ou non, respiration entrecoupée de
nombreux soupirs
-
Section
entre le bulbe et la moelle épinière
" Arrêt
respiratoire
Þ Séparation
des centres respiratoires et des structures sous–jacentes,
Suggestions de la présence de 3 centres
respiratoires.
-
Le
centre bulbaire qui automatise la respiration. Il peut être divisé en centre
inspiratoire et en centre expiratoires,
-
Le
centre pneumotaxique qui facilite l’expiration,
-
Le
centre apneustique qui facilite l’inspiration,
-
Avec,
en plus, le nerf vague qui a un rôle facilitateur de l’expiration.
§ Le centre de rythmicité
bulbaire :
Il s’agit du
centre où siège la régulation du rythme de base de la respiration. Au repos,
l’inspiration dure environ 2 secondes, et l’expiration environ 3 secondes. Il y
a 10 à 15 cycles respiratoires par minutes.
On
y trouve 2 types de neurones :
-
Les
neurones inspiratoires qui forment le centre inspiratoire, appelé aussi le
groupe respiratoire dorsal,
-
Les
neurones expiratoires qui forment le centre expiratoire, appelé aussi le groupe
respiratoire ventral.
Il y a, en plus,
l’existence de neurones inspiratoires dans le centre expiratoire.
Le
rythme de base de la respiration est déterminé par des influx nerveux produits
dans le centre inspiratoire.
Au début de l’expiration, les neurones
du centre inspiration sont inactifs. Toutefois, au bout de 3 secondes (soit à
la fin de l’expiration), ces neurones deviennent soudainement et
automatiquement actifs. Ce sont des neurones autorythmiques.
En
effet, quand on bloque toutes les connexions nerveuses vers ces centres
inspiratoires, ces neurones inspiratoires continuent à décharger de façon
rythmique. Ils sont doués d’une excitabilité intrinsèque.
Soit ces neurones possèdent un rythme
endogène, soit le rythme est crée par des interneurones inhibiteurs.
En
général, ce sont des neurones qui possèdent un potentiel membranaire au repos
assez positif. Les influx nerveux en provenance des centres inspiratoires
actifs durent environ 2 secondes et se dirigent vers les muscles inspiratoires.
Ils sont
véhiculés par des nerfs spécifiques :
-
Le
nerf phrénique qui innerve le diaphragme,
-
Les
nerfs intercostaux qui innervent les muscles intercostaux externes.
Quand les influx
nerveux atteignent les muscles respiratoires, ceux–ci se contractent. Au bout
de 2 secondes, ces influx nerveux n’arrivent plus et les muscles se relâchent.
Ceci
implique que le rôle des neurones expiratoires n’est pas très clair parce que
l’expiration est un processus passif déclenché par le relâchement des muscles
inspiratoires.
En théorie, dans une respiration
normale, les neurones expiratoires restent inactifs.
Cependant,
lors d’une respiration forcée, des influx nerveux en provenance des centres
inspiratoires activent les centres expiratoires qui envoient alors un influx
nerveux vers les muscles expiratoires (les muscles
abdominaux et les muscles
intercostaux internes)
Cela permet une respiration forcée.
§ Le centre
pneumotaxique :
Il
a pour rôle la coordination de la transition entre l’inspiration et
l’expiration. Il transmet constamment des l’influx inhibiteurs au centre
inspiratoire favorisant ainsi le passage de l’inspiration vers l’expiration,
avant que les poumons ne contiennent un volume d’air excessif.
Les influx nerveux de ce centre limitent
l’inspiration et favorisent l’expiration. Lorsque ce centre est sur–stimulé, la
fréquence respiratoire augmente. A l’inverse, la respiration devient plus
lente.
Þ Il facilite l’expiration est contrôle le
volume des poumons.
§ Le centre apneustique :
Il
a un rôle facilitateur de l’inspiration. Il envoie des influx nerveux stimulateurs
vers les centres inspiratoires pour activer et prolonger l’inspiration et
inhiber l’expiration.
L’action de ce centre est visible quand
le centre pneumotaxique est inactif. En effet, quand ce dernier est actif, il
l’emporte sur le centre apneustique.
§ Résumé :
Les
centres respiratoires sont composés d’un centre essentiel (le centre
bulbaire) et de 2 centres régulateurs.
Plusieurs modèles ont été proposés pour
expliquer le fonctionnement de ces différents composants. Le modèle le plus
cité est le modèle de Van Euler, appelé aussi modèle d’inhibition phasique.
Ce modèle fait
intervenir un générateur d’activité inspiratoire et un système d’interruption
de l’inspiration.
·
Le
générateur d’activité :
Selon ce modèle,
cette structure est composée de structures chémosensibles qui reçoivent des
afférences multiples, que ce soit des afférences centrales ou bien des
afférences périphériques (comme les corpuscules carotidiens sensibles à la
pression des gaz)
Le générateur
envoie des influx nerveux vers les neurones de types a et b situés au
niveau du centre inspiratoire.
·
L’interrupteur
de l’inspiration :
Il
reçoit des afférences vagales qui transitent par les cellules inspiratrices de
type b
et également des afférences du centre pneumotaxique qui ont pour rôle
d’abaisser le seuil d’excitabilité du système d’interruption de l’inspiration.
Selon
ce modèle, le générateur d’activité inspiratoire central stimule les cellules
de type a
du centre inspiratoire et donc provoque une inspiration.
Mais ce générateur stimule également les
cellules de type b dont la stimulation va être
transmise vers le système d’interruption de l’inspiration. Cela provoque
l’inhibition phasique du générateur et donc entraîner l’expiration.
A la fin de
l’expiration, l’interrupteur n’est plus activé et le générateur reprend.

Le
nerf vague est sensible à l’état de distension des poumons. Une fois que ces
poumons sont remplis, des mécanorécepteurs (situés au niveau des bronches) sont
stimulés et envoient des influx nerveux, via le nerf vague, vers les centres
respiratoires.
Ces influx nerveux facilitent le passage
de l’inspiration vers l’expiration. Ils facilitent donc l’expiration.
§ Régulation consciente :
Il s’agit d’une
régulation nerveuse corticale. Elle est relativement limitée : on ne peut
pas se donner volontairement la mort par un arrêt respiratoire.
D’autres
types d’influx nerveux en provenance de l’hypothalamus et du système limbique stimulent
les centres respiratoires.
Ils permettent à des stimuli émotionnels
de modifier la respiration.
Ø Régulation
chimique (ou métabolique) :
Certains stimuli
chimiques modifient l’amplitude et la fréquence respiratoire. L’objectif ultime
de la respiration est de maintenir des taux constants de gaz.
Le
système respiratoire est sensible au taux de CO2 dans le sang,
car le CO2 est très liposoluble et très
diffusible.
Une augmentation du taux de CO2 entraîne une
production de protons et donc une acidification du milieu.
Il existe une
région au niveau du bulbe rachidien, appelé le centre chimiosensible central, qui est très sensible aux variations
de pH. Elle envoie un influx nerveux aux centres respiratoires pour adapter la
respiration afin de rétablir le pH.
Il existe
d’autres centres chimiosensibles au niveau des corps carotidiens. Les
changements de pH au niveau plasmatique vont être détectés par ces centres qui
vont envoyer un influx nerveux au centre respiratoire pour rétablir
l’homéostasie du pH et du CO2.
Le
système digestif présente autant de neurones que dans la moelle épinière. Il
remplit 5 fonctions principales :
-
L’ingestion qui correspond
à l’entrée de la nourriture,
-
Le mouvement de
la nourriture
le long du tube digestif (où s’effectue la régulation nerveuse),
-
La digestion qui correspond de la
transformation de la nourriture par des processus chimiques et physiques,
-
L’absorption qui correspond
au passage de la nourriture digérée du tube digestif vers les systèmes
vasculaire et lymphatique.
-
La défécation qui correspond à l’exclusion
des substances non digérées.
La
digestion mécanique désigne les divers mouvements du tube digestif, y compris
les mouvements assurés par les muscles lisses de l’estomac et de l’intestin
grêle.
Ces mouvements pétrissent les aliments
et les mélangent aux enzymes qui effectuent la digestion.
La digestion
chimique désigne toute une série de réactions cataboliques qui implique des
enzymes. Elle permet la transformation de grosses molécules en petites
molécules qui vont être absorbées par l’organisme.
v Organisation
générale :
Les
organes digestifs peuvent être divisés en 2 groupes principaux :
-
Le
tube digestif est formé par plusieurs organes, y compris la bouche, le pharynx,
l’œsophage, l’estomac, l’intestin grêle et le gros intestin.
-
Les
organes annexes qui comprennent les dents, la langue, les glandes salivaires,
le foie, la vésicule biliaire et le pancréas.
A part les dents
et la langue, les organes annexes ne rentrent jamais en contact direct avec la
nourriture, mais ils sécrètent des enzymes.
L’organisation
des tissus qui forment le tube digestif est fondamentalement la même depuis
l’œsophage jusqu’au canal anal. En fait, on va trouver 4 couches (ou tuniques)
qui forment le tube digestif.
Couche superficielle ou interne (Lumière du tube digestif)![]()
Ces
couches sont :
-
La
muqueuse,
-
La
sous–muqueuse,
-
La
musculeuse,
-
Couche profonde ou externe
La
séreuse.
La
muqueuse est formée par 3 couches :
-
L’épithélium
de revêtement qui un rôle de protection du tube digestif mais aussi de
sécrétion,
-
Le
chorion qui est l’épithélium de soutien,
-
La
musculaire muqueuse qui est formée de cellules musculaires lisses.
La
sous–muqueuse est formée de tissu conjonctif qui relie la muqueuse à la
musculeuse. Elle est richement vascularisée et contient une partie d’un plexus
(= réseau de neurones) appelé plexus
sous–muqueux (également appelé plexus
de Meissner)
Ce plexus renferme des fibres qui
appartiennent au SNA et qui innervent la musculaire muqueuse. Il a un rôle
essentiellement sensitif, bien qu’il possède des fibres motrices. L’ensemble
des fibres joue un rôle important dans la sécrétion du tube digestif.
La
muqueuse de la bouche, du pharynx et de la partie supérieure de l’œsophage est
formée en partie de muscles squelettiques. Ils sont impliqués dans le contrôle
volontaire responsable de la déglutition.
On retrouve des muscles squelettiques au
niveau de l’anus. Ils constituent le sphincter, permettant le contrôle
volontaire de la défécation.
Dans
le reste du tube digestif, la musculeuse est formée de muscles lisses
habituellement disposés en 2 couches (sauf au niveau de l’estomac où il y en a
3) :
-
Une
couche interne constituée par des fibres circulaires,
-
Deux
couches externes constituées par des fibres longitudinales.
C’est la
contraction involontaire de ces fibres musculaires qui est responsable de la
transformation physique des aliments, leur mélange avec les sécrétions
digestives et la propulsion des aliments dans le tube digestif.
Ces
fibres lisses présentent une caractéristique structurale qui consiste en la
présence de nexus. Ce sont des
contacts étroits entre 2 cellules musculaires lisses, c’est–à–dire des zones où
les membranes de 2 cellules musculaires lisses sont collées.
Ces contacts
sont labiles : ils peuvent se faire et se défaire.
Ce sont des contacts de synapses
électriques, permettant la propagation du PA et donc du signal entraînant le péristaltisme (qui correspond la
coordination de la contraction de ces fibres musculaires lisses)
Au
niveau de la couche musculaire, on trouve un 2ème réseau de neurones
appelé plexus myentérique (également
appelé plexus d’Auerbach) Il
représente la plus grande partie du tissu nerveux dans le tube digestif. On y
trouve les 2 composants du SNA (sympathique et parasympathique)
Ce plexus myentérique joue un rôle
important dans la motilité du tube digestif. En fait, le tube digestif peut
avoir une organisation intrinsèque indépendant du contrôle nerveux.
En ce qui
concerne les neurotransmetteurs dans le tube digestif, la plupart des fibres
sont cholinergiques.
Les
jonctions neuromusculaires sont différentes des plaques motrices du muscle
strié. En effet, dans la majorité des cas, les terminaisons nerveuses n’entrent
pas en contact direct avec l’élément musculaire. Le neurotransmetteur va
diffuser depuis la terminaison pré–synaptique vers les cellules musculaires
lisses.
La dépolarisation produite par le
neurotransmetteur gagne de proche en proche les cellules musculaires lisses et
ceci grâce à la présence de nexus.
A coté des
fibres cholinergiques, on trouve des neurones purinergiques qui libèrent des
purines telles que l’ATP ou l’adénosine et qui possèdent un effet inhibiteur
sur les cellules musculaires.
En
fait, l’organisation décrite fait penser que le tube digestif est totalement
autonome en ce qui concerne le système nerveux. Toute fois, le tube digestif
n’et pas totalement isolé du SNC. En effet, on trouve des fibres (sympathiques
ou parasympathiques, afférentes ou effectrices) qui vont innerver le tube
digestif.
On parle d’innervation extrinsèque. Elle
n’est pas indispensable à la production d’ondes de contractions musculaires,
cependant elle va moduler l’amplitude et la fréquence de ces ondes.
Les fibres
afférentes (sensitives) conduisent des influx nerveux qui naissent au niveau de
récepteurs mécaniques ou chimiques. Ces récepteurs sont disséminés dans la
paroi du tube digestif.
Les
fibres efférentes (motrices) vont suivre les nerfs vagues (pour le système
nerveux parasympathique) et également les nerfs pelviens. Elles s’articulent
avec les neurones plexiques.
En ce qui
concerne les fibres sympathiques, elles se distribuent de façon variable à
partir des ganglions sympathiques :
-
Soit
le neurone post–ganglionnaire se projette sur un neurone cholinergique plexique
(mise en jeu de récepteurs a–adrénergiques)
-
Soit
il se projette directement sur une cellule musculaire lisse (mise en jeu de
récepteurs adrénergiques a ou b)
Il
existe des ganglions sympathiques à coté du tube digestif (en dehors de la
chaîne ganglionnaire) :
-
Le
ganglion céliaque,
-
Le
ganglion mésentérique supérieur,
-
Le
ganglion mésentérique inférieur.
Propriétés intrinsèques de la cellule
musculaire lisse :
Elles
présentent un potentiel de repos moins important (–50mV) que celui de la fibre
musculaire striée (– 90mV)
Cela provoque une instabilité du
potentiel de ces cellules. En effet, en dehors de toute stimulation, il existe
des variations spontanées du potentiel membranaire de la cellule musculaire
lisse.
La genèse de ce
phénomène se situe au niveau même de la cellule. Il persiste après une
dénervation du tube digestif. Il s’agit d’une activité membranaire rythmique
comparable à des oscillations du potentiel membranaire que l’on observe dans
quelques cellules nerveuses d’invertébrés tels que l’aplésie.
Ces
variations de potentiel sont appelées les ondes
lentes de dépolarisation et correspondent à des entrées cycliques de Na+ dans la
cellule. Ces ondes lentes naissent au niveau des cellules appelées les entraîneuses (sorte de « pace
maker ») pour gagner ensuite les autres cellules appelées les suiveuses.
Ces ondes,
lorsqu’elles atteignent une amplitude seuil, déclenchent l’apparition de PA,
puis la cellule musculaire se contracte.
-
Cette
contraction musculaire peut rester localisée et ainsi réaliser un mouvement
segmentaire. On parle d’onde de type I (ou onde segmentaire)
-
Mais
généralement, les ondes se propagent dans le sens aboral (= antéro–postérieur)
et donc ces ondes sont à l’origine du péristaltisme que l’on rencontre dans le
tube digestif et qui vont induire la propulsion de la nourriture.
Cette
activité intrinsèque va être moduler par les systèmes nerveux intrinsèque et
extrinsèque via la libération de neurotransmetteurs :
-
L’acétylcholine
renforce les contractions du tube digestif en augmentant la fréquence et
l’amplitude des ondes lentes (effet facilitateur)
-
Les
catécholamines ont un effet inverse (effet inhibiteur sur le tube digestif)
-
L’ATP,
libéré par les neurones plexiques ou par les fibres sympathiques ou
parasympathiques, inhibe fortement les ondes lentes (nette hyperpolarisation)
A coté de cette
modulation nerveuse, il existe une modulation d’ordre hormonale. En effet,
plusieurs hormones telles que la prostaglandine ou les hormones peptidiques
gastro–intestinales (comme la cholécystoquinine, la gastrine, le VIP, la
bombézine, etc) vont moduler l’activité du tube digestif.
Þ Cela illustre la complexité de la régulation
de la fonction digestive.
v Sécrétion salivaire :
En temps normal,
la salive est sécrétée en quantité suffisante pour maintenir les muqueuses de
la bouche et du pharynx humides. Cependant, lorsque des aliments pénètrent dans
la cavité buccale, les sécrétions salivaires augmentent afin de lubrifier la
nourriture, de la dissoudre et également d’amorcer la transformation chimique
de cette nourriture.
La
salive est sécrétée par 3 glandes salivaires (3 paires) :
-
Les
glandes parotides,
-
Les
glandes submandibulaires (ou submaxillaires),
-
Les
glandes sublinguales.
Ces glandes
envoient la salive sécrétée dans la bouche via des canaux.
La
salivation est entièrement régulée par le système nerveux. La production de
salive varie entre 1 et 1,5L.
En situation
normale, la stimulation parasympathique assure la sécrétion continue d’une
quantité de salive (humidification des muqueuses, lubrification des lèvres)
Cette salive est ensuite avalée et humidifie l’œsophage. Elle est ensuite
réabsorbée.
La stimulation sympathique est modérée.
Elle augmente la sécrétion, le métabolisme et la croissance des glandes
salivaires.
Les
aliments entraînent une forte sécrétion des glandes salivaires. Lorsqu’ils pénètrent
la bouche, les substances chimiques qu’ils contiennent stimulent des récepteurs
situés dans les bourgeons gustatifs de la langue.
Egalement, la friction produite par un
objet solide excite les récepteurs situés au niveau de la langue.
Les influx
nerveux produits par ces stimulations sont conduits depuis les récepteurs
jusqu’aux noyaux salivaires (supérieur et inférieur) localisés dans le tronc
cérébral. A partir de ces noyaux, l’influx nerveux sympathique est conduit par
les nerfs faciaux (7ème paire) et par les nerfs glossopharyngiens (9ème
paire) qui stimulent les glandes salivaires.
Dans
certains cas, l’information passe dans le cortex. Par exemple, quand on regarde
quelqu’un manger, quand on pense à un repas, quand on sent l’odeur de
nourriture ou quand on entend un son (Pavlov), cela développe un comportement
acquis qui fait appel à la mémoire.
L’anticipation de cette salivation va
préparer la digestion. Il existe des stimuli qui inhibent la salivation, comme
le sommeil, la fatigue, la peur et la déshydratation.
v La déglutition :
C’est
l’acte de propulsion des aliments de la bouche dans l’estomac via le conduit
œsophagien. Elle se décompose en 3 phases :
-
La phase buccale qui est
directement sous le contrôle volontaire,
-
La phase
pharygienne
qui est de nature réflexe.
Elle est constituée de contractions
musculaires en amont du bol alimentaire et d’inhibition de la contraction en
aval. Ces phénomènes sont étroitement coordonnés avec la respiration : il
y a inhibition du cycle respiratoire et fermeture des voies aériennes.
Elle est déclenchée par le contact de la
nourriture sur les récepteurs tactiles du pharynx. Les messages afférents
suivent les voies des 9èmes et 10èmes nerfs et gagnent
des noyaux situés dans le tronc cérébral avec un ensemble d’interneurones
(formation réticulée)
Ces noyaux forment le centre de la
déglutition et envoient des informations vers l’œsophage via un ensemble de
nerfs (7ème, 9ème, 10ème et 12ème
paires) qui vont innerver les muscles de la langue et d’une partie du pharynx
pour contrôler la 2ème phase de la déglutition.
-
La phase
oesophagienne,
constituée de phénomènes moteurs qui ont lieu dans l’œsophage.
C’est un phénomène réflexe qui assure la
progression des aliments vers l’estomac. L’œsophage est un conduit musculaire
où l’on rencontre dans le ⅓
supérieur des fibres musculaires striées innervées directement par le nerf
vague. Dans les ⅔
inférieurs,
on trouve des fibres musculaires lisses innervées par des neurones
parasympathiques.
Au niveau de l’œsophage, on trouve 2
épaississements musculaires qui forment le sphincter pharyngo–œsophagien et le
sphincter inférieur de l’œsophage (qui sépare l’œsophage de l’estomac) Ces
sphincters jouent un rôle important dans la déglutition.
L’activité myogène spontanée de
l’œsophage n’a pas été clairement mise en évidence comme chez l’estomac et
l’intestin. L’innervation intrinsèque de l’œsophage (plexus myentérique) et
l’innervation extrinsèque (du nerf vague entre autres) coopèrent pour produire
le péristaltisme.
Lors de la
déglutition, l’activité tonique assurant la fermeture du sphincter
pharyngo–œsophagien cesse. Cette inhibition est centrale (SNC) dans la partie
supérieure de l’œsophage. L’innervation vagale va déclencher la contraction
musculaire et permettre ainsi la propulsion du bol alimentaire. Cette
stimulation vagale est faite par un réflexe vago–vagal.
Dans le premier ⅓ de l’œsophage,
l’innervation intrinsèque ne jour pas un rôle important dans la contraction
musculaire. Par contre, cette innervation assure la contraction musculaire et
la propagation de la nourriture dans la partie moyenne et inférieure de
l’œsophage.
L’information
est transmise par des réflexes courts. Les informations intra–œsophagiennes
sont transmises par les cellules nerveuses sensitives au plexus myentérique qui
effectue une intégration locale avant de les envoyer aux cellules musculaires
lisses via des neurones cholinergiques.
L’activation des
récepteurs pharyngo–œsophagiens initie un réflexe dont la résultante est la
relaxation d’une certaine partie de l’estomac. Les informations, depuis ces
récepteurs, sont transmises par le nerf vague à certains neurones purinergiques
du plexus myentérique. Ces neurones purinergiques sont inhibiteurs.
v L’estomac :
C’est
le continuum de l’œsophage. Il est subdivisé en 4 parties :
-
La
cadia,
-
Le
fundus,
-
Le
corps de l’estomac,
-
Le
pylore (juste avant l’intestin)
Il
est composé de 3 couches musculaires :
-
Une
couche circulaire,
-
Une
couche oblique,
-
Une
couche longitudinale.
De
4 couches cellulaires :
-
La
muqueuse,
-
La
sous–muqueuse,
-
La
musculeuse,
-
La
séreuse.
La muqueuse
contient des cellules à mucus, des cellules pariétales (sécrétrices d’HCl), de
cellules de type G (sécrétrices d’une hormone : la gastrine) Il existe une
forte sécrétion hormonale.
Au niveau de
l’estomac, la digestion est divisée en 2 composantes : la digestion
mécanique et la digestion chimique.
Ø Digestion
mécanique :
Elle
consiste en des mouvements péristaltiques modérés et ondulants qui se propagent
le long de l’estomac toutes les 15 – 20 secondes.
Ces mouvements (ou ondes) macèrent les
aliments et les mélangent avec les sécrétions des glandes gastriques. Ces
mouvements réduisent en une bouillie appelée chyme gastrique. Au cours de la
digestion, des ondes plus fortes commencent dans le corps de l’estomac et
s’intensifient en atteignant le pylore.
Le
sphincter pylorique reste normalement entrouvert. Quand les aliments atteignent
le pylore, chaque onde pousse une petite quantité (quelques mL) du contenu
gastrique dans le duodénum.
La plus grande partie de la nourriture
est refoulée dans le corps de l’estomac où le mélange se poursuit. L’onde
suivante pousse une nouvelle fois le contenu de l’estomac vers l’avant pour
faire pénétrer encore une fois une petite quantité dans le duodénum.
Le mouvement de
va–et–vient dans le sens aboral assure à lui seul presque tout le mélange des
aliments dans l’estomac.
Ø Digestion
chimique :
Les cellules
pariétales de l’estomac sécrètent l’HCl dans la lumière de l’estomac. Cette
acidité va détruire les microbes, dénaturer partiellement certaines protéines,
stimuler la sécrétion d’hormones qui favorisent la sécrétion de la bile et,
également, augmenter la sécrétion du suc pancréatique ainsi que d’autres
enzymes (lipases, pepsine)
Ø Régulation
de la digestion :
Les
contractions de l’estomac ainsi que la sécrétion des sucs gastriques sont liés
à des mécanismes nerveux et hormonaux. Ces mécanismes se déroulent en 3 phases
qui se chevauchent :
-
La
phase céphalique,
-
La
phase gastrique,
-
La
phase intestinale.
Au
cours de la phase céphalique, des influx nerveux parasympathiques, en
provenance du noyau situé dans le bulbe rachidien, sont transmis par le nerf
vague. Ces influx nerveux favorisent :
-
Le
péristaltisme des muscles lisses de l’estomac,
-
La
sécrétion par les glandes gastriques d’enzymes, d’HCl, de mucus, etc. dans la
lumière de l’estomac,
-
La
stimulation des certaines hormones libérées dans la circulation sanguine (comme
la gastrine)
Pendant la phase
gastrique, des réflexes à l’intérieur de l’estomac continuent de stimuler la
contraction et les processus de sécrétion.
Au cours de la
phase intestinale, des réflexes neuronaux commencent dans l’intestin et vont
être envoyés dans l’estomac pour exercer un effet inhibiteur sur l’activité de
cet organe.
§ Phase céphalique :
Elle concerne de
réflexes déclenchés par des récepteurs sensoriels situés dans la tête. En
effet, avant même que les aliments ne pénètrent l’estomac, la vue, l’odeur, le
goût ou la pensée de nourriture déclenchent ce réflexe céphalique.
Le
cortex cérébral envoie des informations via l’hypothalamus, et plus
spécifiquement le centre de la faim, au bulbe rachidien. On y trouve des
neurones spécialisés qui relaient l’information par l’intermédiaire de neurones
parasympathiques du nerf vague pour stimuler des neurones post–ganglionnaires
ou bine stimuler le plexus sous–muqueux.
Ces neurones plexiques, à leur tour, innervent
les cellules pariétales (sécrétrices de mucus) ainsi que les cellules qui
sécrètent les hormones gastriques. Ces neurones plexiques innervent également
les cellules musculaires lisses, produisant des mouvements de contraction.
Ces stimuli
émotionnels (stress, peur, anxiété, etc.) peuvent ralentir la digestion dans
l’estomac (système sympathique)
§ Phase gastrique :
Des mécanismes
nerveux et hormonaux déclenchés par des récepteurs situés au sein de l’estomac
permettent que la sécrétion et la motilité de l’estomac se poursuivent.
Tous
les aliments induisent une distension (étirement) de l’estomac et donc la
stimulation de récepteurs de tension (mécanorécepteurs)
Par ailleurs, l’entrée des aliments dans
l’estomac produits une élévation du pH (effet tampon) Des chimiorécepteurs
(sensibles aux variations de pH) vont être activés.
L’ensemble de
l’information induite par l’activation des mécanorécepteurs et chimiorécepteurs
est envoyé au plexus sous–muqueux. On va avoir une stimulation parasympathique
et la résultante est la contraction des fibres musculaires et la sécrétion des
cellules pariétales (sécrétion de mucus et rétablissement du pH avec du HCl)
Les ondes
péristaltiques mélangent les aliments au suc gastrique. Lorsque ces ondes
deviennent plus fortes, une petite quantité du chyme gastrique passe dans le
duodénum. Etant donné que le pH du chyme devient faible (moins d’effet tampon)
et que les parois de l’estomac ne sont plus étirées, ce système réflexe de
rétrocontrôle va cesser.
La
distension de l’estomac et la présence de protéines partiellement digérées
favorisent la production de gastrine par les cellules de type G. La gastrine
est libérée dans la circulation sanguine et a pour effet une stimulation d’une
grande quantité de suc gastrique.
Elle contracte
également le sphincter œsophagien inférieur, augmente la motilité l’estomac et
relâche le sphincter pylorique.
La sécrétion de gastrine s’arrête quand
le pH tombe en dessous de 2.
L’ensemble des
mécanismes mécaniques et chimiques permettent la digestion et le passage dans
l’intestin.
§ Phase intestinale :
Elle
est due à l’action de récepteurs de l’intestin qui exercent des effets
inhibiteurs sur l’activité sécrétoire et la motilité de l’estomac. Ils
ralentissent la sortie de chyme gastrique et évitent que le duodénum ne reçoive
plus de chyme qu’il ne peut entraîner.
Ces phénomènes comprennent des réactions
hormonales, comme
D’autres
part, la présence d’aliments dans l’intestin déclenche un réflexe neuronal
appelé de réflexe entérogastrique. Ce sont des influx nerveux qui partent de
l’intestin, atteignent le bulbe rachidien et reviennent dans l’estomac pour
inhiber l’activité motrice de l’estomac.
Ces influx inhibent le système nerveux
parasympathique et stimulent le système nerveux sympathique.
Ce réflexe
entérogastrique est déclenché par l’étirement de l’intestin et la présence
d’acides gras et de glucose dans le chyme.
Le
système endocrinien, dont l’unité de base est la cellule sécrétrice, s’adresse
à toutes les cellules par l’intermédiaire d’un liquide extracellulaire (système
sanguin)
Le système nerveux, dont l’unité de base
est le neurone, s’adresse à certaines cellules par l’intermédiaire de
connexions bien coordonnées (réseaux)
La
cellule sécrétrice et la cellule nerveuse possèdent plusieurs propriétés en
commun, comme la capacité de sécrétion ainsi que le potentiel électrique. Elles
sont capables de libérer des médiateurs chimiques.
Dans ces 2 types de cellules, on va
trouver les mêmes médiateurs chimiques, c’est–à–dire certains neurones sont
capables de libérer des hormones et inversement des cellules sécrétrices
libèrent des neurotransmetteurs.
Cette
double sécrétion concerne les cellules de l’hypothalamus. On y trouve des
neurones qui peuvent sécréter des neurotransmetteurs et des hormones (qui vont
se retrouver dans la circulation sanguine)
Ces neurones
hypothalamiques sont très spécialisés et représentent un lien majeur par lequel
le cerveau va réguler les mécanismes comme la reproduction.
On parle aussi de transmetteurs
neuroendocriniens car ils sont capables de traduire une activité neuronale en
sécrétion hormonale.
Le
système endocrinien travaille en synergie avec le système nerveux pour
contrôler les activités cellulaires. Cependant, la vitesse et les mécanismes
mis en jeu par ces 2 systèmes sont différents :
-
Le
système nerveux contrôle l’activité des muscles et des glandes par le biais
d’un influx nerveux. En réponse, les organes réagissent très rapidement.
-
Le
système endocrinien contrôle l’activité métabolique des cellules cibles par la
sécrétion d’hormones qui circulent dans tout l’organisme. Les tissus cibles
peuvent répondre après une période de latence.
Une fois amorcée,
ces réactions tendent à durer beaucoup plus longtemps que la réaction
induite par le système nerveux.
Il
existe différents types de sécrétion :
-
La sécrétion
endocrine :
Les cellules endocriniennes sécrètent
des hormones en niveau extracellulaire qui vont entrer dans le sang pour
atteindre les cellules cibles qui peuvent se trouver à une distance
considérable (exemple de l’hypophyse antérieure)
-
La sécrétion paracrine :
Les cellules paracrines vont sécréter
des hormones qui vont agir sur les cellules au voisinage immédiat
(exemple du glucagon qui a une action sur les cellules pancréatique
voisines sécrétrices d’insuline)
-
La sécrétion autocrine :
L’hormone agit sur la cellule
sécrétrice. Elle a souvent une action de rétrocontrôle (exemple de l’IGF
qui agit sur les cellules mères)
-
La sécrétion neuroendocrine
(= neurohormonale) :
L’hormone est sécrétée par la cellule
nerveuse et déversée dans la circulation sanguine (exemple de la vasopressine
ou hormone antidiurétique qui est sécrétée par les neurones de l’hypophyse
antérieure dans la circulation sanguine)
-
La sécrétion de
neurotransmetteurs :
Le neurone
pré–synaptique sécrète des neurotransmetteurs qui vont agir sur le neurone
post–synaptique.
Les
hormones appartiennent à une classe de molécules synthétisées par des cellules
spécialisées qui peuvent être regroupées en glandes endocriniennes comme la
thyroïde, le thymus, la surrénale, les glandes sexuelles, l’hypophyse (ou
glande pituitaire), la glande pinéale (ou épiphyse) qui sécrète la mélatonine,
ou encore l’hypothalamus qui fait partie intégrante du SNC mais qui de
transformer l’activité neuronale en activité hormonale.
Outre ces glandes, certains organes
possèdent des cellules capables de libérer des hormones. Par exemple, le tube
digestif présente des cellules disséminées, capables de sécréter des hormones.
De même, le cœur possède des cellules sécrétant le NAF (= facteur atrio–Na+diurétique)
Chaque
glande peut sécréter une ou plusieurs hormones et certaines hormones agissent
sur plusieurs tissus (action généralisée) Par exemple, l’hormone de croissance
(ou somathotropine) agit rapidement sur tous les tissus de l’organisme. Il en
est de même pour l’hormone thyroïdienne T4.
D’autres hormones agissent sur un tissu
unique. Par exemple, la tyrotrophine (TSH) est sécrétée par l’hypophyse
antérieure et va agir de manière spécifique sur la thyroïde. De même, la
corticotrophine (CTH) est sécrétée par l’hypophyse antérieure et va agir de
manière spécifique sur la glande surrénale.
Bien
que l’organisme produise des hormones de structure diverse, on peut les classer
en 2 groupes en se basant sur leur nature :
-
Nature
peptidique (ou protéique) :
Elles sont hydrosolubles. Cette classe
comprend la plupart des hormones.
-
Nature stéroïde :
Elles sont
liposolubles, synthétisées à partir du cholestérol. On y retrouve les hormones
gonadiques et les hormones de la cortico–surrénale.
De
par leur hydrosolubilité, les hormones de nature peptidique peuvent circuler
dans le sang en forme libre ou associées à des protéines de transport.
Plus le caractère hydrophobe est marqué,
moins l’hormone sera susceptible sous forme libre : il y aura la nécessité
de protéines de transport comme
Les
hormones de nature peptidique ou protéique vont être synthétisées dans les
cellules spécialisées (cellules endothéliales) et cette synthèse suit les
processus classiques de synthèse peptidique ou protéique.
Les hormones stéroïdes vont être
synthétisées à partir du cholestérol au niveau des mitochondries. Les hormones
stéroïdes ne sont pas accumulées dans les cellules sécrétrices mais seront
synthétisées à la demande : il n’y a pas de stock.
Les hormones
vont atteindre pratiquement toutes les cellules de l’organisme car elles se
trouvent dans la circulation sanguine. Cependant, une hormone donnée agit ou
active uniquement des cellules cibles qui possèdent des récepteurs spécifiques.
Au
niveau intracellulaire, on distingue 2 types de mécanismes d’action.
-
Le
1er consiste en la formation d’au moins un 2nd
messager :
-
L’adénylate
cyclase pour le glucagon, l’adrénaline, les hormones sexuelles et la
corticoprotéine.
-
La
guanylate cyclase pour l’IGF, l’insuline et l’EGF.
-
Un
récepteur associé à une tyrosine kinase pour l’hormone de croissance et la
prolactine.
-
Le
2ème implique la régulation directe de gènes par l’hormone. Les
hormones stéroïdes peuvent diffuser librement à travers la membrane. Une fois
dans la cellule, elles doivent se lier à des récepteurs cytosoliques et vont
être associées à l’ADN. Cette activation entraîne la transcription du gène.
En
général, les hormones sont des substances particulièrement puissantes qui
exercent des effets à de très faibles concentrations sanguines. Or, la
concentration sanguine d’une hormone va dépendre de 2 paramètres :
-
La
vitesse de libération de cette hormone,
-
La
vitesse de son inactivation et de son élimination par l’organisme.
Certaines
hormones sont inactivées par les cellules cibles mais la plupart sont éliminées
par les cellules rénales ou les cellules hépatiques. La demi–vie d’une hormone
varie d’une hormone à l’autre (de quelques minutes à quelques heures)
La vitesse
d’action (cinétique) des hormones varie selon la nature de ces hormones :
-
Nature
peptidique : action rapide,
-
Nature
stéroïde : action prolongée.
|
|
Nature
peptidique |
Nature
stéroïde |
|
Récepteurs |
Membranaires |
Intracellulaires |
|
Transduction
du signal |
Cascade de
phosphorylations 2nds
messagers |
Liaison à
l’ADN Transcription |
|
Cinétique |
Rapide |
Prolongée |
|
Exemples |
Insuline,
adrénaline |
Cortisol,
thyroxine |
Certaines
hormones peuvent avoir plusieurs fonctions et certaines fonctions (= processus
physiologiques) mettent en jeu plusieurs hormones. Souvent ces hormones
présentent une action opposée à celle des autres.
La testostérone
a une action sur différents tissus (développement embryonnaire de l’appareil
génital, des glandes sébacées, la pousse de la barbe, etc.)
La régulation de la glycémie fait
intervenir le glucagon, l’insuline, l’hormone de croissance, le cortisol,
l’adrénaline.
Le
système endocrinien est un système puissant soumis à un contrôle très fin pour
éviter qu’il ne s’emballe. La synthèse et la libération de la plupart des
hormones sont régulées par un rétrocontrôle.
Un stimulus
interne ou externe va déclencher la sécrétion de l’hormone. L’augmentation de
la concentration de l’hormone, tout en agissant sur les cellules cibles, inhibe
sa libération par la glande endocrinienne.
Par conséquent,
la concentration de l’hormone varie très peu. Ces rétrocontrôles pour être
décrits selon 2 schémas :
1er
schéma :
La glande libère
l’hormone qui agit sur son tissu cible pour le stimuler ou l’inhiber. La
réponse induite par l’hormone peut soit inhiber soit stimuler la glande
d’origine afin de diminuer ou d’augmenter la sécrétion de l’hormone.

2ème schéma :
La glande produit
un 1er signal hormonal qui agit sur une 2nde glande qui
est stimulée pour produire une 2ème hormone qui va agir sur un tissu
cible pour produire une réponse. Additionnellement, cette 2ème
hormone est capable de contrôler la production et la libération de la 1ère
hormone par un phénomène de rétrocontrôle (feedback)
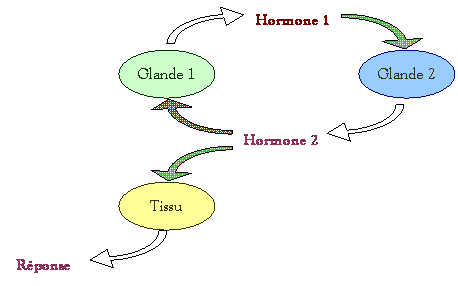
S’il
n’y avait pas de rétrocontrôle, la sécrétion de l’hormone augmente, provoquant
une amplification de la réponse exogène.
Souvent la
concentration en hormone est contrôlée par un rétrocontrôle négatif.
Dans quelques cas rares, il existe un
rétrocontrôle est positif. C’est le cas de l’œcytocine chez la femme enceinte.
Lors de l’accouchement et de l’allaitement, l’hypophyse sécrète des hormones
qui vont agir sur l’utérus. Il y a alors une amplification de la sécrétion par
l’hypophyse jusqu’à la sortie du fœtus ou la fin de l’allaitement.
Stimuli capables de provoquer la
synthèse et la sécrétion hormonale :
-
Stimuli humoraux :
Les variations de taux sanguins de
certains ions ou nutriments entraînent la libération d’hormones.
Exemples :
-
La
baisse du taux sanguin de Ca2+ provoque la
libération de parathormone, synthétisée par la glande parathyroïde.
-
La
baisse de la glycémie provoque la libération de glucagon, synthétisé par le
pancréas.
-
L’augmentation
du taux sanguin de NaCl provoque la libération de vasopressine.
-
Stimuli hormonaux :
La libération de
la plupart des hormones de l’hypophyse antérieure dépend d’hormones
hypothalamiques. A leur tour, les hormones de l’hypophyse antérieure vont
induire la libération d’hormones dans le sang par d’autres glandes
périphériques.
-
Stimuli nerveux :
Des fibres nerveuses peuvent stimuler la
libération d’hormones.
-
Par
exemple, le système nerveux sympathique produit, essentiellement dans des
situations de stress, la libération d’adrénaline et de noradrénaline par la
glande médullo–surrénale.
-
Autre
exemple, des influx nerveux provenant de l’hypothalamus vont libérer des
hormones de l’hypophyse antérieure, notamment la vasopressine et l’ocytocine.
L’ensemble
de ces stimuli sont intégrés au sein de l’hypothalamus et vont induire une
libération. L’axe hypothalamo–hypophysaire joue un rôle central dans le système
endocrinien.
L’hypothalamus va intégrer des stimuli
en provenance des centres supérieurs et va les transformer en messages
hormonaux pour réguler des fonctions physiologiques.
On
peut décrire 2 voies de sécrétion hormonales :
-
Certaines
hormones, appelées stimulines, sont libérées par l’hypophyse sous le contrôle
d’hormones, elles–même libérées par l’hypothalamus. Ces stimulines, ayant pour
organes cibles les glandes périphériques, réguleront les cellules cibles par
leur propre sécrétion. Dans cette voie, l’information est transmise par 3
hormones successives.
-
Certaines
hormones, sécrétées par l’hypophyse, vont agir directement sur des cellules
cibles. Ces hormones hypophysaires sont également sous la dépendance d’hormones
hypothalamiques.
Anatomie de l’axe hypothalamo–hypophysaire :
L’hypothalamus
se situe à la parie inférieure du diencéphale en dessous du 3ème
ventricule et s’étend entre le chiasma optique et les corps mamillaires.
Entre le chiasma optique et le corps
mamillaires, se situe l’éminence médiane qui se prolonge vers le bas par une
tige, appelée tige pituitaire (= infundibulum) Elle est dirigée vers l’arrière
et son renflement terminal va constituer le lobe postérieur de l’hypophyse,
appelé également neurohypophyse ou pars nervosa.
La
neurohypophyse est d’origine neuro–ectodermique et constituée de cellules gliales,
appelées pituicytes, d’axones de neurones sécréteurs hypothalamiques, de
capillaires sanguins qui ressemblent à ceux que l’on trouve dans la circulation
périphérique (capillaires fenestrés, c’est–à–dire sans BHE)
Cette absence de BHE va faciliter le
passage des hormones.
Au
cours du développement embryonnaire, une vésicule qui provient de la paroi
antérieure du pharynx migre vers l’hypophyse postérieure et va s’accoler pour
former le lobe antérieur de l’hypophyse, appelé également l’adénohypophyse ou
l’anthypophyse ou pars glandularis ou pars distalis.
Au niveau de l’anthypophyse, il existe
une couche mince de tissu qui constitue le lobe intermédiaire de l’hypophyse
qui, d’un point de vue fonctionnel, est lié au lobe antérieur de l’hypophyse.
Relation anatomique et fonctionnelle
entre l’hypothalamus et l’hypophyse :
Au
niveau de l’hypothalamus, les cellules nerveuses sont regroupées en noyaux
responsables de fonctions hormonales précises. L’hypothalamus est formé d’un
groupement de noyaux. Ces noyaux hypothalamiques n’ont pas uniquement une
fonction hormonale ou neuroendocrinienne.
On va y trouver le siège de contrôle de
mécanismes physiologiques (faim, température, régulation du système nerveux
autonome, horloge biologique dans le
noyau supra–chiasmatique)
La
relation entre l’hypothalamus et l’hypophyse postérieure est directe. Cette
relation est constituée de prolongement de structures nerveuses de
hypothalamus.
La majorité des fibres nerveuses dans
l’hypophyse postérieure provient de cellules de grande taille, appelés neurones
magnocellulaires, situées dans les noyaux supra–optique et para–ventriculaire.
L’hypophyse
antérieure n’a pas une origine ectodermique. Elle est reliée à l’hypothalamus
par l’intermédiaire de neurohormones qui sont sécrétées dans l’hypothalamus et
acheminées vers l’hypophyse antérieure par un système vasculaire original (=
système porte veineux)
Système
porte veineux :
D’ordinaire,
l’artère passe dans un organe sous forme de capillaires et il en ressort une
veine. Le système porte veineux consiste en 2 réseaux capillaires reliés entre
eux par un système veineux. Cela permet d’éviter que les hormones sécrétées
soient diluées et dégradées dans la circulation générale.
Les
hormones hypothalamiques sont nombreuses, on peut citer :
-
-
Le
CRF (corticotropine releasing factor)
qui stimule la libération l’ACTH.
-
-
La
stomatostatine (= hormone inhibitrice)
L’hypothalamus
va intégrer des informations des centres supérieurs et de récepteurs
périphériques et va transformer cette information par la sécrétion hormonale.
Cette sécrétion hormonale est soumise à un contrôle très fin par les
neurotransmetteurs.
L’hypothalamus
présente des axones terminaux à dopamine, noradrénaline, acétylcholine et au
GABA. La dopamine exerce un effet inhibiteur sur la sécrétion de la prolactine
par l’hypophyse antérieure. La libération de CRF est contrôlée par la
noradrénaline et la dopamine.
La dopamine peut aussi être sécrétée au
niveau de la tige pituitaire et peut atteindre l’hypophyse antérieure via le
système sanguin.
4 profils de contrôle nerveux sur le
neurone sécréteur hypothalamique :
-
L’activité
de ce neurone hypothalamique régulée par un ensemble de neurones et
interneurones.
-
La
régulation directement (sans interneurones)
-
La
partie terminale du neurone hypothalamique possèdant des récepteurs
pré–synaptiques qui permettent une régulation via la synapse terminale (exemple
des opiacés)
-
La
régulation par la libération de neurotransmetteurs dans les vaisseaux sanguins.
Þ En résumé,
l’activité hormonale de l’hypothalamus est le siège d’une régulation complexe
et fine.
Exemple de régulation de sécrétion d’une
hormone de l’hypophyse postérieure et ses effets :
L’hypophyse
postérieure sécrètent 2 hormones : la vasopressine (= hormone
antidiurétique et l’ocytocine) Elles ne sont pas synthétisées par les mêmes
neurones. Les neurones vasopressinergiques et ocytoninergiques contiennent
également plusieurs neurotransmetteurs et neuropeptides tels que la
gualanine et les catécholamines.
Chacune
de ces hormones est stockée dans des granules sous forme associée avec sa
protéine spécifique : la neurophysine 1 (pour la vasopressine), la
neurophysine 2 (pour l’ocytocine)
Ces protéines
sont synthétisée au niveau de l’hypothalamus et vont être transportées
jusqu’aux terminaisons nerveuses localisées dans l’hypophyse postérieure.
Une fois ces neurones dépolarisés, les
hormones vont être libérées dans le liquide interstitiel et vont atteindre les
capillaires qui irriguent l’hypophyse postérieure.
La vasopressine
est un petit peptide de 9 acides aminés. Elle exerce ses effets au niveau des
parois collectrices du rein. Elle est aussi un puissant vasoconstricteur. Elle
agit sur les cellules cibles via des récepteurs couplés aux protéines G.
Il
existe 2 types de récepteurs à la vasopressine : V1 et V2.
-
Les
récepteurs V1 sont subdivisés en V1a et V1b.
Le récepteur V1b est exprimé dans
plusieurs structures du système nerveux central (cortex cérébral, hippocampe,
système limbique) Cela montre l’action de la vasopressine sur ces fonctions
cognitives (modulation de l’activité cérébrale : mémoire, état psychique)
Il est également exprimé au niveau des
vaisseaux sanguins (puissant vasoconstricteur)
-
La
majorité des V2 est présente au niveau du rein. Son rôle majeur est le contrôle
de la diurèse en diminuant le volume urinaire.
L’ocytocine agit
sur la mémoire spatiale.
Mécanismes de régulation l’hormone
antidiurétique (= vasopressine = ADH) :
Il
existe 2 mécanismes :
-
Un mécanisme de
contrôle réflexe
est mis en jeu suite à une augmentation du volume sanguin qui est le reflet
d’une augmentation de la quantité d’eau dans l’organisme.
L’hypervolémie se traduit par une
distension des organes circulatoires (en particulier le cœur) Les parois de ces
organes possèdent des mécanorécepteurs sensibles à l’étirement et donc sensible au volume des cavités. On parle
de volorécepteurs.
Les informations reçues au niveau de ces
récepteurs sont transmises par le nerf vague au niveau des noyaux supra–optiques.
Ces informations vont inhiber la libération de vasopressine, d’où une réduction
de perméabilité à l’eau du tube collecteur du néphron, ce qui favorise la
diurèse et ainsi contribuer à rétablir le volume sanguin.
-
Un mécanisme de
contrôle humoral
est mis en jeu par des variations de la pression osmotique du tissu
extracellulaire. Cette pression osmotique peut être due soit à l’augmentation du
capital en eau dans l’organisme, soit à une diminution de la quantité de
substances en solution.
Par exemple, une augmentation du NaCl
entraîne une augmentation de
Ces variations
de POSM sont perçues par des récepteurs
spécifiques, appelés osmorécepteurs, situés dans les neurones hypothalamiques
(essentiellement les noyaux supra–optiques) La stimulation de ces récepteurs a
pour effet de diminuer la libération de la vasopressine, ce qui entraîne une
augmentation de la diurèse de façon à rétablir
La
vasopressine est sujet à un contrôle plus fin. En effet, plusieurs paramètres
(= substances) sont capables de moduler la sécrétion de la vasopressine. Par
exemple,
-
La
diminution de
-
La
diminution de
Cette hormone
joue un rôle important dans le maintien des volumes liquidiens de l’organisme.
Ce rôle peut être illustré dans le cas d’une pathologie, appelée diabète
insipide (absence de sucre dans les urines)
Cette
pathologie est liée à une réduction de la sécrétion de vasopressine (voire une
suppression totale) à la suite d’atteinte des noyaux hypothalamiques ou de
l’hypophyse antérieure. On constate une diurèse très importante : on parle
de polyurie. Les volumes d’urine excrétée peuvent atteindre 20L/jour,
entraînant une sensation de soif importante et une déshydratation.
Il existe une autre variante : le
diabète insipide néphrogénique où le rein ne répond plus à la vasopressine.
Les
récepteurs à la vasopressine sont exprimés dans le cerveau. Le rôle de ces
récepteurs n’est pas suffisamment connu.
La vasopressine jouerait un rôle dans
les processus de mémoire. En effet, dans certains modèles expérimentaux,
l’effet de la vasopressine permet de réduire le déficit mnésique induit par des
agents pharmacologiques. Récemment, un laboratoire français explique que la
vasopressine serait impliquée dans des pathologies psychiques, comme la
dépression et l’anxiété.
Des
antagonistes des récepteurs à la vasopressine ont des effets anxiolytiques et
antidépresseurs. Exemple de la souris dans un tube en Y avec une des 2 branches
dans l’obscurité et l’autre est éclairée.
Avec du
diazépan, il y a une augmentation du pourcentage d’entrée dans la branche
éclairée (alors que la souris a une préférence naturelle aux zones sombre.
Avec des antagonistes des récepteurs à
la vasopressine, on observe les mêmes effets.
La vasopressine
facilite l’apprentissage (au niveau de l’hippocampe et du système limbique) Le Na+ stimule la
libération de vasopressine via les noyaux hypothalamiques. L’effet passerait
par l’activation de neurones glutamatergiques (excitateurs)
En
résumé :
La
vasopressine est une enzyme sécrétée par l’axe hypothalamo–hypophysaire et agit
sur les organes périphériques (notamment le rein), mais également au niveau
central pour réguler des processus nerveux.
D’un autre coté,
la sécrétion de cette hormone est sous la dépendance de l’activité cérébrale
(via des neurotransmetteurs)
Þ Communication
bidirectionnelle.
Exemple d’une hormone hypophysaire :
la stimuline :
Elle
est sécrétée par l’hypophyse antérieure et contrôle la sécrétion d’autres
hormones par une glande périphérique comme
C’est une glande
située à la base du larynx et constituée par 2 lobes latéraux reliés par un
isthme. Elle pèse 10 à 20g chez l’adulte. C’est une glande très
dynamique :
-
Elle
est plus petite dans les régions où l’apport en iode est absent,
-
Elle
est plus volumineuse chez la femme que chez l’homme,
-
Sa
taille augmente pendant la puberté, la grossesse, la lactation et la dernière
partie du cycle menstruel.
Sur
le plan microscopique, la thyroïde est formée de nombreux follicules entourés
d’un tissu interstitiel où cheminent des capillaires, des terminaisons
nerveuses et des cellules appelées des cellules de type C qui synthétisent une
hormone appelée calcitonine (rôle homéostasique)
Chaque follicule de la thyroïde est
constitué d’une seule couche de cellules folliculaires qui produisent une
glycoprotéine (= thyroglobuline) et la libèrent dans la cavité centrale du
follicule appelé colloïde.
Les hormones
thyroïdiennes qui sont la triiodothyronine (T3) et la tétraiodothyronine (T4 =
thyroxine) sont obtenues par condensation de 2 molécules de thyrosine dont le
noyau a subi 1 ou 2 iodinations.
La glande
thyroïde est capable de synthétiser et de libérer lentement des hormones. Les
hormones thyroïdiennes sont hydrophobes. La majeure partie de ces hormones va
se lier à des protéines plasmatiques dont la plus importante est
Certains
médicaments se fixent sur cette protéine et entraîne une augmentation de la
concentration plasmatique en hormones thyroïdiennes, comme le salicylate (famille
de l’aspirine), les antiépileptiques ou les anti–inflammatoires stéroïdiens.
-
20%
de
-
Le
reste provient de la transformation de T4 en T3.
Cette
transformation se fait au niveau de les cellules cibles qui possèdent des
déiodinases (dont la 5’–déiodinase)
Certains auteurs décrivent
Les
hormones thyroïdiennes sont hydrophobes : elles peuvent pénétrer aisément
dans la cellule par simple diffusion. Certaines cellules possèdent, au niveau
de leur membrane, un mécanisme de transport spécifique pour les hormones
thyroïdiennes qui facilite la capture de la fraction libre de ces hormones et
leur entrée dans la cellule.
Les récepteurs aux hormones
thyroïdiennes sont des protéines nucléaires associées à la chromatine qui
régulent la transcription.
T3
possède une affinité pour les récepteurs supérieure à celle de T4. Après la
liaison hormonale, le complexe hormone–récepteur induit la transcription de
gènes qui sont réceptifs aux hormones thyroïdiennes.
Ceci passe par une activation préalable
de domaines TRE (Thyroïd hormon Response Element)
L’interaction entre les hormones thyroïdiennes, le récepteur et ces domaines
TRE peut soit amplifier, soit inhiber la transcription des gènes.
2 types de
récepteurs ont été identifiés (issus de gènes distincts) : TRa et TRb qui sont
eux–mêmes dubdivisés en plusieurs sous–types (TRa1, TRa2, … et TRb1, TRb2, …)
Au
niveau de SNC, la densité la plus élevée des récepteurs aux hormones
thyroïdiennes a été observée dans le cervelet, ainsi que dans le cortex cérébral.
Ils sont aussi présents dans d’autres structures comme l’hippocampe, le
striatum et certains noyaux hypothalamiques, la moelle épinière et le tronc
cérébral.
Leur existence dans ces structures
suggère un rôle des hormones thyroïdiennes dans le fonctionnement de ces
structures.
Le transport des
hormones thyroïdiennes depuis le sang jusqu’aux compartiments
intra–parenchymateux (= intra–cérébral) est facilité par une protéine
plasmatique appelée transthyrétine qui permet le transport à travers
Mode d’action des hormones
thyroïdiennes :
Elles
possèdent plusieurs fonctions physiologiques, elles exercent un rôle important
sur les voies métaboliques :
-
Augmentation
de la synthèse protéique,
-
Augmentation
du métabolisme des lipides et des sucres, ainsi que des vitamines,
-
Stimulation
du métabolisme énergétique dans la plupart des tissus de l’organisme.
Cette élévation
du métabolisme énergétique produit une élévation de la température avec une
consommation d’O2. Les
hyperthyroïdies ont un métabolisme basal élevé et les hypothyroïdies sont un
métabolisme basal faible (froid, fatigue)
Le changement de
température régule la production des hormones thyroïdiennes. Le froid est perçu
par l’hypothalamus qui produit de
Les
hormones thyroïdiennes jouent un rôle important dans la croissance, elles sont
nécessaires au développement et la différenciation de la plupart des tissu de
l’organisme.
Ces actions sur la croissance peuvent
être directes ou indirectes via la stimulation de l’hormone de croissance.
Les
pathologies humaines caractéristiques qui touchent l’enfant sont liées à une
hyposécrétion des hormones thyroïdiennes. Chez ces enfants, il existe un
nanisme caractérisé où la formation des os longs est particulièrement altérée.
Au niveau du SNC, il est bien connu que
les hormones thyroïdiennes agissent sur le développement cérébral. Ceci a pu
être mis en évidence en étudiant des individus atteints de crétinisme.
Cette pathologie
était répandue dans les régions pauvres en iode et avec une faible consommation
de produits de la mer. Cela entraîne une carence en iode qui induit un retard
dans le développement moteur et intellectuel chez l’enfant.
Chez
l’homme, la présence de récepteurs aux hormones thyroïdiennes peut être
observée dès la 10ème semaine de grossesse. D’ailleurs, le cerveau
du fœtus possède une densité plus élevée de récepteurs aux hormones
thyroïdiennes par rapport au cerveau de l’adulte, suggérant ainsi un rôle
important dans le développement embryonnaire cérébral.
Elles sont
essentielles au développement des synapses (synaptogenèse) ainsi que dans la
synthèse de neurotransmetteurs.
Elles jouent également un rôle dans le
développement des cellules gliales (astrocytes, oligodendrocytes et microglie),
leur viabilité (= survie) et la différenciation des cellules microgliales
(émission de prolongements)
Une littérature
importante suggère un rôle des hormones thyroïdiennes dans le processus de
mémoire et d’apprentissage. Il a été montré que T3 était capable d’atténuer les
déficits de mémoire causés par la scopolamine (= antagonistes des récepteurs
cholinergiques)
" Test de la
piscine de Morris
Une déficience
en hormones thyroïdiennes serait un
facteur de risque pour développer la maladie d’Alzheimer.
Ces
hormones thyroïdiennes sont sous contrôle de nombreux neurotransmetteurs
(adrénaline, noradrénaline, sérotonine, glutamate, GABA, dopamine, etc.)
La dopamine agit sur l’hypothalamus mais
également sur l’hypophyse antérieure pour inhiber la synthèse de TSH (et donc
inhiber la libération d’hormones thyroïdiennes)
Dysfonctionnement
de la glande thyroïdienne :
-
L’hypothyroïdie peut être
provoquer par des anomalies de la glande elle–même (hypothyroïdie IAIRE) ou être due à
une déficience de TSH (hypothyroïdie IIAIRE) ou due à une
anomalie de l’hypothalamus (hypothyroïdie IIIAIRE)
L’hypothyroïdie peut être observée à la suite d’une carence alimentaire en
iode.
Chez l’adulte, le syndrome
hypothyroïdien est appelé syndrome de myxodème et se manifeste par un
métabolisme basal long, des sensations de froid, un assèchement et un
épaississement de la peau, des oedèmes, une baisse des aptitudes mentales,
parfois une léthargie, une dépression, une baisse de la force cardiaque, une
bradycardie, une baisse de la motilité intestinale, un visage boursouflé (dû à
la l’œdème), etc. Une hypothyroïdie sévère peut amener jusqu’au coma.
Si l’hypothyroïdie est due à une carence
en iode, la glande thyroïde s’hypertrophie, ce qui produit un goitre endémique.
S’il n’y a pas de traitement mis en place, les cellules thyroïdiennes
s’épuisent et la glande s’atrophie.
Chez l’enfant,
l’hypothyroïdie grave s’appelle le crétinisme. Ce trouble se caractérise par
une petite taille, une langue et un cou épais, accompagné d’une arriération
mentale.
-
Le
trouble d’hyperthyroïdie le plus
répandu est la maladie de Basedow. Cette pathologie est observée dans la région
où l’apport est iode est suffisant et constant, dû à un déséquilibre du système
immunitaire. il s’agit d’une maladie auto–immune. En fait, on va trouver dans
le sérum des anticorps TSI (Thyroïd
Stimulating Immunoglobulins) qui se fixent sur les cellules folliculaires à
la place de
Le diagnostique, en sérologie, est une
baisse de
Chez ces patients, on observe une
accélération du métabolisme basal, une sudation importante, des pulsations
cardiaques rapides et irrégulières, de la nervosité, une diminution du poids
corporel (perte pondérale), une exophtalmie (sortie des yeux hors des orbites)
Il existe des traitements d’injections
par intraveineuse d’anti–thyroïdiens, d’ablation de la glande thyroïde et, chez
les personnes âgées, d’injections d’iode radioactif qui irradie la glande
thyroïdienne.
Il existe une autre maladie
auto–immune : maladie de Hashimoto qui entraîne la destruction de la
glande thyroïde par d’autres anticorps.