Rappels
v Notions de base :
Ø La
membrane plasmique :
§ Structure :
Elle représente
80% du poids cellulaire.
Elle constitue
une barrière physique pour protéger la cellule.
Il s’agit d’une
bicouche lipidique avec en son sein de :
-
Protéines
disposées dans la partie externe de la membrane : les récepteurs ;
-
Protéines
disposées dans la partie interne de la membrane : protéines
intracellulaires, protéines G (participation à la machinerie
intracellulaire) ;
-
Protéines
transmembranaires (qui font que la barrière n’est pas complètement étanche)
Les protéines
transmembranaires permettent des échanges à travers de la membrane. Ces
échanges vont dépendre de plusieurs paramètres comme la nature du soluté :
-
Molécules
hydrophobes (essentiellement des gaz)
qui traversent la membrane passivement,
-
Molécules
chargées électriquement (hydrophiles) :
-
Molécules
de petite taille qui traversent la membrane passivement,
-
Molécules
de grande taille qui nécessitent des transporteurs,
-
Ions
(= atomes de petite taille chargés) qui nécessitent des transporteurs.
§ Les protéines
transmembranaires :
-
Les
transporteurs :
-
Liaison
à la substance d’intérêt,
-
Changement
de conformation,
-
Translocation
de la substance (comme le glucose)
-
Les canaux :
Ils permettent
le passage des ions. Ce sont des protéines présentant des configurations et des
structures différentes.
L’ouverture et
la fermeture du canal se font par des changements de conformation.
Ø Diffusion
d’un soluté chargé :
Elle dépend de 3
paramètres :
-
La
force chimique,
-
La
force électrique,
-
L’état
du canal.
Le canal oscille
entre 2 états : soit perméant
(ouvert), soit imperméant (fermé ou inactivé)
La force chimique consiste en la
différence de concentration de part et d’autre de la membrane. On parle aussi
du gradient de concentration.
La force électrique consiste en la
différence de potentiel électrique de part et d’autre de la membrane. On parle
aussi de différence de charge.
Þ Ces 2 forces se combinent pour donner la force électromotrice globale. On parle
aussi de Drinving force.
Même si elle est en faveur avec un
passage dans un sens, le passage ne se fait que si le canal ouvert.
Exemple : La membrane est perméable au K+.

C’est qui qui
gagne ? †!!
Pour savoir dans
quel sens se fait le passage de K+, il faut
« convertir » la force chimique en un équivalent électrique.
En
effet, une différence de concentration en éléments chargés doit présenter une
différence de charge…
Soit EION, le potentiel
d’équilibre de l’ion, ou force électrique équivalente, correspond à un rapport
de concentration et s’exprime en mV.

Þ
Equation de Nernst :
Par convention, on prend toujours le
compartiment extracellulaire comme compartiment de référence.
Dans l’exemple
ci–dessus, EK+ = –18 mV La différence de potentiel : Vm = –60 mV
La driving force = Vm –
EK+ = –60 – (–18) < 0 " Vm < EK+
" Le passage d’ion se fait de E vers I.
 EK+ = –60 mV
EK+ = –60 mV
La différence de
potentiel : Vm = –60 mV
La driving
force =
Vm – EK+
= –60 – (–60) = 0
" Vm = EK+
" Le flux net est nul.
 EK+ = –78 mV
EK+ = –78 mV
La différence de
potentiel : Vm = –60 mV
La driving
force =
Vm – EK+
= –60 – (–78) > 0
" Vm > EK+
" Le passage d’ion se fait de I vers E.
Vm > EK+ " Passage de I vers E = flux sortant,
Vm < EK+ " Passage de E vers I = flux entrant.
§ Conductance :
C’est la
facilité d’un ion à traverser la membrane. Elle s’exprime en Siemens et va de 5
à 200 pS pour un canal.
gIon = 1 / R gIon = gIon . NIon . PIon
|
gIon |
Conductance
globale d’un ion |
|
gIon |
Conductance
unitaire dans un canal |
|
NIon |
Nombre de
canaux |
|
PIon |
Probabilité
pour un canal d’être à l’état ouvert |
§ Intensité d’un courant
ionique :
Soit le courant
unitaire : iIon = gIon (VM – EIon)
Et le courant
ionique global : IIon = iIon . NIon . PIon
Soit un neurone
avec un potentiel membranaire Vm = –60 mV :
·
[ Na+ ]EXT > [ Na+ ]INT :
Il a tendance à
entrer selon la force chimique et selon la force électrique.
(L’intérieur est
« plus négatif » que l’extérieur)
INa+ = (VM – E Na+) . N Na+ . g Na+ = (VM – E Na+) . g Na+
A l’état de
repos, les canaux sont ouverts : il y a un courant Na+ entrant.
![]()
·
[ K+ ]EXT < [ K+ ]INT :
Il a tendance à
entrer selon la force électrique. Mais il a tendance à sortir selon la force
chimique.
VM – E K+ = –60
– (–84) > 0 " Le courant est sortant.
A l’état de
repos, les canaux sont ouverts : il y a un courant K+ sortrant.
![]()
·
[ Cl– ]EXT > [ Cl– ]INT :
Il a tendance à
entrer selon la force chimique. Mais il a tendance à sortir selon la force
électrique.
VM – E K+ = –60
– (–60) = 0 " Le courant est nul.
![]()
·
[ Ca+ ]EXT >> [ Ca+ ]INT :
Le Ca2+ a un rôle
important à la base du fonctionnement du neurone et à sa mort par une entrée
massive.
Il a tendance à
entrer selon la force chimique et selon la force électrique.
![]() Mais à l’état de
repos, tous les canaux sont fermés : la conductance du Ca2+ est nul donc il
n’y a pas le courant est nul.
Mais à l’état de
repos, tous les canaux sont fermés : la conductance du Ca2+ est nul donc il
n’y a pas le courant est nul.
Méthode
d’étude en électrophysiologique
v Courant imposé (= Current
clamp) :
 C’est la 1ère
mesure développée. Il s’agit de l’injection d’un courant et de la mesure des
variations de potentiel de membrane.
C’est la 1ère
mesure développée. Il s’agit de l’injection d’un courant et de la mesure des
variations de potentiel de membrane.
Exemple : L’effet d’un neurotransmetteur (l’acétylcholine)
sur le potentiel membranaire :
On impose un
potentiel membranaire de base (–38 ; –42 ; –45 ; … ; –70
mV) et on applique de l’acétylcholine sur la membrane.
On mesure les variations du potentiel de
membrane :
-
De
–32 à –45 mV, l’acétylcholine hyperpolarise la membrane. Mais plus les
potentiels de base « devenaient négatifs », plus l’amplitude
diminuait.
-
L’hypolarisation
disparaît pour les potentiels de base entre –45 à –47 mV.
-
De
–47 à –70 mV, l’acétylcholine dépolarise la membrane. Plus les potentiels de
base « devenaient négatifs », plus l’amplitude augmentait.
Þ
L’acétylcholine peut induire des variations de potentiels membranaires.
v Voltage imposé (= Voltage
clamp) :
Il s’agit du
maintient du potentiel de membrane à une valeur donnée, puis on enregistre un
courant traversant la membrane.
" Mesure du
courant macroscopique.
Hodkin et Huxley
ont mis en place un dispositif de rétrocontrôle électronique :
-
Il
contrôle la différence entre le potentiel de membrane effectivement enregistré
et la valeur de potentiel désiré.
-
Il
génère alors un courant pour amoindrir la différence.
" La quantité de
courant nécessaire pour maintenir le potentiel de membrane à la valeur désirée
fournit un index de la perméabilité membranaire (conductance) pour un niveau
précis du potentiel imposé.
Pour les cellules de grande taille, on
utilise 2 électrodes : TEVC (Twin electrod voltage clamp)
Pour les cellules de petite taille, on
utilise une seule électrode : SEVC (single electrod voltage clamp)

Vm = –60 mV
Vc = –30 mV
En général, on
choisit un potentiel de maintient VH à peu près égal
au potentiel de repos. On mesure un courant global.

VTEST
+20
–20
–35
–60 = VH
v Technique de Patch
clamp :
Neher et Sakmann
ont développé une variante du voltage imposé.
Il s’agit d’une
technique de mesure d’un courant ionique à travers d’une portion de membrane
(quelques canaux ioniques, voire un seul)
" Mesure d’un
courant élémentaire (unitaire) ou d’un courant macroscopique (global)
On enregistre
des sauts de courant survenant lorsque, à potentiel constant, l’état d’un canal
ionique se modifie, passant d’un état non conducteur à un état conducteur.
-
La
pipette (préalablement polie à la chaleur) entre en contact avec la membrane
(elle–même préalablement traitée aux protéases pour enlever
-
 On crée une
aspiration, formant ainsi un contact extrêmement serré entre l’orifice de la
pipette et le fragment de membrane.
On crée une
aspiration, formant ainsi un contact extrêmement serré entre l’orifice de la
pipette et le fragment de membrane.
Succion
![]()
La
résistance du contact est de l’ordre du gigaOhm (»
L’étanchéité
du contact (ou seal) a 2 conséquences :
-
La
résistance du courant entre l’intérieur de la pipette et le milieu
extracellulaire est tellement forte que les petits changements en résistance
provoqués par l’ouverture et la fermeture des canaux dans la membrane peuvent
être détectés grâce à un système d’amplificateur.
-
Il
est possible de mesurer le courant ionique selon différentes configurations.
L’établissement
du seal va déterminer la qualité de mesure :
-
Le
bruit de fond doit être le moins important,
" Le rapport signal/bruit dit être le plus
élevé.
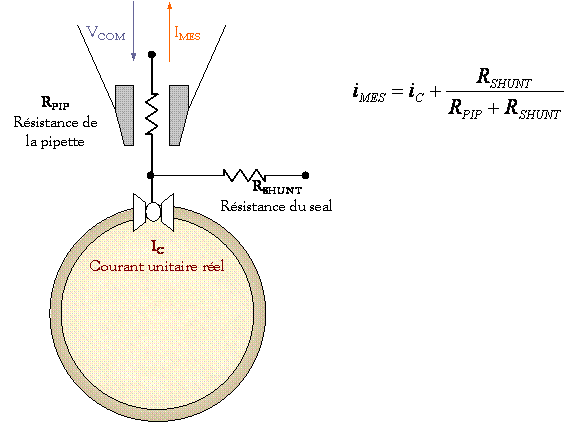
Seal
de l’ordre du :
 MW GW
MW GW
Ø Configuration
Cellule–attachée (cell attached) :
L’activité d’un
seul canal peut être étudié. Il n’y a que le seal installé.
" On travaille dans des conditions d’intégrité
de la cellule.
" Mesure de l’activité du courant élémentaire
(unitaire)
Ø Configuration
Cellule–entière (whole cell) :
Une fois le seal
installé, on crée une aspiration plus forte. Il y a alors la cassure de la
membrane emprisonnée à l’intérieur de la pipette. Cela crée une voie de faible
résistance à l’intérieur de la cellule.
Le milieu
intrapipette et intracellulaire sont mélangés.
" Mesure d’un courant global qui traverse le
reste de la cellule.
Cette technique
est moins traumatisante que l’introduction d’une électrode de mesure, dans le
cas de la technique de voltage imposé.
Limite de cette technique :
Il existe une
probabilité de perdre certains constituants de la cellule. Cela peut influencer
l’activité des canaux ioniques.
Ø Configuration
Patch–perforé :
Elle consiste en
la formation de pores dans le patch sous la pipette, par des antibiotiques
(comme la nystatine) Mais le patch devient poreux et peut casser facilement.
Ø Configuration
Inside–out :
Grâce à la
solidarité du joint, la pipette peut être utilisée pour enlever un fragment de
membrane :
-
A
partir de la configuration Cellule–attachée, on remonte doucement la pipette,
-
Il
y a cassure de la membrane et formation d’une vésicule autours de la pipette,
dont la surface externe peut être cassé en sortant pipette à l’air libre.
" La surface
cytoplasmique est au contact de la solution externe.
Þ Etude du rôle des substances et facteurs qui
agissent sur le coté intracellulaire de la membrane sur le canal ionique.
" Mesure du courant unitaire du canal piégé
dans le fragment de membrane.

Ø Configuration
Outside–out :
-
A
partir de la configuration Cellule–entière, on retire la pipette du milieu,
induisant une rupture de la membrane de part et d’autre du patch,
-
Les
bords libérés se ressoudent pour former une vésicule.
" La surface
extracellulaire est située dans le milieu externe.
Þ Etude du rôle des substances et facteurs qui
agissent sur le coté extracellulaire de la membrane sur le canal ionique.
![]()

Les travaux de
Patch clamp se font sur des cultures de cellules isolées. Mais il existe de
plus en plus des applications de technique de Patch clamp sur des systèmes plus
intégrés, tels que des tranches de cerveau.
Le courant
unitaire est caractérisé par des déflexions abruptes verticales, soit vers le
haut, soit vers le bas.
Par convention :
Pour un courant
cationique :
-
La
déflexion est vers le haut quand le courant est sortant,
-
La
déflexion est vers le bas quand le courant est entrant.
L’ouverture d’un
canal unitaire va suivre des processus aléatoires. C’est–à–dire que l’ouverture
d’un canal unitaire et son temps d’ouverture (dans des conditions données) sont
indépendants de son état passé.
On ne peut
connaître que la probabilité de
changement d’état.
v Séparation des canaux
ioniques :
Ø Utilisation
d’ions imperméants de certains canaux :
Exemples :
-
Cs
substitué au K+ peut supprimer
les courants K+ ;
-
Co,
Ni substitué au Ca2+ peut supprimer
les courants Ca2+ ;
-
Nméthyl_D_glutamate
substitué au Na+ peut supprimer
les courants Na+ ;
-
Méthylsulfurate
substitué au Cl– peut supprimer
les courants Cl– ;
Ø Utilisation
d’inhibiteurs sélectifs des canaux :
Exemples :
-
Les
canaux Na+ : TTX, STX (saxitoxine) ;
-
Les
canaux K+ : TEA, Apamine, 4_AP, Quinine ;
-
Les
canaux Ca2+ : Vérapamil, Dihydroxypyrimidine (Niférine) ;
-
Les
canaux Cl– : DIDS, IAA–94, SITS.
Ø Utilisation
de protocoles de stimulation particuliers :
·
Le potentiel de
maintien est placé à une valeur où un canal est fermé ou inactivé :

Dépolarisation de –80 à –5
mV
" INA+ + IK+
Dépolarisation de –40 à –5 mV
" IK+
Différence des 2 courbes
" INA+
A –40 mV, les
canaux Na+ sont déjà inactivés.
·
Séquences de
pulse :
VTEST
Il
existe différents protocoles :
VTEST




" Cinétique de fermeture
" Cinétique de fermeture et de réouverture
·
Temps de
mesure :
Les canaux
possèdent des temps cinétiques différents. On effectue des mesures après un
temps donné suite à la stimulation.
·
Expression du
canal dans une cellule :
On développe
l’expression du canal cloné dans une cellule (exemple des ovocytes de
xénope)
Exemple : Récepteur canal NMDA :
Il
s’agit d’un récepteur d’un neurotransmetteur excitateur : le glutamate. Il
permet l’entrée du Ca2+
Ce récepteur
fonctionne dans les processus physiologiques et cérébraux, dont la mémoire.
Il est
responsable de nombreuses pathologies, comme l’accident cardiovasculaire :
-
Les
vaisseaux sanguins bouchés déclenchent un mouvement de panique des récepteurs
NMDA.
-
Ils
créent une entrée massive de Ca2+ qui cause la
mort du neurone.
On utilise la
configuration Outside–out avec l’application de glutamate sur différents
types de récepteurs NMDA :
Un assemblage de sous–unités NR1 et NR2A présente :
" Un courant est
de plus grande amplitude,
" Un temps
d’ouverture est plus long.
Qu’avec
un assemblage de sous–unités NR1 et NR2C.
v Analyse des courants
ioniques :
Ø Amplitude
du courant :
Après un grand
nombre de la même expérience, on obtient l’histogramme d’amplitude représentant
la fréquence d’apparition du courant en fonction de son amplitude.


Dépolarisation :
j
k
l
En général, on obtient
une courbe Gaussienne (présentant un pic) Ce pic correspond à une valeur
moyenne d’amplitude de courant.
Autre exemple :
 Fermé Ouvert
Fermé Ouvert
![]() Cette
largeur est due au bruit de fond
Cette
largeur est due au bruit de fond
![]()
Courant en picoA
0 1,5
Ø Durée
d’ouverture :

Exemple de canaux K+ (courant sortant) :
+10
mV
 –45 mV
–45 mV
–70 mV
" Plus on dépolarise, plus la probabilité
d’ouverture augmente et plus l’amplitude augmente.
 Courbe d’activation :
Courbe d’activation :
Forme sigmoïde
Ø Potentiel
d’inversion du courant EINV :
EINV est la valeur
de potentiel à laquelle le courant change de sens.
A ce point, le
courant est nul.

Dépolarisation :
Courbe du courant I en fonction du
potentiel V :
I

V
EINV
Canaux
ioniques voltage–dépendants
Les canaux
ioniques Na+, K+ et Ca2+ présentent une
grande famille de protides.
-
Ils
sont responsables de variations de potentiel membranaire, en particulier du PA.
-
Ils
régulent un grand nombre de processus cellulaires.
Un grand nombre
de ces canaux ioniques ont été isolés, purifiés, clonés ; mais il y a
encore un travail de recherche immense sur leur fonctionnement.
v Structure :
Le canal est
formé par plusieurs sous–unités avec une sous–unité principale a (ou a1) et une ou plusieurs
sous–unités auxiliaires (ou secondaires)
La sous–unité a présente une grande homologie de
structure entre les différents canaux.
Pour les canaux Na+ et Ca2+ :
La sous–unité a présente 4 domaines
transmembranaires, chacun constitué de 6 segments transmembranaires (S1 à S6)
Pour les canaux K+ :
La sous–unité a est formée d’un seul domaine
transmembranaire, constitué de 6 segments transmembranaires (S1 à S6)
![]()
La sous–unité a va former le
pore sous–unité canal. Le changement de sa conformation détermine l’état du
canal.
Elle contient également un élément qui
détermine la sensibilité de ces canaux au potentiel, il s’agit plus
spécifiquement du segment S4.
Le segment S4 contient une série d’acides aminés
chargés positivement (lysine et arginine) responsable de la sensibilité au
potentiel de ces canaux.
Lors d’une
dépolarisation, ces charges positives sont attirées vers la surface externe de
la membrane.
" Le mouvement de charges produit le changement
de conformation.
Les sous–unités auxiliaires sont de nombre
et de structure différents. Elles ne sont pas bien connues : elles peuvent
modifier la cinétique du canal (stabilité de la conformation active)
v Le canal K+ « de la rectification
retardée » :
Ø Canal
unitaire :
Il est activé
par la dépolarisation et participe à la repolarisation du PA.

![]() Configuration
Inside–out :
Configuration
Inside–out :
–5 mV
![]()
–100
mV
Plus l’amplitude
de dépolarisation augmente :
-
Plus
la probabilité d’ouverture augmente,
-
Plus
l’intensité du courant augmente.
L’ouverture se fait toujours avec un délai par rapport au
début de la dépolarisation.
Histogramme de latence (ou délai)
d’ouverture :
Le délai est dû
à plusieurs changements conformationnels avant d’atteindre l’état ouvert.
 Dépolarisation de –100 à +40 mV
Dépolarisation de –100 à +40 mV
Dépolarisation
de –100 à –30 mV
Plus
on dépolarise, plus le délai diminue.
Ø Potentiel
d’inversion :
Lors d’une
variation du potentiel membranaire, on mesure le courant ionique dans les
conditions de concentrations physiologiques.
– 60

–100
– 20
–100
0
–100
+ 20
–100
" Le courant
est toujours sortant, il n’y a pas d’inversion du courant
Et à des valeurs plus négatives, il n’y a pas
d’ouverture (PO nul)
Þ On obtient le potentiel d’inversion EINV par
extrapolation.

 PO I
PO I
V V
–
90
S’il y a une
modification des concentrations et que l’on se place dans des conditions
isotoniques : [K+]EXT = [K+]INT =
– 60

–100
" EINV = 0 et EK+ = 0
– 30
Þ Le canal
sélectif pour l’ion K+
–100 (passage
presque exclusif)

+ 30
–100
Ø Courant
global :
Une
dépolarisation de membrane en courant imposé ou en patch clamp (configuration
whole–cell) met en jeu plusieurs canaux et la somation de tous les canaux donne
une courbe lisse. Cela fonctionne aussi avec un canal dans 100 expériences.


Plus la
dépolarisation est longue, plus le nombre de canaux ouverts est important.

Courbe I = f(V) :
C’est la
combinaison des 2 courbes :
La courbe d’activation : La
courbe du gradient électrochimique :


Quand tous les canaux sont ouverts,
c’est la force électrochimique qui dirige le passage ionique.
Ø Pharmacologie
:
-
TEA :
Il
s’agit du 1er composé chimique utilisé pour bloquer les canaux K+ dans les
préparations de l’axone de calmar.
Mais
il ne bloque pas spécifiquement les canaux K+ à rectification
retardée : il bloque aussi d’autres canaux K+.

(Courant
unitaire)
" L’action du TEA est dose–dépendante.
-
Cg :
C’est
un analogue du TEA.
Soit une
expérience : Cg (+ TTX pour bloquer
les canaux Na+) appliqué au niveau
intracellulaire.



+ TTX +
TTX + Cg
Il
y a un effet retardé de Cg.
En
fait, le Cg se fixe sur le canal ouvert pour annuler le courant.
Il existe d’autres inhibiteurs avec des
spécificités différentes aux différents types de canaux K+.
v Le canal Na+ :
C’est
canal voltage–dépendant (= son activation se fait dépolarisation)
Il est
responsable de la genèse du PA (phase ascendante)
Ø Inactivation :
Configuration
Inside–Out
![]()
![]()
Courant
entrant
" Cette
inactivation est caractéristique du canal Na+.
Il se présente
sous au moins 3 états :
C O I

= Etat
imperméable mais non fermé
L’inactivation
peut être affectée par la protéase (comme la pronase) qui diminue, voire
inhibe, l’état inactivé du canal.
0
![]() +
Pronase (intracellulaire)
+
Pronase (intracellulaire)
![]()
![]() –80
–80
" La
suppression de l’inactivation se fait par clivage peptidique.
Hypothèse :
L’inactivation
résulte d’un blocage du port ionique par une séquence intracellulaire de la
protéine canal, blocage qui ne se produit qu’après ouverture.
Cette
hypothèse est par la suite confirmée par les travaux réalisés sur le canal K+ « shaker
B » qui présente aussi cette inactivation.
" La zone
N–terminale est responsable de l’inactivation du canal Na+.
On parle de l’inactivation de type N.
La
zone N–terminale est séparée en 2 domaines :
-
Les
20 premiers acides aminés qui correspondent à la balle responsable directement
du blocage du pore,
-
Plusieurs
dizaines d’acides aminés qui forment à la chaîne, c’est le site de clivage par
la clypsine.

Ø Potentiel
d’inversion :
" EINV = +50 mV
Il
s’écarte un peu du ENa+ (= 58 mV)
Dans ces
conditions, le canal Na+ laisse passer
d’autres ions que le Na+ comme K+ (étude de
perméabilité relative) mais reste majoritairement perméable au Na+.
Ø Courant
global :
Soit une
préparation de l’axone géant de Calmar en potentiel imposé, en présence de TEA
pour bloquer les canaux K+ de la
rectification retardée.



+ Pronase
Courbe d’activation : Courbe
I = f(V) :
 (µA)
(µA)

–50
–30 50
La
courbe I = f(V) est la combinaison de la courbe de probabilité d’ouverture PO et du gradient
électrochimique.
Le bas de la
courbe est responsable du processus régénératif du PA.
Processus régénératif :
Une
dépolarisation membranaire
ß
Ouverture
de canaux Na+
ß
Entrée
de Na+
ß
Augmentation
de l’amplitude de dépolarisation
ß
Ouverture
de canaux Na+
ß
Etc.
jusqu’à atteindre un seuil déclenchant d’un PA
Ø Pharmacologie
:
Il existe
d’autres toxines qui peuvent affecter le courant Na+. Le canal
présente au moins 4 sites de liaison pour ces toxines.
§ 1ère
famille :
Ce sont les
alcaloïdes, des extraits de différentes espèces de plantes, comme l’aconitum,
le vératrum. Ces plantes sont connues comme étant de puissants poisons.
La caractéristique
des alcaloïdes est leur solubilité dans les lipides.
Cette famille
induit un déplacement de la courbe d’activation vers des potentiels plus
négatifs et ralentit le processus d’inactivation.
" Elle
entraîne une activité rythmique répétitive du PA.
Exemple :
La
vératridine est une toxine qui agit sur le côté intramembranaire (lipophile) du
canal Na+.
" Le courant
ionique dure plus longtemps (de l’ordre des secondes au lieu de ms) sans
application de dépolarisation.
Elle entraîne
l’ouverture de canaux Na+ générant ainsi
un PA (exemple des crises d’épilepsie)
De plus, elle
entraîne une diminution de l’inactivation.
" Le PA dure
donc plus longtemps.
§ 2ème
famille :
On y retrouve des
toxines de scorpion et d’anémone de mer, elles sont appelées a–toxines.
Elles
entraînent le ralentissement, voire le blocage, de l’inactivation et donc le
prolongement du PA. Elles agissent sur la face extracellulaire de la sous–unité
a
(entre les segments S5 et S6)
§ 3ème
famille :
Il s’agit de la
famille des b–toxines
extraites à partir de venin de scorpion.
Leur
caractéristique est la réduction du seuil d’activation du canal sans modifier
l’inactivation. Leur action se fait sur la partie extracellulaire : un
site différent des a–toxines.
" Il y a une
ouverture du canal lors d’un potentiel de repos.
§ 4ème
famille :
C’est
la famille des brévétoxines.
Elles déplacent
la courbe d’activation et bloque complètement l’inactivation par une action
membranaire.
Leur utilisation
sert à l’isolation des différents canaux Na+ (± sensibles aux
différentes toxines) Elles servent de sonde moléculaire.
v Le potentiel
d’action :
Il
présente 2 périodes réfractaires :
-
Une
période absolue = Tous
les canaux Na+
inactifs, il n’y pas d’autre PA déclenché ;
-  Une période relative = La probabilité que les canaux Na+ se referment est encore petite, il est difficile pour refaire
un PA.
Une période relative = La probabilité que les canaux Na+ se referment est encore petite, il est difficile pour refaire
un PA.
La
phase de repolarisation :
-
dure
plus longtemps avec d’ajout de pronase (canaux Na+),
-
dure
encore plus longtemps avec l’ajout de TEA (canaux K+),
-
est
complètement bloquée quand ces 2 substances sont couplées.
" La phase de
repolarisation met en jeu l’inactivation des canaux Na+ et K+.

Exception :
Certains PA
mettent en jeu une entrée Ca2+ via des canaux Ca2+ voltage–dépendant.
v Le Canal Ca2+ :
En absence de Na+ et l’ajout de
TTX, on observe la génération d’un PA à plateau calcique.

Ce
PA dure plus longtemps.
Il est dû à un
flux de Ca2+ à travers des canaux spécifiques
au Ca2+. Leur conformation dépend du
potentiel membranaire (ils sont voltage–dépendant)
Une
dépolarisation induit l’ouverture de ces canaux et donc une entrée massive du Ca2+.
Le
PA à plateau calcique (observé dans les neurones et les fibres musculaires du
cœur) peut être dû :
-
Soit
uniquement par une entrée de Ca2+ " Plateau calcique pur ;
-
Soit
par une entrée de Ca2+ accompagnée par
l’ouverture de canaux Na+ " Ouverture plus importante ;
La
repolarisation est liée à l’activation de canaux K+ dépendant du Ca2+.
Il
existe 2 familles de canaux Ca2+
voltage–dépendants :
-
Les
canaux calciques de type L,
-
Les
canaux calciques de type T.
Les canaux
calciques de type L :
Ils ont un seuil
d’activation bas (» –70 mV) et présentent une
inactivation.
Ils sont appelés
LVA = Low Voltage Activated.
Les canaux calciques de type T :
Ils ont un seuil
d’activation haut. Ils sont appelés HVA =
High Voltage Activated.
Les
HVA ont un rôle important dans les phénomènes du système nerveux. Leur trop
grande activation peut aboutir à la mort du neurone (conditions pathologiques)
L’étude
des canaux Ca2+ est contrecarrée par des
problèmes expérimentaux :
-
Il
n’existe pas de préparation riche en canaux Ca2+
voltage–dépendants.
-
De
plus, les canaux Ca2+ présentent des
caractéristiques physiques particulières telles qu’une inactivation Ca2+–dépendante, la
perte d’activité sur un fragment de membrane isolée.
Ces
caractéristiques doivent être considérées pour l’étude de ces canaux.
Au niveau
cérébral, il existe un gradient de concentration très fort :
-
[Ca2+]INT = 10–7 M
-
[Ca2+]EXT = 10–3 M
Ceci porte la
valeur du ECa2+ à des valeurs très
positives : ECa2+ » + 116 mV
Le gradient
électrochimique est en faveur d’une entrée de Ca2+ et localement
la concentration en Ca2+ est susceptible
de varier de façon très importante. Or l’augmentation de la concentration
interne en Ca2+ peut être à l’origine de
plusieurs phénomènes.
Exemple :
-
L’activation
des canaux K+ dépend à la concentration
interne en Ca2+.
-
L’inactivation
des canaux Ca2+ dépend à eux–même.
-
L’activation
d’un grand nombre de protéines, dont des enzymes (comme la phosphatase, la
kinase, etc.)
Tous ces
phénomènes sont impliqués dans l’activité physiologique du neurone (libération
du neurotransmetteur, l’expression des gènes)
Il
est donc nécessaire que la concentration interne en Ca2+ soit très
finement régulée de manière que le taux de Ca2+ intracellulaire
soit maintenu à des valeurs très basses.
Pour cela, il
existe des mécanismes de régulation (pompes ATP–dépendantes, réticulum
endoplasmique, protéines fixant le Ca2+)
Expérimentalement,
pour maintenir la concentration intracellulaire en Ca2+ à des valeurs
fixes, on introduit un tampon calcique du type EGTA ou BAPTA (= chélateurs de Ca2+)
Ø Caractéristiques des canaux Ca2+ :
-
Phénomène de
« Run down » (= disparition) :
Certains canaux Ca2+
voltage–dépendant perdent leur activité quand on travaille sur un patch isolé.

+
Protéine Kinase A
0 0
–40 –40
0
–40
Conclusion :
Le passage de la
configuration Cellule–attachée à la configuration Inside–Out a causé la perte
de certains éléments dont dépendent les canaux Ca2+.
Ces canaux sont
donc dépendants de leur état de leur état de phosphorylation (PKA)
" Il faut que le canal soit phosphorylé pour
être activable.
En réalité,
c’est un peu plus compliqué…
Il peut y avoir
un 2ème mécanisme :
On peut ajouter
de la leupeptine pour inhiber
l’irréversibilité
du phénomène de run down
Le Fura2 est une
sonde fluorescente dont l’intensité dépend du Ca2+.
Le Barium est un
équivalent du Ca2+ (même perméabilité)
" Certains canaux Ca2+ vont être
inactivé par le Ca2+ lui–même :
(configuration Whole–cell)
0

–40
Ca2+ Ca2+
Ba2+ Ca2+ + chélateurs
Avec
juste du Ca2+, il y a une diminution de
l’amplitude du courant entrant :
" Régulation
pour éviter une entrée massive qui peut être délétère pour la cellule.
Schéma :

Ca2+ Calcineurine
& [Ca2+] (= déphosphatase)
Ø Canaux Ca2+ à haut seuil d’activation :
Ils forment une
famille hétérogène de canaux voltage–dépendant. Ils ont un rôle important dans
la libération de neurotransmetteur (avec le PA)
Ils
sont mis en jeu dans certains PA (caractéristique
majeure : haut seuil)
 Ils ont des
activation et inactivation lentes.
Ils ont des
activation et inactivation lentes.
![]()
![]() 0
0
![]()
![]()
![]()
![]() –80
–80
Le courant de
queue est une augmentation du courant au moment de la repolarisation.
Explication de ce courant :
" Le courant est la conjugaison de la
perméabilité du canal et du gradient électrochimique :
j
Le gradient électrochimique est important : Vm – ECa2+ = –80 – 116 = –196 mV
Mais les canaux sont fermés.
k
Le gradient électrochimique est moindre : Vm – ECa2+ = 0 – 116 = –116 mV
Mais les canaux sont ouverts, il y a donc un
courant.
l
Le gradient électrochimique est important : Vm – ECa2+ = 0 – 116 = –196 mV
Et les canaux sont ouverts, il y a donc un
fort courant.
Ce courant de queue
est aussi observé dans certains canaux K+.
Courbe I =
f(V) : (µA)

» 70
EINV » +70 mV
ECa2+ = +116 mV
" Il y a une non sélectivité du canal par
rapport à l’ion Ca2+.
Le rapport de
perméabilité du Ca2+/K+ = 6000
Il y a une
multiplicité des canaux Ca2+ à haut seuil d’activation :
" Il existe des
canaux de type : L, N, O, P, Q, R (et plus s’il y a une autre découverte)
Ces différents
canaux sont plus ou moins sensibles à des inhibiteurs pharmacologiques.
Exemple :
-
Les canaux de
type L
sont sensibles à la nitreudipine et à la dihydropyrimidine (un médicament
utilisé pour les problèmes cardiaques et
de vascularisation)
-
Les canaux de
type N
sont bloqués de façon plus spécifique par la w_conotoxine_GVTIA.
-
Les canaux de
type P
sont bloqués par
Les
canaux N ont un rôle dans la libération de neurotransmetteur, et sont
synthétisés dans plusieurs structures du SNC.
Les
canaux P sont synthétisés presque exclusivement dans les cellules de Purkinje
(soit »
92% des canaux Ca2+)
Les proportions
des différents types de canaux à haut seuil dépend du type cellulaire et de la
région étudiée.
+
Nitreudipine
![]()

2
Canaux
![]() de type L + w_conotoxine
de type L + w_conotoxine
1
Canaux
de type N
Les gènes codant
pour la sous–unité a1 des canaux Ca2+ ont été clonés,
d’abord à partir du muscle squelettique, puis à partir de divers tissus dont le
cerveau.
Les 5
sous–unités a1 sont codées par
5 gènes différents qui ont été identifiés : les gènes A, B, C, D et S.
-
Les
sous–unités C, D et S correspondent à des canaux de type L,
-
La
sous–unité B correspond à des canaux de type N,
-
La
sous–unité A correspond à des canaux de type P.
Il existe plusieurs
variants pour chaque sous–unité a1 selon le
phénomène d’épissage alternatif.
Exemple : La sous–unité a1D présente 4
variants.
Il existe des
sous–unités auxiliaires a2, b, g, etc. donc le rôle n’est pas
trop connu.
Par contre, on
sait que la sous–unité b est une sous–unité cytoplasmique
qui module l’activité du canal.
La
présence de cette sous–unité fait augmenter considérablement l’amplitude du
courant de Ca2+ et fait diminuer le seuil
d’ouverture.
![]() I
I
10 20 V

a1
a1+b
Ø Canaux Ca2+ à bas seuil d’activation :
L’existence de
ces canaux, appelés LVA, a été suggérée, il y a plus de 20 ans, pour expliquer
l’activité rythmique déclenchée dans les neurones thalamiques à la suite de
leur hyperpolarisation.
Cette activité,
un peu paradoxale de part son activation par hyperpolarisation, semblait
s’expliquer par l’existence de canaux Ca2+.
Ces dernier sont
partiellement inactivés dans la gamme du potentiel de repos, mais leur
l’activation est à nouveau permise par l’hyperpolarisation de ces neurones.
L’avènement de
la technique de Patch Clamp a permis une description électrophysiologique de
ces canaux.
En fait, au
niveau du thalamus, l’étude des canaux a permis de confirmer l’implication de
canaux de type T dans :
-
la
genèse de l’activité rythmique des neurones,
-
l’activité
cardiaque,
-
la
sécrétion hormonale des neurones hypothalamiques,
-
l’épilepsie.
Inactivation des canaux à bas
seuil :
Etude de
neurones sensoriels dans la conformation de whole–cell :
 VTEST = –35
VTEST = –35
![]() VH =
VH =
Le canal est déjà inactivé. Pour avoir une réactivation, il faut atteindre une nouvelle
hyperpolarisation.
– 55 :
– 65 :
![]() – 75 :
– 75 :
– 85 :
– 95 :
– 105 :
Courbe d’inactivation :
I/IMES

1
0,5
VH
–80 –40
Il
existe une diversité de canaux :
On
connaît 3 gènes différents pour a1 " 3 isoformes de a1.
De plus, pour chaque sous–unité, il y a
différents variants.
Ø Localisation et rôle spécifiques des canaux Ca2+ :
Les HVA et les
LVA peuvent coexister au niveau d’une même cellule.
Etude sur un
neurone sensoriel :
Les canaux Na+ et K+ sont bloqués.
I (mA)
 –50 –10 V
–50 –10 V
0

–1
–2
Etude sur la
synapse géante de calmar :
 Les canaux Na+ et K+ sont bloqués.
Les canaux Na+ et K+ sont bloqués.
Courant pré–synaptique
Courant
post–synaptique
ICa2+
ICa2+ est
normalement vers le bas (courant entrant) Ici, il est indiqué vers le haut pour
faciliter la lecture de la courbe.
L’entrée massive
de Ca2+ au niveau pré–synaptique est
responsable de la libération de neurotransmetteur (due au gradient
électrochimique)
Plus le PA est
bref, plus les canaux Ca2+ HVA (= de type
T) sont impliqués dans le courant global.
Û
Plus le PA est
long, plus l’implication des canaux Ca2+ LVA est
proportionnellement importante.
[Ca2+]INT

Temps du PA

