
Retour au sommaire des cours |

Une version pdf est à votre disposition ici. |
« Je le
répète chaque année et je ne le vois pas dans la moitié des copies.
Alors,
je ne cesserai pas de vous le répéter tout le long de ce cours et ça ne sera
pas de trop
»
Les lymphocytes B et T sont les 2 types de cellules importantes dans
la réponse immune car ils possèdent des récepteurs spécifiques aux antigènes.
Il
existe dans lenvironnement de nombreux microorganismes qui attaquent notre
organisme. Il doit donc avoir une défense : le système immunitaire qui
permet de développer des réponses immunes.
Immunité : Résistance des individus visàvis dagents
infectieux.
Immunologie : Etude de limmunité visàvis dagents
infectieux.

Anticorps
: Molécule de nature protéique produite par la
ligne B (chez les vertébrés) en réponse à un antigène en se liant à celuici de
manière spécifique.
Antigène : Molécule qui induit spécifiquement la
production danticorps.
v Les cellules impliquées
dans la réponse immune :
Toutes
les réponses immunitaires ont la même origine : une origine
hématopoïétique.
Il
y a aussi dautres cellules avec une autre
origine comme les cellules épithéliales
De cette origine, 2 lignées se
distinguent :
-
La
lignée lymphoïde : Lymphocytes T et B (en priorité),
-
La
lignée myéloïde avec :
-
Les
polynucléaires et les macrophages,
-
Les
mégacaryocytes et les plaquettes,
-
Ainsi
que les globules rouges.
Immunité
spécifique :
Elle
est appelée aussi immunité humorale. Elle est due à la lignée lymphoïde.

 BCR (B_Cell receptor) TCR (T_Cell receptor)
BCR (B_Cell receptor) TCR (T_Cell receptor)
(=
Immunoglobuline
de membrane)
Les
lymphocytes T sécrètent des cytokines (CK, anciennement lymphokines)
On parle
dimmunité à médiation cellulaire.
On
observe un phénomène mémoire :
la réponse immunitaire augmente en rapidité (et donc en efficacité) lors dune
réinfection.
On parle
dimmunité acquise ou immunité adaptative.
Immunité non
spécifique :
Elle est appelée aussi immunité innée ou naturelle.
Elle est due à la lignée myéloïde, notamment les polynucléaires et les
macrophages (fonction de phagocytose)
La réponse immunitaire est basique : il ny a
pas de phénomène mémoire. Elle consiste en laction :
-
Du
lysosyme (au niveau des muqueuses) = substance protéique qui détruit lantigène
infectieux,
-
Du
complément qui augmente le processus inflammatoire en stoppant la
progression de lantigène et en favorisant lopsonisation (phase de
phagocytose),
-
Les
interférons a,
b
et g
(mais surtout a et b) qui ont une
action antivirale.
 Antigène
Antigène
Lymphocyte
Cellule
phagocytaire
Destruction
de lantigène piégé dans la cellule phagocytaire
Anticorps
Cytokines
D Notion de clonalité pour les lymphocytes B et
T.
Phagocytes
![]()

La lignée
lymphoïde :

Cytokine
Cytokine
Anticorps
Macrophages,
polynucléaires (lignée myéloïde)
Lymphocyte B
Lymphocyte T

La
phagocytose :
-
Adhésion (ou
opsonisation) :
Il
y a des facteurs cellulaires et extracellulaires : pH, température,
présence dions (notamment le Ca2+ et Mg2+) et la présence
opsines (molécules sériques intermédiaires entre les cellules et les antigènes)
qui se fixent sur des récepteurs aux opsines, dont les RFC.
-
Ingestion :
Elle
consiste en la formation dun phagosome. On observe un changement de pH
(acidification)
-
Digestion :
Elle
consiste en une dégradation enzymatique (lyse) et une exocytose des débris. La
lyse se fait par 2 mécanismes : un dépendant de la consommation dO2 et un
indépendant.
Laugmentation
de la consommation dO2 entraîne une
augmentation du catabolisme du glucose et donc une augmentation des radicaux
libres, ensuite oxydés en H2O2.
La
phagocytose est étudiée dans léventualité de traitement des tumeurs et des
inflammations. Comme tout mécanisme, il peut présenter des pathologies
(attaques de cellules normales)
Les polynucléaires
neutrophiles :
Ils sont caractérisés par la présence de granules
colorables (colorant basique comme le bleu de méthylène ou colorant acide
comme léosine) Il existe :
-
Des
granules IAIRES : les
lysosomes,
-
Des
granules IIAIRES : les plus
dense et un peu plus petites,
-
Des
peroxysomes qui contiennent des peroxydases.
Les
polynucléaires neutrophiles présentent une chimiotactie : ils peuvent se
déplacer sur le site de lagression.
Ils phagocytent
surtout des bactéries et des levures.
Les
polynucléaires eusitophiles :
Ils
ont des granules (colorables) sous forme de cristaux (structure cristalloïde)
qui contiennent des enzymes (en majorité des lysophospholipases)
Leur nombre
augmente avec linfection par des helminthes (vers plats) Ils sont stimulés par
certaines immunoglobulines.
Les
polynucléaires basophiles :
Ils
sont rares. Ils possèdent des granules particulières que lon met en évidence
par des colorations basiques. Ces granules contiennent des enzymes dont
lhistamine et lhéparine (médiateurs préformés)
" Ils interviennent dans les réactions
allergiques.
Lallergie est
une pathologie du système immunitaire. Il sagit dune hypersensibilité de type
I.
IgE

Normalement, les
IgE (produites par les lymphocytes B spécifiquement en réponse à lallergène)
disparaissent en quelques jours. Mais elles peuvent se fixer sur un
polynucléaire basophile. Ce dernier effectue un « comptage » et, si
les IgE sont en trop forte quantité, il libère de lhistamine.
Les monocytes
(circulants) et macrophages (fixés dans un tissu) :
Ils
présentent un noyau en forme de fer à cheval et un cytoplasme granuleux
(lysosymes, peroxydases, etc.)
La
transformation des monocytes en macrophages est stimulée par des cytokines.
Ils
causent la destruction des cellules cibles par cytotoxicité et dégradation
enzymatique. Ils constituent le système réticulohistiocytaire.
Les macrophages :
Ils
sont présents un peu partout dans lorganisme (poumons, foie, os, tissus
lymphoïdes, etc.)
-
Ils
ont la capacité de sinfiltrer dans les tissus et fixer les particules
étrangères (réponse immunitaire non spécifique)
-
Ils
informent aussi le système immunitaire de la présence dantigènes : les macrophages sont des CPA (cellules
présentatrices dantigènes)
Les
mégacaryocytes :
Ce
sont des cellules géantes avec beaucoup de cytoplasme. Ce dernier se fragmente
pour former les plaquettes (absence de noyau)
Les
plaquettes ont un rôle dans le mécanisme de lhoméostasie, mais elles nont
quun faible rôle dans la réponse immune : activation des lymphocytes et
des polynucléaires neutrophiles.
Les
érythrocytes :
Ce
sont les globules rouges. Leur rôle majeur est le transport de lO2, mais ils
participent aussi à la réponse immune en éliminant le complexe immun.
Les cellules NK
(natural killer) :
Elles
permettent lélimination des cellules tumorales. Elles présentent des éléments
membranaires communs aux lymphocytes T.
v Les organes
lymphoïdes :
Tous les organes lymphoïdes comportent un système
sanguin et un système lymphatique. Il existe 2 types dorgane lymphoïde :
-
Les
organes lymphoïdes IAIRES (ou
centraux) : la moelle osseuse et le thymus,
-
Les
organes lymphoïdes IIAIRES (ou
périphériques) :
-
Les
organes lymphoïdes encapsulés : la rate, les ganglions lymphatiques, etc.
-
Les
organes lymphoïdes non encapsulés (ou diffus) : tissus associés à des
muqueuses. Exemples :
-
GALT :
tissu associé à lintestin (= gult en
anglais),
-
MALT :
tissu associé aux muqueuses.
Le
passage dun organe lymphoïde IAIRE à un organe
lymphoïde IIAIRES se fait par le
système sanguin.
Ø Le
thymus :
Il
se situe dans le thorax. Cest un organe lymphoïde encapsulé par une enveloppe
de tissu conjonctif. Le thymus involue en îlots thymiques à la puberté.
Chez les
mammifères et les oiseaux, il apparaît lors de la 7ème semaine de
développement.
Pathologie :
Le
syndrome de DiGeorge est une maladie congénitale qui consiste en labsence de
thymus durant le développement. Cette absence est souvent que partielle. Elle
cause labsence de lymphocytes T et une diminution des B (absence de réponse
immune spécifique)
Des cellules dorigine épithéliale (cellules
« nurse ») servent de support des lymphocytes T et aide à leur
différenciation par la sécrétion dhormones.
Lors de la
différenciation, il y a beaucoup de perte (apoptose fréquente) ; cest
pourquoi il y a une forte présence de macrophages.
 Cortex (zone
corticale) : LT immatures : CD
et CD
Cellules peu développées
Cortex (zone
corticale) : LT immatures : CD
et CD
Cellules peu développées
Superficiel
LT
immatures : CD1 et CD2
Profond
Zone
corticomédulaire
LT
immatures : TCR, CD3 et CD2 ( ?)
LT
matures : TCR, CD
et CD4 ou CD8
Médula (zone
médullaire) Cellules très développées
Ø La
moelle osseuse :
Elle
est mise en place vers les 910èmes semaines.

Sang
Pré B " " " " LB mature &
Ø La
rate :
Elle est située dans la partie gauche de labdomen,
derrière lestomac. Elle est très étudiée dans les rejets de greffe. Elle joue
le rôle de filtre.
On observe 2
régions : la pulpe blanche et la pulpe rouge (élimination des hématies)



Ø Les
ganglions lymphatiques :
Ils constituent la chaîne ganglionnaire. Ils ont
aussi un rôle de filtre (présence de macrophages)
La
formation lymphoïde se fait autour des vaisseaux lymphatiques.
On y observe
aussi des lymphocytes T et B en fin de différenciation.
Cortex :
follicules lymphoides :
Paracortex :
zone thymo-dépendante :
Région médullaire :
zone mixte :
Cellules B et plasmocytes, cellules T, macrophages
Lymphocytes T et macrophages
Cellules B, quelques T, cellules dendritiques
Capillaires lymphatiques afférents

![]() Aorte
Veine Hile
Aorte
Veine Hile
Capillaire
lymphatique efférent
v Mécanisme du Homing et
circulation lymphocytaire :
La
population des lymphocytes B et T est très diverse et doit reconnaître le
« nonsoi » uniquement. Il faut donc lui apprendre à aller vers
celuici. Ceci nécessité une coopération entre les lymphocytes B et T, ainsi
quune réponse fonctionnelle.
Lenvironnement du lymphocyte est
capable de jouer un rôle sur lhoméostasie du système immun. Pour préserver
cette homéostasie, il faut 2 mécanismes :
-
La
circulation des lymphocytes,
-
Le
homing (= reconnaissance)
Les
cellules endothéliales et des molécules dadhésion sont impliquées dans cette
homéostasie en permettant la fixation lymphoendothélium (liaison
ligandrécepteur)
Conclusion :
Les lymphocytes sont programmés :
-
Au
départ, ils sont « naïfs » (cad : sans avoir rencontré
dantigène)
-
Ils
font 2 ou 3 fois le tour de la circulation avant de rencontrer un antigène
(probabilité de rencontre)
-
Une
fois lantigène rencontrer, il termine sa différenciation et développe soit un
mécanisme effecteur, soit un mécanisme mémoire.
Il
faut comprendre les interactions cellule à cellule :
-
Ligand +
Récepteur
-
Antigène +
Anticorps
-
Cytokine +
Récepteur
-
Substrat +
Enzyme Û Complexe
EnzymeSubstrat
-
Liaison
forte : Liaison covalente
" Nécessité
denzymes, dhydrolyse, dénergie pour les casser
(Exemple :
pont disulfure)
-
Liaison
faible : Liaison hydrogène
(entre H et un atome plus électopositif comme O),
Liaison
électrostastique (entre des particules chargées : force de Van der Waals),
Liaison hydrophobe (quand des molécules deau
entourent des groupements non polaires)

En
immunologie, on caractérise la liaison antigèneanticorps comme étant une
liaison exothermique (2 à 40 Cal) Il sagit dune liaison spécifique
réversible.
" Antigène
+ Anticorps Û AntigèneAnticorps
La
dissociation est possible par la chaleur, le pH ou avec un apport de cations.
Laffinité est
lintensité des forces qui vont participer à la liaison antigèneanticorps.
La
pente k correspond au facteur dassociation ou de dissociation.

Pente
k forte : grande
affinité
104
< k < 1012
Pente
k faible : peu daffinité
En
immunologie, la constante k varie entre : 107 1010 " Faible affinité
1010 1013 " Forte affinité
Lavidité dun anticorps
pour un antigène spécifique est caractérisée par la rapidité de la réponse
immune. Elle dépend :
-
De
la constante dassociation,
-
De
la balance de lanticorps,
-
Du
nombre dépitopes.
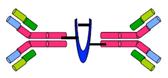
v Structure des
immunoglobulines :
Le
plus souvent, on étudie limmunoglobuline de classe G (IgG)
Mais il existe 5 classes : A, D, E,
G et H. Ces différentes classes présentent des points communs :
-
Molécule
symétrique,
-
Constituée
de chaînes polypeptidiques de 2 catégories :
-
Des
chaînes lourdes ou chaînes H (heavy),
-
Des
chaînes légères ou chaînes L (light)
-
Stabilité
par des ponts disulfure.

Spécificité :
Le nom de la chaîne lourde détermine le nom de
limmunoglobuline :
-
a, d, e, g ou m " chaînes
lourdes,
-
k ou l " chaînes
légères.
Exemple : (H2 k2) ou (H2 l2) qui peut être
répété n fois :
-
n
=1 : Ig monomérique qui existe dans
toutes les classes,
-
n
=2 : pour les IgA et certaines IgM,
-
n
=5 : pour les IgM (= IgM
pentamériques)
Il
existe des sousclasses, essentiellement pour les IgG qui présentent 4
sousclasses dues à des variantes de la chaîne lourde (g1, g2, g3 et g4), mais aussi
pour les IgA (a1 et a2)
Rappels sur la
nomenclature :
Elle
a été établie à laide de 2 enzymes couramment utilisées : la papaïne et
la pepsine.
Disparition de la région
C_terminale par réduction

Fab = Fragment « antigen
binding »
Fc = Fragment cristallisable
(Cest le site
de fixation du complément)
Remarque :
Les
anticorps peuvent se fixer sur les antigènes (au niveau du Fab) mais peuvent
aussi se fixer sur des cellules de lorganisme (au niveau du Fc) ce qui peut
entraîner des faux positifs dans les expériences. Cest pourquoi les
laboratoires utilisent des fragments F(ab)2.
-
Il
existe des ponts disulfures entre 2 chaînes différentes (ponts disulfures
interchaînes) et des ponts disulfures à lintérieur de la chaîne (ponts
disulfures intrachaînes)
-
Les
extrémités NH2 sont le site de liaison à
lantigène.
-
Il
existe 2 régions principales (ou domaines) :
-
Régions
variables : VL et VH,
-
Régions
constantes : CL, CH1, CH2, CH3 et CH4 (plusieurs
catégories de région constante et parfois plus comme chez les IgM et IgE)
-
La
région de reconnaissance de lantigène est une région hypervariable pour
sadapter à la diversité antigénique.

Ø Les
IgA :
Elles
présentent 2 chaînes lymphocyte (l ou k) et 2 chaînes H de sousclasses a1 et a2.
Il existe des
IgA :
-
 Monomériques (⅔ des IgA du
sang)
Monomériques (⅔ des IgA du
sang)
-
 Dimériques, qui
sont reliées dune pièce de jonction (= chaîne J) par des liaisons covalentes
avec les avantdernières cystéines de la partie Cterminale de chacune IgA.
Dimériques, qui
sont reliées dune pièce de jonction (= chaîne J) par des liaisons covalentes
avec les avantdernières cystéines de la partie Cterminale de chacune IgA.
-
Sécrétrices,
qui sont retrouvées dans les sécrétions (en particulier dans les sécrétions
intestinales, mais aussi dans la salive, les bronches, etc.) Elles présentent
une pièce sécrétrice (ou sécrétoire) synthétisée au niveau des cellules
épithéliales.
Exemple : Lintestin :
La
pièce sécrétrice a pour fonction de protéger lIgA dimérique de la dégradation
enzymatique.

Il existe surtout des IgA2 : les IgA1 sont plus
fragiles aux protéases.
 Les
IgM :
Les
IgM :
Elles présentent 4 chaînes H de classe m.
Elles existent sous forme soluble ou
membranaire. Sous forme soluble, il y a la formation dIgM pentamérique (n = 5)
liée par une pièce de jonction.
Chez
lhomme, la forme principale est la forme pentamérique. Chez la souris, il
existe parfois des hexamères. Les monomères constituent la plupart de nos BCR.
Ø Les
IgD :
Elles
sont monomériques. Comme les IgM, elles sont peu nombreuses dans le sang (inf.
à 1%) Ceci est dû à leur tendance à la protéolyse et au fait quelles sont la
plupart du temps fixées à la membrane pour la reconnaissance de lantigène.
Il
est donc difficile de les étudier en dehors dune situation pathologique
(myélome dIgD)
Ø Les
IgE :
Elles sont monomériques et possèdent 4
chaînes constantes. Elles sont présentes en faible concentration dans le sang.
Elles sont responsables du développement dune
hypersensibilité de type I (allergie)
En effet, elles
sont capables de se fixer par leur Fc sur les polynucléaires basophiles et les
mastocytes, entraînant la libération dhistamines.
|
|
IgG |
IgD |
IgA |
IgD |
IgE |
|
Proportion dans le sang |
Dont |
|
|
Traces |
Traces |
|
Poids moléculaire |
155 000
Da |
950 000
Da |
170 000
Da Pour
le pentamère |
180 000
Da |
190 000
Da |
|
Formes |
(g2
l2) (g2
k2) |
(m2
l2) x5 + J (m2
k2) x5 + J |
(a2
l2) (a2
k2) (a2
l2) x2 + J (a2
k2) x2 + J (a2
l2) x2 + J + CS (a2
k2) x2 + J + CS CS =
composante sécrétrice |
(d2
l2) (d2
k2) |
(e2
l2) (e2
k2) |
v Réarrangement des
immunoglobulines :
Comment dans une
même protéine
peutil y avoir
des séquences variables et constantes ?
Le
nombre dantigènes sélève à 109 1010. Notre système
immun doit pouvoir faire des récepteurs pour reconnaître les antigènes et
fabriquer des anticorps pour y répondre.
Au
début, on partait sur lhypothèse de base quun gène codait pour une protéine.
Mais il aurait alors fallu 109 1010 gènes codant
uniquement pour les différentes immunoglobulines. Cette hypothèse a donc été
revue : un gène pour plusieurs produits protéiques.

Duplications géniques
= Superfamille
des immunoglobulines
Il existe un mécanisme responsable de
cette synthèse : cest le réarrangement des immunoglobulines. Il est
décrit dans le système lymphoïde uniquement.
Pour
quune immunoglobuline soit fonctionnelle, il faut un réarrangement des gènes
fonctionnel.
Ø Mécanisme
de recombinaison (ou réarrangement) génique :
§ Les chaînes k :
Les
gènes se situent sur le chromosome 2.
Une
chaîne k est constituée
dune région V et une autre C. Il y a la nécessité de 3 catégories de
gènes : C, V et J.
Description
avant et après réarrangement :
-
Sur
lADN, il y a plusieurs gènes impliqués (V, J et C)
-
Les
gènes V : 150 à 300 gènes différents (dans la région
-
Les
gènes J : un peu plus de 5 gènes différents,
-
Un
seul gène C.
-
Les
gènes V et J sont séparés par plusieurs centaines de kb.
-
Il
y a la présence dune séquence leader (L) devant chaque gène V qui disparaît
sur la dernière étape de maturation de la protéine (protection)
-
La
chaîne C est codée par le gène C ; la chaîne V est codée par un
réarrangement de V et J.
-
Il
y a système de « coupercoller » pour donner une nouvelle structure
VJ :
-
Coupure
en
-
Elimination
de la partie entredeux,
-
Association
des brins.
D Le terme de
« coupercoller » nest pas à réutiliser (dans une copie par exemple)
Cest juste pour faire comprendre le
mécanisme.
Ce
mécanisme de réarrangement est aléatoire, mais il est sous le contrôle de
mécanismes moléculaires.
![]()

Eléments de
contrôle :
-
Présence
de séquences heptanonamères (= RRS
= Recombinaison Signal Sequence)
-
Heptamère :
-
 Nonamère :
Nonamère :
-
Elles
sont séparées par 23 pb du coté du gène V et de 12 pb du coté du gène J.
-
Elles
suivent la loi des 1223 qui consiste en la complémentarité des bases
entraînant un rapprochement des gènes V et J.
-
Présence
de la recombinase. Il sagit dune
enzyme spécifique de la lignée lymphoïde qui empêche les recombinaisons
illégitimes. Pour cela, elle possède 2 activités : endonucléase et ligase.
-
Les
gènes RAG1
et RAG2 (= Recombinaison ou Recombinase Activating Gene)

Coding
ends
![]()
![]() Signal ends
Signal ends
Protéines synthétisées par RAG1 et RAG 2
Ce
sont des éléments spécifiques de la lignée lymphoïde et du réarrangement.
-
-
Lacétylation des histones peut modifier
la structure de la chromatine. Sans lacétylation, la recombinase et les
protéines de RAG1 et RAG2 ne pourraient
pas reconnaître les séquences heptanonamères.
§ Les chaînes l :
Les
gènes se situent sur le chromosome 22.
-
Sur
lADN, il y a plusieurs gènes impliqués (V, J et C)
-
Il
y a autant de gènes J que de gènes C.
![]()
Leader
Elimination
Dans les régions variables, il existe
des régions hypervariables. Elles sont sous le contrôle de mutations somatiques (hypersomatiques) Elles sont plus tardives que
les autres mécanismes.
Cest
une spécificité de la lignée des lymphocytes B (environ 1000 mutations par
division cellulaire)
On
pense quelles ont lieu surtout dans les organes lymphoïdes IIAIRES.
§ Les chaînes lourdes :
Les
gènes se situent sur le chromosome 14.
-
Sur
lADN, il y a plusieurs gènes impliqués (V, D, J et C)
![]()
-
1ère
recombinaison : D " J
-
2ème
recombinaison : V " D

Bloc de gènes de
C :
![]()
l :
Séquence Switch.
Elle est présente devant chaque gène C (sauf pour le gène Cm)
La
1ère chaîne lourde synthétisée est une chaîne lourde m : IgM (= immunoglobuline
membranaire) Parfois, cela peut aussi être une IgD.
Immunoglobuline
membranaire :
Les IgM et les IgD sont, pour la plupart du temps,
fixés. Dans le cas où les IgM sont sécrétées, elles forment des pentamères.
Les transcrits
sont faits avec Cm et Cd ou avec Cm seulement. La
sélection se fait ensuite avec un épissage alternatif.
Cm et Cd sont sous le
contrôle de la même séquence S. Le fait que Cm et Cd soient les 1ers
à être synthétisés sexplique par le fait quils soient les plus proches.
Immunoglobulines sécrétées :
La séquence synthèse est responsable de
la commutation des chaînes lourdes des immunoglobulines. La commutation est la
recombinaison entre 2 séquences synthèse et lélimination de ce quil y a
entredeux.
Cette
recombinaison est irréversible et conduit à lévolution clonale.
|
|
V |
D |
J |
C |
|
|
Chaîne L |
k |
Inf. à 300 |
|
5 |
1 |
|
l |
Inf. à 300 |
|
6 |
6 |
|
|
Chaîne H |
Inf. à 300 |
~ 30 |
6 |
9 |
|
Chaîne légère :
( 300 x 5 ) (recombinaison VJ) x 4 (TdT :
incertitude de jonction) =
6 000
Chaîne légère :
( 300 x 30 ) (recombinaison VD) x 4 (TdT) x (4 x
4) (recombinaison
DJ) = 576 000
Þ 6 000
x 576 000 = 3 456 . 106 x 103 (mutation
somatique pour les régions hypervariables) = 3
456 . 109
-
ADN avant le réarrangement (cellule non
lymphocytaire) :

Promoteur
fort Séquence Enhancer
(trop lointaine du promoteur)
-
ADN après le réarrangement génique (lymphocyte
B) :

Séquence Enhancer
(suffisamment proche du promoteur pour
lactiver)
Exclusion
allélique (ou haploïdie fonctionnelle) :
Pour
devenir fonctionnels, les gènes des immunoglobulines ne vont pas réarranger
systématiquement les 2 allèles.
Chaîne lourde :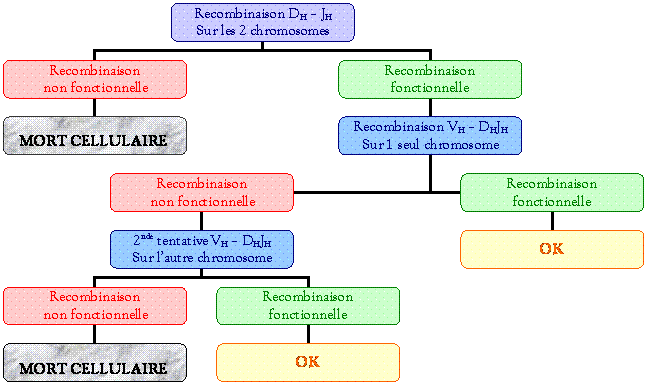

Chaîne légère :
Les
immunoglobulines de membrane :
La
chaîne lourde (6000 Da) présente une extrémité hydrophobe qui permet la
fixation à la membrane. Elle est facilitée par la présence de cystéines.
" Mécanisme
de capping avec les molécules du cytosquelette (dépendant de la
température)
= Endocytose
Toutes
les régions dune immunoglobuline peuvent se comporter comme un antigène.
-
Isotypie :
On va retrouver des épitotes (=
déterminant antigénique) de type isotypique au niveau des domaines C
(constants) et présents chez tous les individus à une même espèce. Les
anticorps de type isotypique vont être reconnus chez tous les anticorps des
individus dune même espèce.
-
Allotypie :
Les anticorps qui appartiennent à
cette famille correspondent à des anticorps qui ont des variations alléliques
au niveau des domaines C.
Le 1er exemple a été
décrit par Oudin : « Lallotypie est la propriété observée sur
certaines protéines animales de posséder, chez certains groupes dindividus
dune même espèce, des spécificités antigéniques transmises de façon
héréditaire.
-
Idiotypie :
Elle est portée par la région
variable de lanticorps. Chaque anticorps va pouvoir se comporter de façon
différente. Il ny a pas de règle.

Le
réarrangement des immunoglobulines est un processus ordonné et régulé.
« Ca passe
ou ça casse »
Il
y a peu délues, doù la présence de monocytes et macrophages pour éliminer la
casse.
NB :
Il existe une souspopulation de lymphocytes B qui
présente de marqueur de surface CD5. Les cellules CD5+ ne sont pas
capables de synthétiser beaucoup dimmunoglobulines. Celles synthétisées sont
de faible affinité, mais elles reconnaissent des antigènes un peu
particulier : autogènes (origine de pathologies autoimmunes) et les
antigènes de nature polysaccharidique.
Ces cellules CD5+ sont aussi
appelées cellules Tindépendantes, cestàdire indépendantes des cytokines
sécrétées par les lymphocytes T.
Leur
rôle est un peu flou (à cause des difficultés détude) Elles sont associées à
des tumeurs : LLC (= leucémie lymphocytaire chronique)
Dans lévolution, il ny a pas de changement des
structures, mais plutôt lajout de nouvelles structures venant compléter les
structures déjà existantes :
-
Le
malt (en premier),
-
Le
thymus,
-
La
moelle osseuse,
-
Les
organes lymphoïdes IIAIRES.
+ Le
réarrangement dun gène ancestral
Le gène V peut être rendu diverse par la présence de
pseudogène. Le pseudogène a la structure dun gène mais pas la fonction :
il nest pas exprimé.
Il permet une
modification de la structure, de séquence, donc une possible modification de la
région V et augmenter sa diversité.
-
Chez
la souris, les antigènes peuvent être polysaccharidiques.
-
Chez
les poissons, la cellule doit sadapter à des températures basses (par
exemple : la présence dacides gras dans la membrane des lymphocytes B)
-
Chez
le xénope, la différenciation des lymphocytes B sarrête pendant la
métamorphose puis reprend après.
La lignée T possède un récepteur
spécifique à un antigène, mais à besoin dune cellule présentatrice dantigène
(CPA)
Le système immun
développe un répertoire de lymphocytes T (grande diversité)
Le TCR est un récepteur de nature protéique
(peptidique) composé de 2 chaînes : une chaîne a et une chaîne b.
Une autre forme
existe avec une chaîne g et une chaîne d (plus chez le mouton ou le
poulet)
Lutilisation de détergents montre
lexistence des chaînes a et b, mais aussi de
5 autres chaînes polypeptidiques invariantes qui forment un complexe autour du
TCR proprement dit.
Il
sagit des 5 chaînes du CD3 (g, d, e, z et h) Les chaînes g, d
et e proviennent de 3 gènes
différents mais présentent une forte homologie de séquence : la répétition
du motif ARAM (ou ITAM)
Le motif ITAM est la séquence intracytoplasmique
YXXL (= TyrosinequelconquequelconqueLeucine) La séquence consensus est
YLYL.
Il permet
lactivation du lymphocyte T quand ce dernier reconnaît un antigène en
déclenchant la synthèse de cytokines.
Le CD4 :
-
Cest
une glycoprotéine avec 4 domaines cytoplasmiques présente chez les LT immatures
et les ’ des LT circulants (= matures)
-
Elle
est très spécifique des LT.
-
Son
domaine Nterminal contient des régions qui reconnaissent les molécules du CMH
de classe II.
-
Cest
aussi le site de fixation de
Le CD8 :
-
Cest
une glycoprotéine composée de 2 chaînes a et b (différentes des chaînes a et b citées
cidessus) organisées soit en aa, soit en
ab, soit enbb.
-
Elle
est présente sur € des LT.
-
Elle
a besoin du CMH de classe I.
-
Sa
région intracytoplasmique est riche en tyrosine, permettant la fixation de
kinase.
Les gènes codant
pour les chaînes a, b, g et d :
-
La
chaîne a : Sur le chr 14 q11
" Combinaison des gènes V, J et C
-
Va » 40
-
Ja » 50
-
Ca = 1
-
La
chaîne d : Sur le chr 14 q11
" Combinaison des gènes V, D, J et C
-
Vd = 8
-
Dd = 3
-
Jd = 4
-
Cd = 1
-
La
chaîne g : Sur le chr 7 q15
" Combinaison des gènes V, J et C
-
Vg = 8
-
Jg = 5
-
Cg = 1 (voire
2, maintenant)
-
La
chaîne b : Sur le chr 7 q35
" Combinaison des gènes V, D, J et C
-
Vb » 50
-
Db = 2
-
Jb = 14
-
Cb = 2
Þ 1015
TCR différents dans le répertoire théorique.
La
présence de 3 gènes permet une seule recombinaison, alors que la présente de 4
gènes permet 2 recombinaisons.
![]()
Les recombinaisons sont sous le contrôle :
-
Des
séquences heptanonamères (= SSR),
-
De
la recombinase,
-
Des
protéines RAG1 et RAG2,
-
De
+ La délétion ou linversion à la place de la
mutation somatique pour les LB.
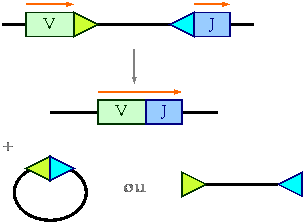 Délétion :
Délétion :
Gènes :
même orientation
Signaux de recombinaison :
orientation inversée
 Inversion :
Inversion :
Gènes :
orientation inversée
Signaux de recombinaison : même
orientation
Les lymphocytes ont des propriétés plutôt
hétérogènes :
-
Fonction
régulatrice :
Lymphocyte
T appelé TH (helper = auxiliaire) " CD4+
Lymphocyte
T appelé TS (suppresseur) " CD8+
-
Fonction à
médiation cellulaire :
Lymphocyte
T sécréteur de cytokines " CD4+
Lymphocyte T appelé TC
(cytotoxique) " CD8+
Mais
on parle surtout des lymphocytes TH et des
lymphocytes TC (en terme dutilité)
La
coopération entre les lymphocytes T et B se fait avec les lymphocytes TCD4.
La
proportion en lymphocytes T est de 60% TCD4 et 40% TCD8.
v Fonction des lymphocytes
CD4+ :
Les lymphocytes TH constituent la
population majeure des TCD4 et sont
subdivisés en 2 souspopulations TH1 et TH2.
En
général, les travaux sur les clones TH posent plus de
problèmes chez lhomme que chez la souris.
-
Les
TH1 sont sensibles aux antigènes de
grande taille et une forte irradiation des CPA.
-
Les
TH2 sont sensibles aux antigènes de
petite taille et une faible irradiation des CPA.
Linterleukine
3 (IL3) intervient dans lendogénie des lymphocytes B.
-
Hypersensibilité
de type I " Allergie (avec les IgE)
-
Hypersensibilité
de type II
-
Hypersensibilité
de type III
-
Hypersensibilité
de type IV " Hypersensibilité retardée (avec les LTH1)
Les
LTH2 ont un effet sur la lignée des
LB.
Les
LTHP = précurseurs ; lINFg = interféron g
-
Le
macrophage sécrète de linterleukine 12 pour activer le LTH1.
-
Le
macrophage sécrète de linterleukine 10 pour inhiber le LTH1.
A
connaître sur le bout des doigts
Mise en évidence
du rôle des LTH1 :
-
Injection
de toxoplasme (= parasite) dans lorganisme :
" Réponse non
spécifique

Le
parasite nest pas détruit, mais stabilisé dans le macrophage (absence de
réplication)
Si
on élimine linterféron g, la réplication
reprend.
Mise en évidence
du rôle des LTH2 :
-
Injection
dhelminthe (Nippostrongylus brasiliensis) :
" Cytotoxicité
cellulaire dépendante de lanticorps
= Cyotoxicité à médiation cellulaire

La
présence de LTH2 aide les
lymphocytes B à synthétiser des anticorps.
v Les cytokines (LTCD4) :
La
réponse immune nécessite des interactions cellulecellule, soit en direct, soit
par un message délivré par des médiateurs solubles (hormones et/ou
cytokines)
Les
cytokines (ou IL) sont sécrétées de façon transitoire (uniquement par des
cellules préalablement activées)
Les
hormones sont sécrétées de manière continue (influence uniquement par la
concentration)
Il
existe dautres cellules (extérieures au système hématopoïétique) qui
synthétisent des cytokines : les cellules de lendothélium vasculaire, les
fibroblastes, les entérocytes
Les cytokines nont quun seul moyen
dagir : par le biais dun récepteur. Il existe donc une régulation
subtile par une équation ligandrécepteur.
Elles peuvent
intervenir en cascade : induction des unes par les autres.
Elles peuvent être classées en 3 grands
groupes :
-
Les
cytokines impliquées dans lhématopoïèse : IL5, 7 et 3,
-
Les
cytokines impliquées dans limmunité spécifique :
-
Synthèse
de TH1 (immunité à médiation) : IL2
et INFg,
-
Synthèse
de TH2 (coopération avec les LB) :
IL4, 5, 6 et 10,
-
Les
cytokines impliquées dans la réaction antiinflammatoire : INFg, IL1 et toute la famille de TNF
(surtout les TNF a et b)
Ø Mécanisme
damplification de la réponse immune :
Les
cytokines sont des molécules médiateurs peptidiques (~ 15000 Da) qui
peuvent être glycosylées ou non. Mais cette glycosylation ne semble pas
nécessaire, notamment avec les cytokines recombinantes (= fabriquées dans des
bactéries) qui ne sont donc pas glycosylées et qui restent fonctionnelles.
Les cytokines peuvent aussi être
classées en :
-
Cytokines
à faible rayon daction,
-
Cytokines
à action à distance.
Les cytokines à
faible rayon daction :
-
Elles
sont capables dêtre synthétisées par un type de cellules voisines
= Situation
« paracrine »
-
Elles
sont capables dêtre synthétisées par le même type de cellules
= Situation
« autocrine »
-
Elles
sont capables dêtre synthétisées à longue distance
= Situation « exocrine »
j Activités pléiotropes :
Selon
le tissu cible, leffet est différent. Il ny a pas que le tissu
hématopoiétique, mais aussi le système nerveux, les cellules rénales, etc.)
Exemple :
TNF " Synthèse dIL1 " IL6 dans les fibrocytes " IL8 " Action sur les leucocytes
k Activités physiologiques :
Les
cytokines agissent à des concentrations faibles, même très faibles (de lordre
de la picomole, voire la nanomole)
On
peut augmenter la concentration en cytokines dun facteur de 1, 2, voire 3.log,
mais cela provoque une action différente. Les cytokines nont plus les mêmes
fonctions (peut être utilisé comme traitement)
Exemple :
Laugmentation
de lIL12 entraîne un trouble des fibres musculaires dans les muscles lisses,
notamment un problème cardiaque.
l Activités redondantes :
Les
cytokines ont une activité pouvant se compenser les unes aux autres.
Exemple :
Un
animal déficient en IL2 (qui permet la mise en place des LT et LB) ne meurt
pas et vit même normalement.
On observe la
présence de récepteurs à IL6 permettant de palier le manque en IL2.
Ø Nomenclature :
Les
cytokines sont aussi appelées interleukine (IL) mais leur nom ne permet pas de
prédire lactivité de telle ou telle cytokine.
Linterféron
g est une cytokine. Les
interférons a
et
b sont des antiviraux.
Il
y a souvent des cellules précurseurs (exemple : IL12) LIL12 est un
peptide hétérodimère. La chaîne de linterleukine précurseur est plus longue
que la forme mature.
On connaît les
gènes et leurs effets.
Les
cytokines ne fonctionnent que par lintermédiaire de leur récepteur. Ceuxci
sont très variables. Ils sont plutôt des dimères et il y a labsence de
spécificité complète. Il existe plusieurs catégories de récepteurs selon le
type cellulaire.
Exemple : Le récepteur à
IL2 = CD25

Il
y a un effetdose des cytokines :

Cytokine
(en fonction de la quantité)
Apoptose
(mort cellulaire)
Différenciation,
Prolifération Anergie
(Evolution
clonale)
v Cytotoxicité des LTCD8 :
Exemples :
-
Le
rejet de greffe ou une pathologie consiste en la destruction des cellules du
même organisme.
-
La
destruction dagents infectieux, virus, bactéries.
La
cytotoxicité est réduite à un type de cellules qui proviennent du HLA de classe
I. Elle seffectue en 3 phases : la reconnaissance, laction puis la
désintégration des cellules cibles.
-
La
reconnaissance a besoin de cations (Mg2+) et elle est
plutôt courte. Elle est aussi appelée le baiser
de la mort.
-
Laction
est sensible au Ca2+ et elle est
très rapide. On parle aussi de coup
mortel.
-
La
désintégration na besoin de rien, mais sa durée est variable.
Les
LT cytotoxiques peuvent tuer plusieurs cellules les unes après les autes.
La cytotoxicité
indirecte (ou lyse indirecte) :
Cest
la mise en place du programme de mort cellulaire (apoptose)
Elle
est qualifiée dindirecte car elle a besoin dune interaction
ligandrécepteur :
 TNFTNFr = FASFASl =
CD95CD95l
TNFTNFr = FASFASl =
CD95CD95l
Activation de protéines adaptrices
ILbConvertingEnzyme
(= ICE)
Apoptose
La cytotoxicité
directe (ou lyse directe) :
Il sagit plutôt dun phénomène de
nécrose. Il y a lexocytose de granules contenant des enzymes de différentes
catégories :
-
Des
sérineestérases : granzine A et granzine B.
Les gènes codant pour les
sérinesestérases sont sur le chr 14,
proches
des gènes codant pour le TCR et des autres Ig.
-
Des
perforines qui ont une forte homologie avec le complément (surtout la protéine
C9 du complément)

Quelques
exemples de cytotoxicité :
Cytotoxicité
dépendante à lanticorps (ADCC) :

Cela
marche aussi avec des lectines à la place des anticorps.

Lymphotoxicité
:
Rejet
de greffe dit aigu :
La
cellule cible est le greffon. Les cellules impliquées dans la destruction sont
les cellules NK. Elles ressemblent aux TL par la présence du CD34 et par leur
sensibilité à lIL15, mais en sont différentes par labsence de TCR (=
récepteur spécifique à lantigène)
Les
cellules NK sont impliquées dans la réponse immune exogène (contre les virus),
dans la réponse immune endogène (lyse directe des cellules tumorales) ou encore
dans la synthèse de certaines cytokines et la stimulation des LTH.
Elles
présentent dautres catégories de récepteurs que les récepteurs spécifiques à
lantigène. Certaines sont sensibles aux HLA de classe I, dautres non.
Les cellules NKT :
Elles
ont des propriétés communes entre les LTCD8 et les cellules
NK. Elles participent au rejet des cellules tumorales et sont associées aux
pathologies comme les maladies autoimmunes.
Indépendante du thymus Indépendance
au CMH Cytotoxicité* NK NKT Sous le contrôle (restriction) du CD1 + Sensibilité au IL4 Restriction par rapport aux HLA de classe I. LTCD8 * : responsable de la sécrétion dau moins un type de
cytokine : lINFg

Les
plus connus : HLA, H2
Il
se caractérise par des protéines de surfaces très différentes. Ce sont ces
molécules qui sont impliquées dans le rejet de greffe. Il a pour fonction
essentielle la présentation de lantigène aux lymphocytes T.
Le
CMH est présent chez tous les animaux. Il a été mis en évidence chez lhomme en
1958 par lutilisation danticorps. Le HLA (human
leucocytes antigens = CMH) sont présents sur tous les leucocytes.
Ce système
présente une grande diversité par polymorphisme.
D Polymorphisme ¹ Réarrangements
LADN est polymorphe, cestàdire quun
gène sexprime sous différentes formes alléliques.
Ce
système HLA est dit multigénique, multiallélique et codominant. Il existe 200
gènes qui peuvent appartenir au HLA (dont 49 avec une spécificité de
présentation de lantigène)

Un haplotype est un ensemble dallèles
transmis dun individu à un autre enfant. Cela peut être ac, ad, bc et bd.
" Cela permet une énorme diversité.
On
a constitué un patrimoine génétique pour le HLA et on peut coder 1013 protéines
différentes pour le HLA.
v Description
des gènes :
Ils occupent une vaste région de notre
génome : 2000 à 4000 kb (soit 1/1000 du génome total) Les gènes sont
situés dur le chromosome 6p (bras court)
Il existe 3
catégories de gènes :

Classe I : une cinquantaine de gènes
Classe II : une quinzaine de gènes
Ø Classe
I :
Les gènes se situent plutôt dans la région télomèrique.
Ils sont divisés en plusieurs sousclasses : A, B, C, etc.
De nombreux
gènes sont des pseudogènes. Ces gènes vont coder pour des protéines exprimées à
la surface de toutes les cellules nucléées. Ils vont coder pour une protéine
HLA classe I.
Cette protéine est composée de 2
chaînes :
-
Une
chaîne lourde polymorphe (a1, a2, a3) synthétisée
par un gène HLA classe I.
Elle
présente un domaine avec une forte homologie de séquences.
PM = 43 kDa.
-
Une
chaîne légère (b2_microglobuline)
synthétisée par un gène qui se situe sur le chromosome 15 (il nappartient aux
gènes du HLA)
Il
peut être relié ou non à la protéine de classe I.
Sa
structure est bien connue.
Il
y a la présence de 8 exons :

La
région transmembranaire est riche en acides aminés hydrophobes. Elle présente
des sites de fixation pour la tyrosine, permettant ainsi des interactions avec
des kinases et des molécules du cytosquelette.
Les séquences a1 et a2 sont les
régions les plus externes : elles présentent les plus forts taux de
polymorphisme pour présenter le peptide antigénique. Elles vont former une
cavité vide où le peptide peut venir se nicher (place maxi de 9 acides aminés)
Cest
une région de +/ forte affinité pour le peptide antigénique.
Ø Classe
II :
Il existe 2 types de gènes regroupés
sous une organisation particulière. Il y a une association des gènes de type D
(DP, DN, DM, DO, DQ, DR)
Ces
gènes vont coder pour une protéine HLA classe II qui est composée de 2 types de
chaînes :
-
Une
chaîne a
(33 kDa) composée de 2 sousunités a1 et dune
sousunité a2,
-
Une
chaîne b
(29 kDa) composée de 2 sousunités b1 et dune
sousunité b2.
 Les sousunités a1 et b1 sont souvent
les plus externes : elles fabriquent spécialement la cavité où le peptide
pourra se nicher pour être présenté aux LT4.
Les sousunités a1 et b1 sont souvent
les plus externes : elles fabriquent spécialement la cavité où le peptide
pourra se nicher pour être présenté aux LT4.
" Types
sérologiques
![]()
![]()
Les gènes de
type DR de classe II :
Il
existe plusieurs catégories de gènes qui codent la chaîne a. La chaîne b est toujours
codée par le même type de gènes.

Les
gènes TAP vont coder pour les protéines de transports (à fonction enzymatique)
Ø Classe
III :
Ce
sont des gènes situés dans la région HLA mais on ne sait pas à quoi ils
correspondent. Ils vont coder pour des protéines de compléments pour les TNF a et b, et pour lHsp
70.
v Distribution
des molécules HLA de classe I et de classe II :
Les HLA de
classe I :
Elles
sont situées à la surface de toutes les cellules nucléées de lorganisme. Elles
sont exprimées par les lymphocytes, les macrophage, hépatocytes, érythrocytes, SNC,
pancréas, glande salivaire, endothélium de la cornée, etc.
Les HLA de
classe II :
Leur distribution est plus
restreinte : elles sont présentes que sur certaines cellules qui ont pour
fonction de présenter lantigène (CPA)
Les CPA les plus
connues sont les cellules dendritiques, les macrophages, les lymphocytes B
activés, les entérocytes, les cellules épithéliales des voies respiratoires.
Les cellules dendritiques sont des cellules cutanées
présentant de longs prolongements. Ce sont des cellules qui ont un précurseur
médullaire qui présente le marqueur CD43.
Elles
appartiennent à un groupe hétérogène de cellules tissulaires qui participent à
la circulation lymphocytaire. Elles sont différenciées selon la zone où elles
se situent :
-
Les
cellules de Langerhans,
-
Les
cellules dendritiques du derme.
Les cellules de Langerhans sont décrites
en 1968. Elles sont plus faciles daccès : elles se trouvent au niveau des
cellules basales de lépiderme.
Elles présentent
un noyau polylobé et des granules (= granules de Birbeck) Elles expriment des
protéines HLA de classe II, des molécules dadhérence (intégrines), des
récepteurs aux cytokines et dautres marqueurs (CD1A)
Les cellules dendritiques expriment
aussi le marqueur CD1A. Elles se différencient par labsence de granules de
Birbeck.
Elles quittent
la peau pour migrer vers les organes lymphocytaires et stimuler les cellules T
naïves. Elles expriment à la surface des molécules dadhérence et sont des
précurseurs CD34.
Les
monocytes et macrophages peuvent apparemment évoluer en cellules dendritiques
v Présentation
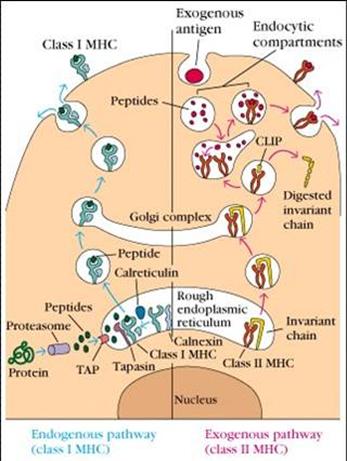
de lantigène par les protéines HLA de classe I :

j Présentation du
peptide antigénique par des enzymes protéolytiques (= protéosome) qui le
transforme en petits fragments
k Franchissement
de la membrane plasmique par un transport actif (hydrolyse dATP) Le peptide
est transporté par TAP1 et TAP2.
l Le peptide
antigénique va se nicher dans une petite activité créée par a1 et a2 (dans le RE)
m Entrée dans une
vésicule de golgi de la protéine HLA de classe I accompagnée du peptide
antigénique et de calnexine.
n Exocytose. Le
peptide est prêt à être reconnu par un lymphocyte TCD8+.
v Présentation
de lantigène par les protéines HLA de classe I :
j Endocytose et
formation dun endosome, permettant la coupure en petits fragments par les
protéases.
k Dans le RE,
mise en place dune chaîne invariante qui protège lensemble protéique.
l Dans lappareil
de Golgi, terminaison de la maturation.
m Fusion des
membranes qui permet la rencontre de la protéine HLA de classe II et du peptide
antigénique. La chaîne invariante est clivée et, en général, elle est ensuite
dégradée ou recyclée.
n Présentation au
lymphocyte TCD4+.
Le
système CD1 permet la présentation pour les molécules lipidiques aux
lymphocytes T. Il existe un locus CD1 où il y a 5 gènes (CD1A, CD1B, CD1C,
CD1D, CD1E)
Cest un système
multigénique, mais il nest pas polymorphe.
Le système est +/ bien définit chez
toutes les espèces de mammifères.
La
protéine CD1 (45 kDa) est composée dune chaîne lourde glycosylée, ellemême
composée de 3 sousunités (a1, a2, a3) Elle ressemble
aux HLA de classe I avec une molécule de b_2M qui peut
être associée de façon non covalente.
Il devrait y
avoir un gène ancestral qui sest adapté et a évolué en HLA de classe I et HLA
de classe II.

2 grands
groupes :
-
Groupe 1 : Les protéines
sont codées par les gènes CD1A, CD1B, CD1C. Elles sont localisées sur les
thymocytes immature. On les retrouve sur les cellules de Langerhans, les
monocytes et les lymphocytes activés.
-
Groupe 2 : Les protéines
sont codées par le gène CD1D. On les retrouve sur les lymphocytes T, les
cellules dendritiques mais surtout sur les hépatocytes et lépithélium
intestin.
La
cavité formée par les sousunités a1 et a2 est hydrophobe
et permet donc la fixation des molécules lipidiques.
Une sousunité population de LT va être
sensible par la présentation dantigène par les CD1. Il y a la formation
dautoantigène.
Le
CD1 peut avoir un rôle à jouer dans le mécanisme antiinfectieux et la fonction
antitumorale. Il a aussi un rôle dans des pathologies. Il permet de contrôler
un environnement tissulaire correct (homéostasie)
" Immunité classique et innée.
Ø Identification
des différents types sérologiques de HLA :
j Différenciation
de sérologie :
Le
HLA se comporte comme une protéine de surface entraînant une réaction de
lymphotoxicité car le complément peut venir se fixer sur le Fc, lIg et
provoquer la lyse de la cellule cible.
k Méthode biochimique
l Méthodes de biologie cellulaire :
Culture mixte lymphocytaire (CML) : 2
populations en culture pour définir :
-
Une
population stimulante " irradiation
pour les supprimer,
-
Une
population reperdant (cytokines, cytotoxicité)
" Compatibilité
m Méthodes de biologie moléculaire :
Utilisation de sondes de gènes HLA.
Technique : RFLPs, microsatellites.
" On trouve
différents types HLA (par exemple : lors dun rejet de greffe)
Les
HLA sont souvent associés à de nombreuses pathologies.
Exemple :
-
Le
HLA B27 est fortement associé à linflammation chronique des microsquelettes
(arthrite) Il existe une distribution de cette population qui augmente des
exemples qui présentent de larthrite.
-
Les
HLA de classe II sont associés à des pathologies autoimmunes comme la
myasthénie ou le diabète (plurifactoriel dont lenvironnement) de type I
insulinodépendant :
LHLA
de classe II : le gène DQ donne la séquence protéique, laspartate en
position 57 permet la résistance au diabète. Si cest un autre acide aminé, le
risque de développer le diabète de type I est plus important.
Le
destin dune greffe va dépendre des différentes de compatibilité entre donneur
et receveur.
v Greffes :
Ø Quelques
définitions :
-
Autogreffe : Le donneur est
le receveur.
-
Isogreffe : Cest une
greffe synergique. Le donneur et le receveur sont génétiquement identiques (=
vrais jumeaux)
-
Allogreffe : Le donneur et
le receveur sont différents mais appartiennent à la même espèce.
-
Xénogreffe : Le donneur et
le receveur appartiennent à 2 espèces différentes.
-
Greffe : Il sagit de
toute transportation de cellules ou tissus. Il ny a pas danastomose
vasculaire. Cest différent de la transplantation.
Le
mécanisme de rejet de greffe est une réponse immunitaire des lymphocytes du
receveur contre les antigènes du donneur.
Ø 3
catégories :
-
Rejet aiguë : Il est caractérisé
par le moment de lapparition du rejet (8 à 15 jours)
-
Rejet suraiguë : Il sagit de
rejets plus rapides (quelques heures à quelques minutes)
-
Rejet chronique
-
GVH (Graft Vernes Host) : Il sagit de la
réaction du greffon contre lautre. Le récepteur ne peut pas rejeter le
greffon.
Sil y a des
lymphocytes T dans le greffon, ceuxci peuvent réagir contre le receveur en
créant une réponse immune pathologique du greffon contre lautre.
-
Autogreffe : Il ny a pas de
rejet (exemple de la moelle osseuse)
-
Isogreffe : Il ny a pas de
rejet.
-
Allogreffe : Il peut y avoir
des rejets aigus. Les lymphocytes du receveur (surtout CD8+) sont
responsables de la réponse immune cytotoxique. Les cellules tueuses sont donc
activées.
Quand il y a un
nombre suffisant de LTCD8+, il faut
plusieurs jours pour la destruction du greffon.
-
Xénogreffe : Il peut y avoir
des rejets suraigus. Les anticorps préformés du receveur vont se fixer sur
lantigène du greffon. Une fixation complète entraîne la lyse du greffon.
Ø Les
lymphocytes :
Les
lymphocytes TCD4+ :
Ils
peuvent être éventuellement impliqués dans le rejet. Ils sont alloréactifs. Ils
sécrètent aussi du TNF, linterféron g et lIL6
entraînant un processus de destruction.
Les
lymphocytes TCD8+ :
Ils
entraînent la cytotoxicité directe ou indirecte, causant la lyse cellulaire du
greffon.
Les
lymphocytes B :
Des alloanticorps préexistants chez le
receveur entraînent lélimination directe par la fixation du complément sur les
cellules du greffon. Cela cause les rejets chroniques.
Il y a
laltération au niveau des vaisseaux.
Le rejet se fait en 2 phases :
-
La
sensibilisation,
-
La
migration des lymphocytes sensibilisés.
La
sensibilité consiste en la défense des cellules dendritiques qui présentent les
antigènes. La migration se fait du donneur vers le receveur.
Il
existe différents traitements utilisés en cas de rejet ou dexpérimentation.
Pour prévenir un rejet de greffe, on effectue une immunosuppression soit
spécifique, soit non spécifique.
Immunosuppression
spécifique :
On utilise des agents alkylants,
inhibiteurs du métabolisme des purines et pyrimidines (azathioprine et
méthotrexate) Ces médicaments sont associés à des corticoïdes.
-
Lazathioprine
limite le développement des LT et la prolifération des cellules tueuses de type
NK.
-
La
méthotrexate bloque la division cellulaire. Elle présente des effets
secondaires.
La
famille des cyclosporines (dorigine fongique) va agir exclusivement des
lymphocytes activés et surtout les LTCD4+. Il ny a pas
deffet toxique sur lhématopoïèse. Il y a moins deffets secondaires mais il y
a une toxicité au niveau des reins.
On
peut effectuer une irradiation (= immunosuppression) par lapplication de
rayons UV (sur les cellules de la peau, les cellules dendritiques et les
cellules de Langerhans), ou de rayons X et g (entraînant une
irradiation totale)
Limmunosuppression
est utilisée avant la greffe (de moelle osseuse, par exemple)
Immunosuppression
non spécifique :
Les cellules de Langerhans ont un rôle
important à jouer dans la présentation des antigènes du greffon. Les cellules
dendritiques sont traitées avec des anticorps anticellule dendritique, puis on
réinjecte ces cellules dendritiques.
Cela permet une
diminution de la probabilité de rejet de greffe.
Il
faut augmenter de tolérance des populations lymphocytaires par rapport aux
antigènes du greffon.
Le thymus a un rôle important dans ce
développement. Il peut être à lorigine de plusieurs pathologies comme le
syndrome de Di George.
Pendant la 1ère
année de la vie, le thymus involue mais reste fonctionnel. Il sagit dune
réduction quantitative mais pas qualitative.
Il
présent un rôle important dans la mise en place du TCR et des marqueurs CD.

Mais cest plus
compliqué
L
Les
cellules précurseurs arrivent par la médulla et migrent dans le cortex. Cest
une cellule dite « double négative », cestàdire CD4 et CD8 (DN)
Maintenant, on
peut parler de cellules triples négatives (TN) : CD4, CD8 et CD3.
Au niveau du cortex, la cellule DN
devient DP (CD4+ et CD8+) et doit
maintenant faire son choix entre le CD4 et le CD8. Il est rare
quun lymphocyte T mature reste DP.
Il
y a alors une sélection : seuls 5% des cellules arrivent à terme (soit 95%
de perte cellulaire)
Il y a lexistence
de cellules stromales qui synthétisent des facteurs de croissance.
Les cellules souches présentent initialement des
marqueurs (CD44, CMH de classe 1)
-
Le
passage du stade précurseur au stade mature nécessite lintervention de lIL2.
Il y a donc un pic dexpression du CD25 (= récepteur à IL2)
-
Le
CD44 disparaît un peu plus tôt.
-
Le
HLA de classe I, en stade cellule souche, disparaît au stade immature et
réapparaît au stade mature.
-
Le
CD5 apparaît un peu après le CD3.
|
Thymus cortex |
Cortex |
Médulla |
Périphérique |
||
|
LT
précoce |
PréT (précoce) |
PréT (tardif) |
TCR Double positif |
TCRab Simple positif Immature |
TCRab SP
mature |
|
CD44+ CD117+ (CKit) IL7R CD44+ |
( CD44+ ( CD44+ CD2+ |
PréTCR (=
b + début de mise
en place de a) |
CD44 CD25 CD8+ CD4+ |
CD8+/CD4 CD4+/CD8 |
|
|
|
VDJb =
1er arrangement (chaîne b
du TCR) |
Chaîne b Pré Ja (pTa) =
chaîne a en cours de mise
en place (il manque notamment la région
variable) =
glycoportéine invariable |
VJa (intervention
des gènes RAG) |
|
|
IL7 Dépendance CD3 Sélection
négative Sélection
négative
![]()
![]()
![]()
|
|
|
Stade
important dans le contrôle du passage au stade suivant = Sélection positive avec association de bpTa
qui permet ce passage |
Phases dépendante du CMH |
-
La
pTa
a un rôle antiapoptotique. Si elle sexprime, elle va contrôler lexclusion
allélique des chaînes b.
-
CD3
à un rôle dans la survie cellulaire.
 Rôle du CMH :
Rôle du CMH :
3
cas de figures :
Pas
daffinité
" Mort par
apoptose
‚
Faible
affinité
" Sélection
positive (survie et différenciation)
ƒ
Forte
affinité (pathologie autoimmune)
" Sélection
négative (mort cellulaire)
La
diversité des peptides du soi exerce une influence sur la sélection et la
différenciation des lymphocytes T.
Interaction TCR
peptide HLAcomplexe :
La région hypervariable du TCR (CDR1, CDR2 et CDR3) présente une
orientation transversale pour mieux reconnaître lantigène. CDR1 et CDR2 fonctionnent
ensemble.
Dans
les cellules précurseur, il existe un facteur notch, appartenant à une famille
de gènes, qui va coder pour un récepteur membranaire (Notch 1)
Cela entraîne la
régulation du choix des différentes cellules :
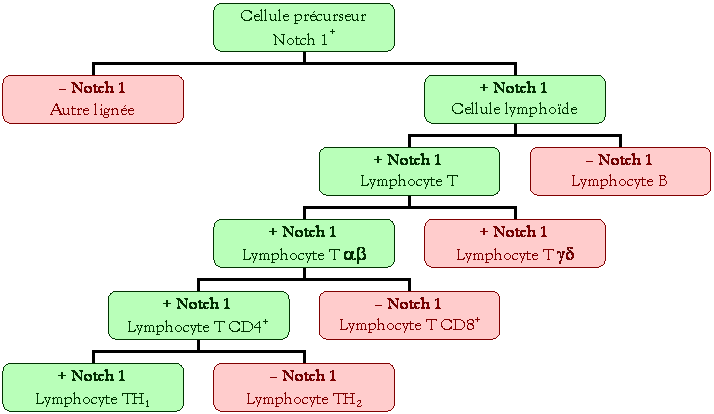
Dautres
gènes interviennent aussi dans la sélection (GATA, runX), ainsi que la
structure de la chromatine.
Il y a 2 concepts :
-
Il
y a la mise en place de récepteurs avec la constitution dun répertoire,
-
Lactivation
des lymphocytes nest pas directe après la rencontre entre un antigène et le
récepteur.
v Mécanismes effecteurs de la
réponse immune :
3
cas de figures :
-
La rencontre
entre un antigène et les lymphocytes B et T entraîne une réponse :
" Il y a survie
du lymphocyte qui permet lévolution clonale (= sélection clonale) qui entraîne
la prolifération et la différenciation cellulaire (2 ou 3 cycles de divisions
cellulaires)
-
La rencontre
entre un antigène et les lymphocytes B et T entraîne une anergie :
" Il y na pas de
réponse, mais il ny a pas de mort cellulaire.
-
La rencontre
entre un antigène et les lymphocytes B et T entraîne la mort par apoptose.
Les
2 derniers cas sont des sélections négatives permettant une tolérance
immunitaire (en particulier contre les éléments du soi)
Ø Répertoires :
-
Le
répertoire des lymphocytes B est varié car il doit reconnaître lantigène directement.
-
Le
répertoire des lymphocytes Tab est plus limité
que celui des lymphocytes B car il est aidé par le HLA.
-
Les
lymphocytes Tgd ont une
position intermédiaire entre les lymphocytes Tab.
Les
lymphocytes B ont des étapes de prolifération limitées ; les lymphocytes T
ont une prolifération plus forte (grâce à la synthèse de cytokines pouvant
activer les cycles cellulaires)
Létape
de reconnaissance est sensible à la concentration en antigène.
Il
y des interactions spécifiques entres les cellules de la réponse immune. Cette
spécificité est expliquée sur le plan génétique par le métamorphisme et le
réarrangement allélique avant et après la fixation de lantigène.
Ø 3
catégories de réponse immunes :
Elles
sont définies selon létape terminale de différenciation et de prolifération
clonale : soit la réponse est positive, soit elle est négative (apoptose
ou anergie)
v Activation lymphocytaire :
Elle
passe par la caractérisation des récepteurs et la transduction du signal. Ce
signal peut être traduit sous différentes modalités dont laction de la
réaction enzymatique (protéinases K) responsable détapes de phosphorylation
spécifiques.
Ø Récepteurs :
Il existe différents types de récepteurs :
-
Le
récepteur de type I = récepteur kinase,
-
Le
récepteur de type II = récepteur catalytique (couplé à une protéine G),
-
Le
récepteur de type III = récepteur couplé à une enzyme
(par
exemple la phospholipase C)
-
Le
récepteur de type IV = récepteur couplé à un canal
(pas en immonuologie)
La
phospholipase C catalyse la dégradation du PIP2 en IP3 et DAG. Le DAB
reste sur la membrane et stimule une protéine kinase (PK) LIP3 est impliqué
dans la stimulation de la modification de la concentration en Ca2+ intracellulaire
qui active des facteurs de transcription.
v Transduction du signal :
Le complexe TCRCD3 reconnaît lantigène (fixation
du TCR) Le CD3 présente un motif consensus : YXXL. La tyrosine (Y) est le
substrat dune protéine kinase.
La
fixation de lantigène a pour conséquence :
-
Une cascade
daction qui est une cascade de kinase (autophosphorylation)
La dernière
passe la membrane nucléaire et active des facteurs trans (déjà dans le noyau)
-
Une cascade des
MAPKinases :
La
phospholipase C fournit du DAG (= substrats de la protéine kinase C) et de lIP3 entraîne une
augmentation de la concentration interne en Ca2+ qui stimule la
calcineurine (stimulatrice dun facteur trans qui passe la membrane nucléaire.
Chez
les lymphocytes B, la fixation de lantigène sur lIgM (ou D) entraîne
lactivation de la protéine kinase C et la phospholipase C via les mêmes
daction au niveau de la membrane.
Les
lymphocytes T présentent des protéines adaptarices qui font la jonction entre
lenzyme et le substrat (GRB2, SOS, LAT, etc.)
Ø Spécificité
aux lymphocytes :
Il y a 2 grandes catégories de kinases :
-
Celles
fixées à la membrane : la famille SRC (= SARC) comme P59PLck, P59Fymn,
Yes, etc.
-
Celles
non fixées à la membrane (ne présentant pas de sites de fixation) : la
famille ZAP70 dans la lignée T, la famille SIC dans la lignée B.
Le CD45 :
Il
est exprimé autour dun récepteur T ou B. Il permet la réversibilité de la
réponse immunitaire grâce à son activité phosphotasique.
Il existe des molécules de surface CD (= molécules
de costimulation) qui vont renforcer la réponse immunitaire (prolifération,
synthèse dinterleukine)
Il
y a la reconnaissance spécifique de lantigène par TCRCD3 (1er
signal)
Ensuite, un
second signal est créé par des molécules de costimulation.
v Molécules de costimulation :
Ø Lymphocyte
B :
Un
2nd signal est nécessaire pour une réponse immune efficace. Il est
dû à la fixation de couples de molécules membranaires spécifiques entre le
lymphocyte T et
Les
lymphocytes présentent :
-
Des
CD28 (= lipoprotéines) dont le ligand est le CD80 ou le CD86 (encore appelés
B7.0, B7.1, B7.2)
Le CD28 est exprimé
sur 100% de la membrane des LTCD4+ et 50% de la
membrane des LTCD8+.
La
fixation entraîne une augmentation de la synthèse dinterleukine IL2
(favorisant la prolifération cellulaire)
-
Des
CTLA4 (forte homologie génique de séquence avec CD28) dont les ligands sont
les CD80 et CD86, avec une affinité plus grande pour CD86.
Il est exprimé
sur les LTCD4+ non natifs.
La
fixation entraîne un rôle important dans les mécanismes dallergie et de
tolérance immunitaire.
Il existe une régulation, notamment par
rétrocontrôle (via des protéines à activité phosphatasique)
Il existe un
travail sur lélimination des cellules tumorales en renforçant le signal.
Ø Coopération
TB :
Il
y a la liaison de CD40 et CD40L.
-
CD40 :
molécule de surface qui appartient à la famille du TNF. Elle est exprimée
essentiellement à la surface des CPA et lymphocytes B. Les lymphocytes B
activés peuvent jouer le rôle de CPA.
Elle
a un rôle dans la synthèse dIL4 (= cytokine dans la commutation de place des
Ig ou switch)
-
CD40L :
molécule appartenant à la famille des TNF. Elle est exprimée surtout à la
surface. Lors de lactivation de LT CD4+, il y a la
synthèse de CD40L par la fixation de
Sil
y a un blocage de linteraction CD40CD40L, il y a une absence de réponse
positive (apoptose ou anergie)
v Voie de signalisation
JAKSTAT :
La
coopération BT correspond à la mise en place dun 1er signal, dun
2ème signal et à la synthèse de cytokine.
Le
système JAKSTAT (Janus Kinase Signal Transducer and Activator of
Transcription) est beaucoup plus rapide et plus simple de la voie MAP Kinase.
-
La
famille de kinase de type JAK (JAK1, 2, 3 et Tyk2) possède 2 domaines kinases,
mais aucun domaine SH2 ou CH3.
-
Les
protéines de type STAT (STAT1, 2, 3, 4, 5A, 5B et 6) possède un domaine SH2 (= site de
tyrosine kinase) et un domaine de liaison à lADN.
Les STAT sont cytoplasmiques. Les protéines JAK sont
associées de manière constitutive au récepteur (ex. : récepteur à INFg) et provoquent une
autophosphorylation du récepteur, entraînant la fixation de 2 STAT. Cela permet
dimérisation des 2 STAT, via leur phosphorylation. Le dimère active la
transcription.
Il existe un
rétrocontrôle par des molécules fixant les STAT.
Lavantage
est sa rapidité (absence de cascade et molécules adaptatives) Lobservation de
cette voie a été possible par la mise en place de modèles animaux déficients.
Il renforce la réponse immune et dépend des
immunoglobulines. Il participe à lélimination par phagocytose. Il est composé
dun ensemble de protéines que lon peut retrouver sous 2 formes (forme soluble
5% et forme membranaire 95%)
Il
complémente la réponse immune (réponse AgAc) par la mise en place de réactions
en cascade. Il a un rôle dans le processus inflammatoire, en augmentant la
perméabilité vasculaire par chimiotactisme. Il a aussi un rôle dans le
processus dans la phagocytose en stimulant le mécanisme dopsonisation.
Il est capable
de lyser les cellules cibles par le biais de réactions phagocytaires. Il est utilisé
à la neutralisation certains virus. Il participe à lélimination du complexe
immun (complexe AgAc)
v Nomenclature :
Il
y a 11 composants : C1q, C1r, C1s, C2, C3, C4, C5, C6, C7, C8 et C9. Leur
ordre daction est :
-
C1q,
C1r et C1s,
-
C4
et C2,
-
C3,
-
C5,
C6, C7, C8 et C9.
Ce
sont des composants à propriétés proenzymatiques : propriétés
enzymatiques mais il y a la nécessité dun clivage protéolytique pour être
activé)
![]()
Lorsquun de ses composants est activé, il est
noté : C1q
Il est activé par clivage (obtention de 2
fragments) :
-
C3 " C3a (grand fragment) et C3b (petit fragment)
-
A
lexception de C2 : C2 " C2a (petit fragment) et C2b (grand fragment)
Il
est inactivé par mécanisme de rétrocontrôle, il est noté : C1ai
v Voies dactivation du complément :
Il
existe plusieurs voies dont 2 voies essentielles :
-
La voie
classique du complément,
-
La voie alterne
du complément,
-
La
voie des lectines.
Ø Voie
classique :
Elle est activée par la formation du complexe AgAc
ou la fixation dun anticorps sur une cellule pathogène. Cela concerne les
anticorps de nature IgM pentamérique, mais aussi de nombreuses IgG (3, 4 et 5)
Cette voie est
dépendante dune réponse spécifique. In
vivo, la stimulation de cette voie se fait par lintroduction de virus
oncogénique, certaines bactéries et de lADN de synthèse.
Elle nécessite lintervention des 11 composants qui
réagissent en cascade :
-
Unité
de reconnaissance : C1qC1rC1s
-
Unité
daction : C4C2 ; C3
-
Unité
dattaque membranaire : C5C6C7C8C9
§ Unité de reconnaissance :
-
C1q
est « lunité de tulipe ». Elle a une structure tubulaire et une
autre fibrillaire (~ fleur et tige) Sa structure
tubulaire interagit avec le domaine constant C4 des IgM (3 domaines C) ou
éventuellement avec le domaine C2 des IgG (3 domaines C)
-
![]()
![]() C1r et C1s se
fixent sur la région fibrillaire de C1q :
C1r et C1s se
fixent sur la région fibrillaire de C1q :
C1q " C1qC1rC1s (complexe)
Ca2+
§ Unité daction :
-
C1q
possède une fonction enzymatique de clivage sur C4 " C4a et C4b.
-
![]() C4b se fixe à la
membrane par liaison covalente thiolester.
C4b se fixe à la
membrane par liaison covalente thiolester.
C4b + C2 " C4bC2 " C4bC2a = C3 convertase
![]()
![]() Mg2+ C1s
Mg2+ C1s
C4bC2a : C3 " C3a + C3b
-
![]() C3b se fixe à la
membrane au niveau de C4bC2a.
C3b se fixe à la
membrane au niveau de C4bC2a.
C4bC2aC3b =
C5 convertase
§ Unité dattaque :
![]()
C4bC2aC3b : C5 " C5a + C5b
-
-
Il
en est de même pour C7.
-
C8
et C9 se fixe au complexe par des mécanismes encore inconnus. Ils forment un
pore.
-
Le
complexe formé entraîne la lyse de la cellule cible et permet linteraction
avec les cellules phagocytaires.
Ø Voie
alterne :
Elle est activée par le complexe AgAc mais plutôt
avec la fixation dIgA avec très souvent avec certaines bactéries qui possèdent
sur leur membrane certains polysaccharides. Elle se met en place plus
rapidement que la voie classique.
![]()
![]()
![]()
![]() Il ny a pas
lintervention C1 et C2. Cette voie commence avec une déviation de C3 de la
voie classique :
Il ny a pas
lintervention C1 et C2. Cette voie commence avec une déviation de C3 de la
voie classique :
C3b + B " C3bB " C3bBb " C3bBbP
" (C3b)nBb
![]()
![]()
![]() D + Mg2+ P Amplification
D + Mg2+ P Amplification
Rôle
de
Ø Régulation
de la voie classique :
Sur
Il
existe des intercalants entre C1q, C1r et C1s. Ce sont des protéines qui
peuvent se fixer ou non à la membrane. Il y a CD35 entre autres.
Sur
Cest
la plaque tournante. Cest un système labile (peu stable) qui sautoinactive
directement. Il y a aussi des inhibiteurs de C3b et C4b.
Sur la cellule
cible :
Elle
met en place des défenses par rapport au complément grâce à des molécules de
liaison entre C4 et C2, comme DAF (= CD55) et CD59.
Ø Régulation
de la voie alterne :
Il y a une régulation sur C3b :
-
Le
facteur H se lie à C3b et linactive,
-
Le
facteur I clive C3b.
Il
y a aussi lintervention de protéines membranaires du type DAF.
v Les récepteurs du
complément :
Ils sont surtout présents à la surface des
phagocytes et des globules rouges (très sensibles au complément)
En
général, il y a 5 catégories de récepteurs : CR1, 2, 3, 4 et 5 (dont les
mieux connus sont CR1, 2 et 3) :
-
CR1
est un récepteur qui a une spécificité pour C2b et C4 et intervient dans loposonisation.
-
CR2
et CR3 ressemblent à un récepteur de molécules dadhésion,
Il
existe aussi un récepteur de type araphylatoxine qui permet le rapprochement
physique des macrophages par fixation de lanticorps.
Le dérèglement peut se faire sur :
-
Le
réarrangement des lymphocytes B,
-
Le
réarrangement des lymphocytes T (TCR),
-
Le
CMH via sa diversité par un mécanisme moléculaire (= polymorphisme de
lADN),
-
La
reconnaissance de lantigène (1er et 2ème signal),
-
Spécificité
de reconnaissance.
Le
dérèglement peut être soit un déficit, soit une hypersensibilité.
v Déficit :
Ø Déficit
primaire :
Il
sagit dun déficit présent dès la naissance.
|
Cellules |
Réponse immunitaire |
Infections |
Traitements |
|
|
Tumorale |
Cellulaire |
|||
|
Cellules
souches |
(( |
(( |
Toutes
cidessous |
Greffe de
moelle épinière |
|
Lymphocytes B |
(( |
Normale |
Bactéries
pyogènes, Pneumocycks corini |
gglobulines |
|
Lymphocytes B |
( |
(( |
Certains virus
candidats |
Greffe de
thymus |
|
Complément |
Normale |
Normale |
Bactéries
pyogènes |
Antibiotiques |
|
Cellules
phagocytaires |
Normale |
Normale |
Bactéries
pyogènes |
Antibiotiques |
La
déficience génique en un récepteur à une cytokine a été le sujet de la 1ère
thérapie génique considérée comme positive.
Ø Déficit
secondaire :
Cest
le cas du SIDA ou un déficit dû à une malnutrition.
v Hypersensibilité :
Il
existe différentes hypersensibilités : 3 dépendantes danticorps (I, II,
III) et 1 retardée (IV)
Ø Hypersensibilité
dépendante danticorps :
Elle
a besoin dimmunoglobulines fixé à lanticorps de la cellule cible.
Hypersensibilité
de type I :
Ce
sont les IgE qui y interviennent.

Hypersensibilité
de type II et III :
Elle
est responsable des pathologies dues à des accidents de transfusion sanguines
et lhémolyse du nouveau né (dû au facteur rhésus)
Ce
sont les IgM qui y interviennent (et éventuellement les IgG) La liaison AgAc
provoque des trous dans la membrane de la cellule cible. Cela fait augmenter le
processus dinflammation.
Il
arrive que le complexe AgAc circule dans le sang et se fixe sur une cellule de
lorganisme.
Hypersensibilité
de type IV :
Elle est dite retardée car elle se met en place en 1
à 3 jours du fait de limplication des lymphocytes T. Il y a besoin dune
présentation de lantigène par les CPA (cellules phagocytaires et macrophages)
Le problème est
lincapacité délimination de lantigène par le macrophage qui devient un
mégacaryote.
v Pathologies au niveau de la
lymphoprolifération et de lautoinnumité :
Ø Lymphoprolifération :
Les
pathologies consistent en une erreur dans la maturation dans une cellule qui
évolue de manière clonale. On y trouve les leucémies.
Ø Maladies
autoimmunes :
Elles
consistent en un problème de tolérance du soi dans la maturation. Il y a un
rôle des 1er, 2ème signaux et du polymorphisme du CMH
(facteurs dassociation)