
Retour au sommaire des cours |

Une version pdf est à votre disposition ici. |
Les voies métaboliques
ont comme finalité d’assurer qualitativement et quantitativement les besoins
indispensables à la vie de l’organisme.
Ces besoins sont de 4
ordres :
-
Ils
permettent l’élaboration ou le renouvellement des structures micro ou
macroscopiques.
-
Ils
participent au … des grands équilibres qu’ils soient de l’ordre osmotique,
ionique, etc.
-
Ils
sont nécessaires au bon fonctionnement de toutes grandes fonctions de
l’organisme.
-
D’une
façon plus générale, ils sont nécessaires à la couverture des besoins
énergétiques.
" La couverture des besoins énergétiques
provient du catabolisme des 3 principaux nutriments : glucides, protides,
lipides.
En conditions
physiologiques normales :
-
Les
glucides couvrent 50 à 55 % des besoins.
-
Les
lipides couvrent 25 à 30 % des besoins.
-
Les
protides couvrent 12 à 15 % des besoins.
j
Ces 3 nutriments et
leurs utilisations ne sont pas cloisonnés : les voies métaboliques
interagissent entre elles, sous la dépendance de régulateurs hormonaux
eux–mêmes dépendants de facteurs internes (état de nutrition, période de la
journée, etc.) et de facteurs externes (stress, température, activité physique)
k
Cette régulation
intégrée est hiérarchisée, dans l’organisme, avec des niveaux grossiers jusqu’à
des niveaux plus fins.
" Notion de compartiments tissulaires et
cellulaires.
Schéma général : 5 compartiments (souvent les organes) Les régulations y seront
différentes et plus ou moins fines.
Les 5
compartiments :
j L’intestin : Entrée des nutriments (apport exogène par l’alimentation de lipides, protéines et
glucides)
k Le tissus
adipeux : Mise en réserve de
l’énergie (besoins 24H/24)
l Le foie : Il fournit les lipides en fonction des
niveaux de régulation fine (apport endogène)
m Le tissu
extrahépatique : Consommateur d’énergie (comme le tissu
musculaire)
n Le sang : Il assure les échanges entre les différents
organes.
v Au niveau de l’intestin :
Les
macromolécules sont dégradées puis absorbées.
Les
lipides alimentaires sont pour plus de 90% des
triglycérides. Les glucides sont surtout des polyosides
(glycogène, amidon), mais également des diholosides
(saccharose, lactose)
L’absorption
des molécules simples (oses, acides aminés) se fait par la veine porte.
Les macromolécules
lipidiques seront absorbées sous forme de chylomicrons.
Les lipides alimentaires tels les triglycérides sont à 75% captés et dégradés
par le tissu adipeux.
Les 25%
restants vont dans le foie pour donner du glycérol et des acides gras libres
par
v Au niveau du foie :
Les triglycérides formés
ne seront pas stockés (transformés en acides gras libres)
Les acides gras libres :
-
Ils
donnent de l’énergie par la b–oxydation avec libération de CO2.
-
Ils
permettent la formation de corps cétoniques,
-
Ils
permettent la synthèse de cholestérol pour la formation des sels biliaires.
-
Le
cholestérol peut s’associer aux triglycérides pour former les VLDL qui vont se
diriger vers le tissu extrahépatique.
v Au niveau du tissu
extrahépatique :
-
Les
muscles tirent 60% de leur énergie à partir de lipides.
-
Les
VLDL transportent des triglycérides du foie vers le tissu extrahépatique.
-
Les
LDL (issues des VLDL) apportent le cholestérol.
-
Les
triglycérides sont donneurs de CO2 via la b–oxydation.
v Les lipoprotéines :
Ce sont
des systèmes de transport des lipides sériques.
Les graisses de
l’alimentation, les lipides synthétisés par le foie et les lipides synthétisés
par le tissu adipeux doivent être véhiculés entre les différents tissus et
organes pour leur utilisation ou stockage.
Mais les lipides sont
insolubles dans l’eau.
Comment les transporter
dans le plasma sanguin (environnement aqueux) ?
Þ Via les lipoprotéines.
Elles sont constituées
de lipides non polaires (triglycérides,
cholestérol estérifié), de lipides polaires (phospholipides,
cholestérol libre) et de protéines
(apolipoprotéines ou apoprotéines)
6 classes de lipoprotéines :
-
Les
chylomicrons,
-
Les VLDL (Very Low Density Lipoprotéine),
-
Les
IDL (Intermediate Density Lipoprotéine),
-
Les LDL (Low Density Lipoprotéine),
-
Les
HDL (High Density Lipoprotéine) et
-
La
lipase (a)
" Toutes les lipoprotéines ont la même
structure de base : structure sphérique constituée de 2 parties :
-
La surface (ou écorce) = lipides polaires hydrophiles (phospholipides,
cholestérol libre) et apoprotéines (différents selon la lipoprotéine),
-
Le noyau
= lipides apolaires hydrophobes (triglycérides, cholestérol estérifié)
Cette structure permet
de stabiliser le globule lipidique et de former les liaisons
hydrogène avec le milieu aqueux (sang)

Plus les lipoprotéine
sont riches en lipides (par rapport aux protéines), moins la molécule est dense
(= plus légère)
Il existe une structure
commune à toutes les lipoprotéines, cependant elles diffèrent selon leur taille, leur proportion
relative entre les lipides et les protéines (rapport de densité), leur composition en apoprotéines et leur rôle.
Les
grosses particules ne diffusent pas entre les cellules endothéliales. Elles
doivent passer dans la lymphe pour ensuite rejoindre la circulation sanguine.
La taille influence la
voie de dégradation.

v Les apoprotéines :
Il existe 4 apoprotéines
principales : A, B, C et E. Chaque apoprotéine présente des isoformes.

|
Apoprotéine |
Lipoprotéines |
Commentaire
et fonctions |
|
Apo AI |
HDL, Chylomicron |
= Facteur d’activation
de l’enzyme LCAT (Lecithine cholestérol acyltransférase) = Ligand des
récepteurs aux HDL |
|
Apo AII |
HDL, Chylomicron |
= 2 chaînes polypeptides
reliés par des ponts disultfures. Action ? |
|
Apo B100 |
LDL, HDL, IDL |
= Ligand du récepteur
aux LDL |
|
Apo B48 |
Chylomicron |
= Facteur de sélection
des chylomicrons par l’intestin |
|
Apo CI |
VLDL, HDL, Chylomicron |
? |
|
Apo CII |
VLDL, HDL, Chylomicron |
= Facteur activateur
de la lipoprotéine lipase |
|
Apo CIII |
VLDL, HDL, Chylomicron |
= Inhibiteur de l’Apo CII
sur la lipoprotéine lipase |
|
Apo E |
VLDL, HDL, Chylomicron |
= Ligand du récepteur
aux LDL, permettant la dégradation des chylomicrons dans le foie |
v Rôle des lipoprotéines :
-
Les chylomicrons sont essentiellement
composés de triglycérides et assurent leur transport de l’intestin vers le foie
et le tissu adipeux.
-
Les VLDL assurent le transport
des triglycérides du foie vers le tissu extrahépatique.
-
Les LDL sont composées de
cholestérol et assurent son transport du foie vers le tissu extrahépatique.
Si les LDL s’accumulent au niveau du sang, cela provoque des
maladies cardiovasculaires
= « mauvais
cholestérol »
-
Les HDL assurent le transport
du cholestérol du tissu extrahépatique vers le foie.
Les HDL épurent les tissus extrahépatiques en cholestérol
qui est ramené au niveau du foie et transformé en sels
biliares.
= « bon
cholestérol »
v Composition des
lipoprotéines :
Proportions des lipides :
|
En % |
Noyau |
Ecorce |
Lipides totaux |
Protéines |
||
|
TG |
CsE |
PL |
CsL |
|||
|
Chylomicron |
58 |
3 |
8 |
1 |
98 |
2 |
|
VLDL |
56 |
15 |
20 |
8 |
90 |
10 |
|
LDL |
13 |
48 |
28 |
10 |
79 |
21 |
|
HDL |
13 |
29 |
46 |
6 |
43 |
57 |
Composition en apoprotéines :
|
Chylomicron |
VLDL |
LDL |
HDL |
|
Apo E, Apo B48, Apo C (CI, CII, CIII), Apo A (AI, AII) |
Apo E, Apo B100, Apo C (CI, CII, CIII) |
Apo B100, Apo E, Apo C |
Apo A (AI, AII) Apo E, Apo C |
v Les chylomicrons :
Ø Absorption
des lipides :

·
Les
lipides du chyme sont hydrolysés dans le duodénum par les enzymes
pancréatiques : lipase, phospholipase, cholestérol estérase. L'hydrolyse
des lipides nécessite une émulsification en gouttelettes grâce aux sels
biliaires. Les sels biliaires sont indispensables à l'action de la lipase
pancréatique ainsi qu'un cofacteur protéique, la colipase.
·
Les
produits de la digestion des lipides sont des monoglycérides, des acides gras,
du cholestérol et des lysophospholipides. Ces nutriments sont associés aux sels
biliaires sous forme de micelles qui permettent leur absorption par la bordure
« en brosse » des entérocytes (= cellules intestinales)
·
Dans
les entérocytes, les lipides sont à nouveau synthétisés à partir du
glycérophosphate pour les phospholipides (voie de KENNEDY) et à partir des
monoglycérides pour les triglycérides (voie de CLARK et HUBSCHER). Le
cholestérol est en partie estérifié dans les entérocytes et en partie réexcrété
vers la lumière intestinale.
Ø Synthèse
des chylomicrons :
Par
définition, les chylomicrons sont présents dans le chyle des vaisseaux chylifères qui drainent l’intestin. Ils
effectuent le transport des lipides alimentaires de l’intestin vers les tissus.
Ils sont
synthétisés par les cellules intestinales (= entérocytes)
à partir de triglycérides, cholestérol, Apo A et Apo B48.
-
L’Apo B48 est synthétisé par les ribosomes du RER (à partir du gène de l’Apo B100 et une
modification post–transcriptionnelle) Elle est incorporée dans les
lipoporotéines du REL (= également site de synthèse
des triglycérides)
-
Les
MTP (microsomial_TG Transfert Protein)
catalysent la formation des lipides conduisant au canal thoracique.
Les lipoprotéines transitent dans le golgi, où elles ont l’addition de lipides
(cholestérol) et de sucres.
-
Les
chylomicrons sont libérés dans les espaces entre les entérocytes par fusion de
vésicules de sécrétion avec la membrane plasmique. Ils entrent ainsi dans le
système lymphatique et le canal thoracique. Ils rejoignent ensuite la veine sous clavière gauche.
Remarque : Les
chylomicrons sont des particules de grande taille. Ils ne peuvent pas traverser
les cellules endothéliales. Les graisses alimentaires transitent par le système
lymphatique et non par le système porte hépatique.
Ø Maturation
des chylomicrons :
 La maturation des
chylomicrons porte sur le réarrangement du contenu en
apoprotéines. Les Apo C (CI, CII) et les Apo E sont incorporées à partir
des HDL, une fois que les chylomicrons ont
rejoint la circulation.
La maturation des
chylomicrons porte sur le réarrangement du contenu en
apoprotéines. Les Apo C (CI, CII) et les Apo E sont incorporées à partir
des HDL, une fois que les chylomicrons ont
rejoint la circulation.
Chylomicron natif Chylomicron
mature
HDL2 HDL3
Ces
échanges d’apoprotéines sont essentiels pour que les chylomicrons soient
fonctionnels et puissent entrer dans le mécanisme de dégradation.
L’Apo B est essentiel à la formation des
chylomicrons. Pathologie :
abêtalipoprotéinémie (maladie rare) où l’Apo B ne peut fonctionner. Il y a la
formation de gouttelettes lipidiques qui s’accumulent dans l’intestin et le
foie. Elle est due à un défaut de
Ø Dégradation
des chylomicrons :
Le tissu
adipeux est l’organe de dégradation des chylomicrons (75%) La clairance des chylomicrons circulants est élevée. La
demi–vie est de l’ordre de quelques minutes chez les petits animaux (comme le
rat), elle est supérieure à une heure chez les hommes.
La
dégradation des chylomicrons se fait sur la face intraluminale des veines
(dégradation des triglycérides via la lipoprotéine
lipase)
v La lipoprotéine lipase (LpL) :
Elle est logée dans la paroi des capillaires.
Elle est activée par l’Apo CII et inhibée par l’Apo CIII.

Au niveau du tissu adipeux : Il existe l’utilisation d’un équipement
enzymatique et une spécificité de la forme du chylomicron pour pouvoir
« l’accueillir » et la dégrader (invagination
au niveau des cellules épithéliales)
 Au niveau de ces invagination
membranaires : Il existe des
récepteurs aux Apo E, aux LpL et aux Apo C.
Au niveau de ces invagination
membranaires : Il existe des
récepteurs aux Apo E, aux LpL et aux Apo C.
L’hydrolyse
des triglycérides
entraîne la déplétion du volume central et donc déformation du chylomicron, qui
va ensuite se détacher de par la libération de l’Apo E.
La
formation de replis de la couche périphérique entraîne un accolement et la
formation d’un disque constitué de phospholipides, cholestérol et
d’apoprotéines (C et A principalement)
Þ HDL naissantes
discoïdales (= pré–b_HDL)
D’autres édifices
enrichis en Apo B48 et Apo E se reforment autour des molécules de cholestérol
estérifié et des triglycérides restants.
Þ « Remnants »
de chylomicrons (= résidu au diamètre réduit : 500 Å) Ils sont ensuite
dégradés par le foie via des récepteurs aux Apo E.

Bilan : 75% des chylomicrons sont dégradés par le tissu adipeux.
25% des chylomicrons sont dégradés par le foie.
Ø Régulation
de la dégradation des chylomicrons :
Normalement, l’épuration
des chylomicrons dure environ 4–6 H. Mais il existe des altérations des
mécanismes de dégradation qui entraînent une hyperchylomicronémie
de type I. Elle consiste en l’augmentation de la concentration
plasmatique en triglycérides jusqu’à 60 g/L, au lieu de 0,5 à 1 g/L.
2 origines :
-
Un
problème de synthèse de
-
Un
problème de synthèse des Apo C (CII activateur et CIII inhibiteur)
Si la quantité d’Apo
CIII est largement supérieure à celle de l’Apo CII (origine génétique)
v Les VLDL :
Ø Synthèse
des VLDL dans les cellules hépatiques :
Elle est comparable à
celle des chylomicrons.
j Synthèse de l’Apo B100 dans le RER.
k
Incorporation
dans les lipoprotéines dans le REL où se fait la synthèse des triglycérides.
 Cette réaction est
catalysée par
Cette réaction est
catalysée par
l Les lipoprotéines transitent dans le Golgi.
m Les VLDL sont libérés après avoir formé des
vésicules de sécurité.
n Elles traversent les fenêtres du revêtement
endothélial pour rejoindre les capillaires sinusoïdes du foie.
L’activation des VLDL se
fera au niveau du sang.
Ø Maturation
des VLDL :
 Elle porte sur des
échanges d’apoprotéines avec les HDL.
Elle porte sur des
échanges d’apoprotéines avec les HDL.
VLDL
natif VLDL mature
HDL2 HDL3
Durant le passage dans
la circulation, les VLDL vont échanger également des lipides avec les HDL sous
l’action d’une protéine de transfert :

HDL VLDL
Mécanisme similaire pour les chylomicrons.
Il existe
une autre protéine de transport :
Ø Catabolisme
des VLDL :
Dans la
circulation, les VLDL sont soumises à l’action de
Les VLDL sont les
précurseurs des IDL, qui forment ensuite les LDL.
Il existe 2 destinations possibles pour les IDL :
-
Elles
sont captées par le foie via les récepteurs aux Apo B/E,
-
Ou
elles sont transformées en LDL via la lipase hépatique.

Ø Régulation
de la dégradation des VLDL :
Le temps de résidence
des VLDL est 15 minutes. La régulation de leur dégradation dépend de la concentration intracellulaire en acides gras libres du foie.
Cette concentration a 3 modulateurs :
-
L’intensité
de la lipolyse du tissu adipeux,
-
La
synthèse endogène à partir de glucides,
-
La
consommation d’alcool
(Dégradation
au niveau du foie Þ &AGL Þ &TG Þ &VLDL)
Les
problèmes de dégradation sont liés à
Ils entraînent une hausse du taux de VLDL :
hypertriglycéridémie de type IV
(triglycérides :3 à 7 g/L)
Les chylomicrons, les
VLDL (et une grande partie des IDL) sont des lipides très riches en
triglycérides et ne sont retrouvées qu’en période post–prandiale (= relatif au repas)
Les autres lipoprotéines
(LDL et HDL) sont riches en cholestérol et seront retrouvées à jeun.
v Les LDL :
Rôle : Ils transportent le cholestérol vers les tissus
extrahépatique :
Apo B100 –
récepteur à Apo B/E
Ø Synthèse
et maturation :
Les LDL sont
essentiellement synthétisées au niveau sérique à partir du catabolisme des
VLDL.
![]()
![]() VLDL
IDL LDL
VLDL
IDL LDL
LpL capillaire LCAT
-
Hydrolyse
des triglycérides,
-
Perte
des phospholipides et une partie du cholestérol libre (le reste est estérifié
par
-
Perte
de l’Apo C.
Elle porte sur des
échanges d’apoprotéines avec les HDL.

IDL LDL
Lécithine Lysolécithine

Ø Apport du
cholestérol :
Chez
l’homme, la majorité du cholestérol de l’organisme est produit par synthèse (~ 700 mg/jour) Le reste
est fournit par l’alimentation. Le foie synthétise ~10% du cholestérol total
et l’intestin ~10%.
Cette
synthèse se fait surtout dans la fraction microsomiale (RE) et cytosolique de
la cellule.
Les
cellules qui ont besoin de cholestérol pour leur métabolisme expriment à leur
surface un récepteur capable de reconnaître les lipoprotéines porteuses d’Apo B
(ou Apo E) riches en cholestérol
Il s’agit
des récepteurs Apo B/E. Ils ont été découvert par Goldstein et Browm en
1974 : PM= 160 kDa.

· Les cellules qui ont besoin de cholestérol
pour leur métabolisme, expriment à leur surface une protéine (récepteur)
capable de reconnaître les LDL, puis de les faire entrer dans la cellule
(internalisation) où elles sont digérées par les lysosomes libérant le
cholestérol que la cellule va utiliser.
· Ce récepteur est une glycoprotéine de 839
acides aminés pesant 160000 daltons. De l'extrémité NH2-terminale à
l'extrémité COOH-terminale, on distingue cinq domaines :
Il existe
de fortes interactions entre les acides aminés positifs et négatifs de l’Apo B
et les acides aminés basiques (Cystéines) et acides (Aspartates) du domaine de
liaison.
La
concentration extracellulaire intervient également avec les charges négatives des asparagines et des
glutamates. Quand cette concentration augmente, cela limite la fixation entre
les récepteurs et les LDL.
Le segment
intracellulaire a un rôle crucial dans l’attachement des récepteurs aux puits
tapissés de clathrines. Des anomalies à ce niveau entraînent une dysrégulation
du catabolisme des LDL par défaut d’internalisation.
L’augmentation
des LDL dans le sang entraîne une hypercholestérolémie
de type II.
"
Déficit quantitatif en récepteurs des LDL (observé dans certains cas
d’hypercholestérolémie familiale)
"
Déficit qualitatif de ces récepteurs provoqué par un régime trop riche en
cholestérol (et/ou engraissement)
Ces
déficits conduisent à ce que les LDL ne soient plus catabolisées par « la
voie normale » des récepteurs aux Apo B/E. Les LDL séjournent plus
longtemps dans le plasma et sont alors modifiées par oxydation par les radicaux
libres.

·
Lorsque
les LDL sont oxydées au cours de leur transport plasmatique, elles ne peuvent
plus être reconnues par le récepteur apoB/apoE.
·
Elles
sont alors prises par un récepteur de polyanions, exprimé à la surface des
macrophages, appelé à ce titre « récepteur éboueur » (scavenger).
·
La
captation des LDL oxydées par les macrophages et leur dégradation aboutit à
l’accumulation de lipides dans la cellule. Celle–ci dégénère (cellule spumeuse)
et est à l’origine de la formation des plaques d'athérome (athérosclérose)
Ø Les
récepteurs LRP = LDL–receptor related protein :
Egalement connu sous le
nom d’a_macroglobuline
receptor, il s’agit d’un récepteur qui présente de nombreux ligands dont les
remnants de chylomicrons et les VLDL.
Il se lie
à l’Apo E et permet l’internalisation des remnants de chylomicrons, VLDL, mais
également de protéases comme la t–PA (plasminogène activateur tissulaire) ainsi
que d’autres molécules comme la lactoferrine et la thrombospondine.
Il joue un rôle dans
différents processus vasculaires dont le métabolisme des lipoprotéines et le
processus de fibrinolyse (t–PA)
Ø
C’est un
nouveau facteur de risque cardiovasculaire : son taux est associé aux
athéromes.
Elle
ressemble à une lipoprotéine dont l’Apo B est liée par un pont disulfure à une
Apo (a) Elle ressemble également au plasminogène.
Son
métabolisme n’est pas bien connu. Elle est d’origine hépatique mais ne provient
pas du catabolisme des VLDL aux chylomicrons. Son métabolisme intracellulaire
passe par la liaison aux récepteurs B/E.
Elle
inhibe partiellement l’activité de HMG–CoA réductase.
Environ 30% des LDL sont
dégradées dans les tissus extrahépatiques ; 70% dans le foie.
v Les HDL :
C’est la voie d’épuration du cholestérol tissulaire avec
retour au foie pour être conjugués sous forme de sels
biliaires et éliminés par la bile. A ce
titre, chez l’homme, elles sont considérées comme bénéfiques.
Les HDL
servent également « d’entrepôt » pour l’Apo C et E nécessaires au
métabolisme des chylomicrons et VLDL.
Elles sont
essentiellement synthétisées dans le foie et sont libérées sous forme native
discoïdale constituée :
-
D’une
bicouche lipidique de phospholipides,
-
De
cholestérol libre,
-
D’un
peu de triglycérides et
-
Des
apoprotéines.
Ø Maturation
des HDL :
Elle se fait dans le
plasma, où
-
Fixation
d’Apo AI issues des chylomicrons et des VLDL,
-
Perte
d’Apo E et C vers les chylomicrons et les VLDL.
Au niveau lipidique,

Les ester
de cholestérol non polaires entrent dans l’intérieur hydrophobe de la bicouche
tandis que la lécithine est transportée à l’albumine plasmatique. La réaction
continue, produisant un noyau non polaire qui repousse la bicouche jusqu’à
former un HDL sphérique.

Lors de leur passage
dans le foie, les HDL sont dégradées, le cholestérol libéré et conjugué pour
former les sels biliaires pour être éliminé.
Ø Rôle
double des HDL :
-
Maturation
des lipoprotéines riches en triglycérides,
-
Epuration
du cholestérol tissulaire.
D’où une interprétation
vulgarisée : « les HDL transportent le bon cholestérol ».
Ø Régulation
du taux de cholestérol circulant :
![]()
Importance du rapport : Si le rapport
augmente, la cholestérolémie baisse.
Si
le rapport baisse, la cholestérolémie augmente.
Ce rapport permet
d’évaluer les risques de pathologies cardiovasculaires.


Ø Classification
des lipoprotéines selon Alauporie :
Cette classification
rend compte de la réalité par rapport à la classification basée sur la densité
(chylomicron, VLDL, IDL, LDL et HDL) Elle repose sur la composition en
apoprotéines (avec l’utilisation d’anticorps)
Il existe
des particules simples, c’est–à–dire qui ne contiennent qu’une seule
apoprotéine, comme
Il existe des particules
complexes, c’est–à–dire qui contiennent au moins 2 apoprotéines, comme
Ces auteurs ont
d’ailleurs montré que seule
v Pathologies associées aux
lipoprotéines :
Ø Les
hyperlipoprotéinémies :
-
De type I :
-
Hyperchylomicronémie,
-
Hypertriglycéridémie
(dépend des graisses alimentaires)
Origine génétique.
-
De type II a :
-
Augmentation
des LDL (b_lipoprotéine)
-
Hypercholestérolémie,
Maladie génétique :
problème de récepteurs.
-
De type II b :
-
Augmentation
des LDL et des VLDL (avec l’âge)
-
Altération
de l’efficacité de l’épuration du cholestérol par les récepteurs,
Traitement : Par une baisse d’apport de sucre et d’alcool (diététique),
équilibre de l’apport alimentaire (baisse de l’apport des acides gras
insaturés)
Par
médicaments : baisse de la synthèse endogène du cholestérol en bloquant
l’HMG_CoA réductase.
-
De type III :
-
Pas
courant
-
De type IV :
-
Augmentation
des VLDL,
-
Hypertriglycéridémie
endogène (dépend des glucides, de l’alcool ou de l’obésité) dépendante de la
concentration intracellulaire hépatique des acides gras.
-
De type V :
-
Hyperchylomicronémie,
-
Augmentation
des VLDL (hyper pré_b lipoprotéinémie)
-
Extension
du type IV : en cas extrême, problème de cyrhose.
Ø L’athérosclérose :
= Pathologies
cardiovasculaires cérébrales
Définition :
Elle
affecte les artères élastiques et les artères musculaires les plus
volumineuses (aorte, artères rénales, artères cérébrales) Selon l’OMS,
l’athérome est une association de remaniements de l’intima des artères des gros
vaisseaux : accumulation de lipides, de glucides, de sang, des plaquettes
sanguines, de tissus fibreux, de dépôts calciques.
Le tout
est associé à des modifications de la média.
La lésion
évolue au cours du temps. La plaque d’athérome commence à se développer chez le
jeune adulte et finit par se calcifier.
L’athérosclérose
est une maladie dégénérative et dysmétabolique de la paroi artérielle (sclérose et durcissement)
Elle comporte : L’athérosclérose (artères de grand
diamètre),
La
médiocalcose (artères de diamètre plus faible),
L’artériosclérose
(petites artères et artérioles),
Facteurs de risque :
-
L’athérosclérose
est fréquente dans les pays industrialisés.
-
Le
risque est plus élevé chez l’homme que chez la femme.
-
Il
peut exister une prédisposition dénétique (hypercholestérolémie), mais elle est
surtout liée aux habitudes alimentaires.
-
L’hyperlipidémie,
l’HTA, le tabagisme, les lésions vasculaires (sénescence, diabète) sont des
facteurs de risques principaux.
v Métabolisme des lipides au niveau
intestinal :
Incorporation
des lipides exogènes par digestion.
Les triglycérides constituent les graisses les plus abondantes dans le système alimentaires.
Ø Les
lipases dans le tractus digestif :
-
Une lipase linguale est sécrétée par
la face dorsale de la langue. Cependant, cette enzyme n’a pas d’importance chez
l’homme par rapport au rat ou à la souris, où elle est la seule enzyme
préduodénale.
-
Dans l’estomac, la chaleur est
importante pour liquéfier la majeure partie des lipides alimentaires émulsifiés
grâce aux contractions péristaltiques. L’estomac sécrète une lipase gastrique qui, chez l’homme, est la principale
enzyme préduodénale.
-
Le pancréas : la lipase pancréatique est l’enzyme du suc pancréatique
qui hydrolyse les triglycérides émulsifiés du duodénum en présence de sels
biliaires et de colipase. La lipase agit
progressivement sur les gouttelettes de l’émulsion lipidique d’autant plus
rapidement que la surface de l’interface lipide/phase aqueuse et agrandie par
les sels biliaires.
Les sels biliaires viennent du foie. En
plus de ses nombreuses fonctions dans le métabolisme intermédiaire, le foie
joue un rôle important dans la digestion en produisant la bile. La vésicule biliaire stocke la bile produite par le foie
entre les repas.
Propriétés de la bile :
j Emulsification :
Les sels biliaires ont la propriété de faire baisser la tension superficielle. Ils peuvent ainsi
émulsionner les graisses dans l’intestin et dissoudre les acides gras.
k Neutralisation de l’acidité :
La bile a un pH légèrement supérieur à 7. Elle
neutralise le chyme acide de l’estomac et la prépare à la digestion
intestinale.
l Excrétion :
La bile est aussi un moyen d’excrétion du
cholestérol et des acides biliaires.
La colipase :
La lipase pancréatique
est apparemment inhibée par les sels biliaires. La colipase a pour fonction de
surmonter cette inhibition, en se liant dans un rapport moléculaire de 1/1 avec
la lipase, et en se liant à l’interface sels biliaires–triglycérides.
Ø Mécanisme
d’action de la lipase pancréatique :
Les triglycérides sont
hydrophobes. L’organisme doit développer un moyen pour augmenter la surface des
lipides afin que la lipase puisse attaquer efficacement ces lipides. Pour cela,
il y formation d’une émulsion sous forme de gouttelettes lipidiques. Celles–ci
doivent être stabilisées : c’est l’action des sels biliaires.
La colipase a 2 fonctions :
-
Elle
fixe les gouttelettes pour renforcer la stabilité de l’émulsion.
-
Elle
possède une affinité pour la lipase pancréatique qui vient en contact avec les
triglycérides et les hydrolyse. La colipase permet l’ancrage de la lipase à son
substrat (les triglycérides)

Colipase
Lipase
Sels biliaires
La lipase
pancréatique hydrolyse spécifiquement les liaisons esters en position 1 et 3
des triglycérides. On obtient alors 2 acides gras
libres et un 2_monolycéride.

L’acide
gras en position 2 est lié à la molécule de glycérol par une liaison ester secondaire. Son hydrolyse nécessite l’isomérisation d’une liaison ester primaire pour
avoir l’hydrolyse complète (processus lent)
Les 2_monoglycérides
sont les produits terminaux majeurs de la digestion des triglycérides.
Ø Régulation
de la lipase pancréatique :
L’action de la lipase
nécessite la structure micellaire : le
niveau de régulation de la lipase correspond à l’intensité
de l’émulsion. Plus il y a de gouttelettes, plus l’action de la lipase est
importante.
Il existe une cholestérol estérase qui dégrade les esters de cholestérol,
qui sont ainsi absorbés dans l’intestin sous forme non estérifiée.
La phospholipase A2 hydrolyse la liaison ester en
position 2 des glycérophospholipides d’origine
biliaire ou alimentaire. Cela donne des lysophospholipides
qui, en tant que « détergents »,
participent à l’émulsification et à la digestion des lipides.
Dans l’intestin :
Les 2_monoglycérides,
les lysophospholipides et le cholestérol sont transportés via les micelles vers
la bordure en brosse des entérocytes. Ces
produits d’hydrolyse traversent la membrane plasmique sous forme de micelles
stabilisées par les sels biliaires. Ces derniers, par leur pouvoir détergent,
déstabilisent les lipides de la membrane pour laisser pénétrer les micelles.
Au niveau
du pôle apical de l’entérocyte, les micelles
sont déstructurées avec libération des acides gras et les 2_monoglycérides. Les
sels biliaires sont réabsorbés au niveau de l’iléon
(partie terminale de l’intestin) puis rejoignent la veine
porte.
Au niveau de l’intestin,
les 2_monoglycérides sont reconvertis en triglycérides. Les acides gras
utilisés pour la resynthèse des triglycérides doivent être préalablement
activés sous forme d’acyl_CoA via le CoASH grâce à l’acylCoA
synthétase.
Acyl
transférase Acyl transférase
2_monoglycéride +
acyl_CoA " 1,2_diglycéride ou 2,3_diglycéride +
acyl_CoA " triglycéride
R1–COOH
+ CoASH " R1–CO~SCoA + H2O
Liaison
thioester
Les acides gras à chaîne courte ont un trajet différent.
Ils sont relativement solubles et diffusent directement au niveau de la bordure
en brosse de l’épithélium intestinal. Ils rejoignent ensuite le sang pour aller
dans le tissu hépatique.
Les lysophospholipides
et le cholestérol sont recyclés via l’acylCoA pour régénérer les phospholipides
et le cholestérol estérifié.
Les triglycérides, le
cholestérol et les phospholipides intègrent les chylomicrons. Ces derniers
partent dans les vaisseaux lymphatiques et rejoignent le sang via le canal
thoracique.
Ø Régulation
au niveau intestinal :
Il n’y a pas de
régulation « proprement dite ». Il existe une seule régulation :
l’absorption des lipides ingérés au niveau de la lipase pancréatique qui dépend
du degré d’émulsion.
Ø Rôle de
la vésicule biliaire :
C’est le lieu de
stockage et de concentration des sels biliaires. Cette concentration est plus
importante après les repas. S’il y a une ablation de la vésicule biliaire, la
sécrétion des sels biliaires se fait en continu.
v Le tissu adipeux :
Le tissu adipeux est un
organe de stockage, de mise en réserve de l’énergie. Cette mise en réserve a 2
origines : l’excès lipidique et l’excès glucidique qui entraînent un dépôt
de triglycérides.
Interactions entre métabolisme glucidique et
lipidique :

Sous
l’action de l’insuline, les glucides sont incorporés sous forme de glucose_6è pour entrer dans la glycolyse et la voie des
pentosesè.
-
La
voie de la glycolyse aboutit à la formation de pyruvate qui est transformé en
acétyl_CoA qui va entrer dans le cycle de Krebs.
-
La
voie des pentosesè est importante car elle est la source de
NADPH+H+, réservoir à la
lipogenèse.
Le
glycérol_3è
peut être formé à partir de la réduction du DHA–è
ou à partir de la phosphorylation du glycérol
(par la glycérol kinase qui hydrolyse un ATP)
Mais la glycérol kinase a une faible activité
dans le tissu adipeux. Le tissu adipeux est dépendant de la glycolyse et a
besoin d’un apport de glucose (via les transporteurs Glut–1 et Glut–4) afin de
fournir du glycérol_3è.
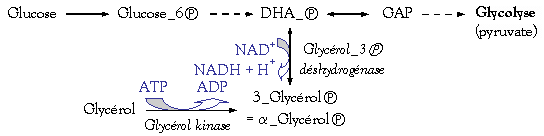
Ø L’a–glycérol (glycérol–è) est le
précurseur des triglycérides :
2 Acyl_CoA Acyl_CoA Acyl transférase Acyl transférase Triglycéride 1,2 diglycéride = 1,2 diacylglycérol Acide phosphatidique = 1,2 diacylglycérolè

Ø Synthèse
des phospholipides à partir de l’acide phosphatidique :
(PC) Acide phosphatidique

Même mécanisme avec
l’éthanolamine :
CDP–éthanolamine " CMP +
Phosphatidyléthanolamine (PE) par une
transférase
La phosphatidylsérine (PS) est directement produit par
réaction de la sérine sur
Dans le foie, une autre voie permet à
La synthèse de la phosphatidylinositol (PI) se fait à partir du
CDP–diacylglycérol.
(PS) (PE) (PC) (PI) ou
Phosphatidylinositol synthétase rol Acide phosphatidique

Ø Devenir
des triglycérides au niveau du tissu adipeux :
j
k Le tissu adipeux peut
retransformer des acides gras libres (provenant de la lipolyse) en acyl_CoA
grâce à l’acétyl_CoA synthétase.
l La réestérification de ces acides gras par le glycérol_3è conduisant à la
formation de triglycérides. A l’intérieur du tissu adipeux, il existe un cycle
continuel de lipolyse/réestérification.
Si le taux de
réestérification est inférieur à celui de la lipolyse, les acides gras s’accumulent
et diffusent dans le plasma et se fixent à l’albulmine.
Il existe 2 pools d’acides gras :
-
Le
pool provenant de la lipolyse des triglycérides de lipoprotéines (chylomicrons,
VLDL),
-
Le
pool provenant de la lipolyse des triglycérides du tissu adipeux par
Ø Régulation
de la synthèse des triglycérides au niveau du tissu adipeux :
La régulation de la
synthèse des triglycérides se fait à partir de
-
Forme
active = forme phosphorylée,
-
Forme
inactive = forme déphosphorylée.
Il existe
un équilibre permanent entre ces 2 formes.
-
L’activation
de l’enzyme par phosphorylation fait intervenir une kinase,
-
L’inactivation
de l’enzyme par déphosphorylation fait intervenir une phosphatase.
L’effecteur essentiel
est l’AMPC qui est lui–même synthétisé à partir de l’ATP
sous l’action de l’adénylate cyclase. Il peut
être transformé en AMP par une phosphodiesterase.
Ø Cet
équilibre est régulé par des hormones :
L’adrénaline, la noradrénaline, le glucagon,
l’insuline et la prostaglandine E.
" Ces hormones vont réguler l’adénylate
cyclase.
-
L’adrénaline et glucagon régulent positivement
l’adénylate cyclase et, donc, favorise la synthèse d’AMPC qui favorise
-
La prostaglandine E régule négativement
l’enzyme.
-
L’insuline régule positivement la
phosphodiestérase et donc inhibe l’action
Le tissu
adipeux est un des principaux sites d’action de l’insuline. Il est beaucoup
plus sensible à l’insuline que d’autres tissus.
Quand
l’apport en glucides est suffisant au niveau de l’organisme :
" Le taux de glucose est élevé,
" Sécrétion importante d’insuline,
" La phosphodiestérase est favorisée,
" Inhibition de
" Cela empêche la mobilisation des acides gras.
Quand
l’apport en glucides est bas :
" Inhibition de la synthèse d’insuline,
" Levée d’inhibition de
" Mobilisation des réserves lipidiques,
" Diffusion des acides gras libres vers les autres tissus.
Ø Mode
d’action des hormones :
Les hormones vont agir
sur les récepteurs membranaires et induisent un signal au niveau de la cellule.
Exemple : L’adrénaline, famille
des récepteurs b–adrénergiques :
Ces
récepteurs sont communs à plusieurs hormones. Celui de l’adrénaline est un des
mieux connus. Ces récepteurs vont dépendre de l’AMPC, c’est–à–dire que la signalisation cellulaire (induite par la fixation du
ligand sur son récepteur) est induite par l’AMPC = 2nd messager.
Cette
transduction du signal implique les protéines G " Système de l’adénylate cyclase.
Le système de l’adénylate cyclase :
-
Il
est impliqué pour les récepteurs à 7 segments transmembranaires.
-
La
régulation de l’adénylate cyclase peut s’effectuer par l’intermédiaire d’au
moins 2 protéines régulatrices dépendantes du GTP.
-
Il
existe des protéines GS, stimulatrices de la synthèse d’AMPC.
-
Il
existe des protéines GI, inhibitrices de la synthèse d’AMPC.
Chacune de
ces protéines est composée de 3 sous–unités a, b et g. La sous–unité a de la protéine G est
capable de lier le GTP ou le GDP.
-
Au
repos, la protéine G porte le GDP.
-
Quand
le récepteur lie l’hormone (ligand), il change de conformation pour pouvoir
s’associer à la protéine G.
-
Les
interactions entre le récepteur et la protéine G provoquent un échange du GDP pour
du GTP, activant ainsi la protéine.
-
Cette
dernière se sépare du récepteur. Et elle se dissocie en, d’une part, la
sous–unité a
et le dimère b–g, d’autre part.
-
La
sous–unité a
peut activer l’effecteur (adénylate cyclase) présente dans la membrane plasmique.
-
L’ATP
est transformé en AMPC. sa concentration intracellulaire
augmente.
-
L’AMPC est un effecteur
allostérique de la protéine kinase A.
-
L’état
inactif de l’enzyme est un tétramère dont les sous–unités cataboliques C sont
bloquées par les sous–unités régulatrices R.
-
Lorsque
l’AMPC s’associe aux sous–unités R, le tétramère se
dissocie. Les sous–unités C sont alors actives et elles phosphorylent les
résidus d’autres protéines (ex : TGLH)

L’extinction
du signal du second messager s’effectue sur plusieurs plans :
-
L’hormone
liée à son récepteur se dissocie.
-
La
protéine G retourne à son état de repos par hydrolyse du GTP en GDP.
-
L’AMPC est dégradé par une
phosphodiestérase.
-
La
baisse de la concentration en AMPC entraîne l’état inactif
de la protéine kinase A.
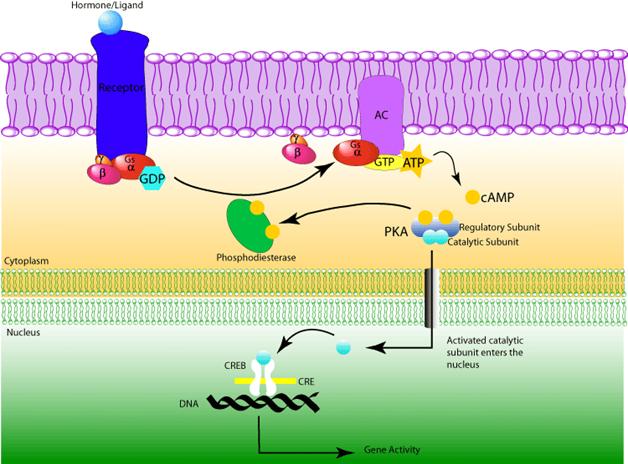
Ø Le
récepteur à insuline :
C’est un récepteur à
activité enzymatique de la tyrosine kinase. Cette activité est activée par une
phosphodiestérase. Elle va phosphoryler les résidus tyrosine des protéines.
En 1er
lieu, le récepteur se phosphoryle lui–même. Puis, les protéines (des voies de
signalisation) se fixent sur les résidus tyrosine–è et seront ainsi
phosphorylées à leur tour.
Le récepteur à insuline
est constitué de 4 sous–unités : 2 a et 2 b.


Effets de l’insuline :
-
Augmentation
de la capture de glucose :
L’insuline
fournit l’utilisation du glucose à des fins énergétiques. L’insuline a un rôle
hypoglycémiant.
-
Augmentation
de la synthèse de glycogène dans le foie et les muscles,
-
Baisse
de la glycogénolyse,
-
Augmentation
de la glycolyse,
-
Augmentation
de la synthèse d’acides gras,
-
Augmentation
de la synthèse de triglycérides dans le tissu adipeux,
-
Baisse
de l’activité des TGHL dans le tissu adipeux.
v Le foie : rôle du tissu
hépatique dans le métabolisme lipidique :
Principales fonctions :
-
Il
collecte les composants alimentaires provenant du tractus digestif via la veine
porte,
-
Il
participe au métabolisme des différentes molécules,
-
Il
approvisionne constamment de l’organisme en substrats énergétiques et en
précurseurs nécessaires aux synthèses.
-
Il
permet la détoxification de composés toxiques,
-
Il
permet aussi l’excrétion de composés dans la bile.
Rôle métabolique :
Le foie participe au
métabolisme de presque toutes les catégories de molécules et contribue à
maintenir constant leur concentration plasmatique.
Au niveau du métabolisme lipidique :
Le foie
est considéré comme jouant un rôle central (bien que le TR soit également très
actifs) Le foie assure des fonctions essentielles :
-
Il
facilite la digestion et l’absorption des lipides en produisant la bile qui
contient du cholestérol et des sels biliaires synthétisés dans le foie ou par
capture du cholestérol des lipoprotéines.
-
Le
foie possède des produits énergétiques nécessaires à la synthèse et l’oxydation
des acides gras et pour la synthèse des phospholipides et des triglycérides.
-
Il
est capable de transformer les acides gras en corps cétoniques.
-
Il
fait partie intégrante du métabolisme des lipoprotéines.
Les fonctions
spécifiques au foie sont :
-
La
synthèse des acides gras polyinsaturés (AGPI),
-
La
synthèse des sels biliaires,
-
La
synthèse des corps cétoniques (= structures relais du métabolisme glucidique
quand il y a un jeûn assez long)
Les tissus
ont en permanence besoins de substrats énergétiques et d’éléments nécessaires
aux synthèses. Ces substrats sont apportés par la nourriture mais en quantité
variable.
Le foie et d’autres
tissus vont jouer un rôle d’organe de réserve afin d’amortir ces variations. On
distingue une 1ère phase d’absorption et une 2nde phase
post–prondriale qui peut aller jusqu’à la faim et au jeûn.
Pendant la 1ère
phase, les tissus vont tirer leur énergie de la dégradation du glucose. Dans la
2nde phase, les besoins énergétiques sont assurés (à l’exception du
tissu nerveux) à partir d’acides gras, de corps cétoniques et d’acides aminés.
La phase
d’absorption débute avec la prise alimentaire et dure 2 à 4 heures. La
digestion des aliments entraîne l’augmentation transitoire du taux plasmatique de
glucose, d’acides aminés et de triglycérides.
Le pancréas répond à ces augmentations par
l’augmentation de la sécrétion d’insuline et une baisse de celle du glucagon.
La disposition en substrats associée à la hausse du rapport insuline/glucagon.
Le tissu adipeux
synthétise des triglycérides. Le foie forme du glycogène et des triglycérides.
Les muscles forment aussi du glycogène et des protéines. Ces substrats sont
stockés et constituent les réserves énergétiques de l’organisme.
Remarque : L’alimentation en glucose du cœur et du tissu
nerveux ne dépend pas du niveau d’insuline.
Le métabolisme lipidique hépatique pendant la
phase d’absorption :
Le sang veineux
provenant de l’intestin et du pancréas parvient directement au foie par
l’intermédiaire du système porte. Le foie est le site le plus important de la
synthèse de nouveaux acides gras.
Les
substrats nécessaires à cette synthèse sont l’acétyl_CoA et le NADPH. Ils sont
fournis par la dégradation du glucose.
Cette augmentation des
acides gras endogène et de ceux provenant de la dégradation des lipoprotéines
conduit à une augmentation de la synthèse des triglycérides.
Le glucose_3è nécessaire à cette
synthèse provient de la glycolyse (cf. tissu adipeux)
Les triglycérides
intègrent les VLDL et sont diversés dans le sang.
Le métabolisme lipidique hépatique pendant la
phase post–prondriale :
Cette phase est
déclenchée par une modification de la sécrétion des hormones du pancréas. Les
cellules A libèrent plus de glucagon, les cellules B qui synthétisent
l’insuline sont inhibées.
La chute
du taux insuline/glucagon dans le plasma correspond à une modification du
métabolisme intermédiaire. Les substrats capables de fournir de l’énergie sont
répartis entre le foie, le tissu adipeux, les muscles et cerveau.
Ceci
permet :
-
Le
maintien du niveau de glucose suffisant pour alimenter le cerveau, les glandes
surrénales et les érythrocytes pour lesquels le glucose est
« vital ».
-
L’approvisionnement
énergétique des autres tissus grâce à la mobilisation des acides gras à partir
du tissu adipeux et des corps cétoniques dans le foie.
Ø Métabolisme
lipidique hépatique dans la phase post–prondriale :
Les acides
gras libérés à partir du tissu adipeux par la lipolyse constituent la source
énergétique du foie la plus importante durant la phase prolongée de faim.
Les acides gras sont dégradés dans le foie en
acétyl_CoA et transformés en majeure partie en corps cétoniques. Avec ces corps
cétoniques, le foie couvre les besoins énergétiques des différents tissus.
L’apport en corps cétoniques est utilisé par tous les tissus à l’exception du
foie lui–même.
" Ceci épargne le glucose et entraîne la
nécessité de dégrader les protéines en acides aminés dont la structure carbonée
serait utilisée et transformée en glucose.
Résumé : Synthèse des acides gras et acides gras
polyinsaturés (spécifique au foie) et synthèse des corps cétoniques. è

La synthèse d’acides
gras se déroule dans le cytoplasme de nombreux tissus dont le foie (tissu
adipeux, reins, poumons, glandes mammaires) La synthèse d’acides gras est
dépendant d’un certain nombre de facteurs.
Elle nécessite :
-
De
l’acétyl_CoA,
-
D’un
pouvoir oxydoréducteur important au niveau cellulaire : le NADPH+H+ qui provient de la voie
des pentosesè.
L’étape limitante de la
biosynthèse des acides gras est la formation du malonyl_CoA
à partir de l’acétyl_CoA.
Ø Formation
du malonyl–CoA :
Elle se fait par
l’acétyl_CoA par carboxylation. Elle est
catabolisée par l’acétyl_CoA carboxylase qui
contient de la biotine comme groupement prosthétique.
Dans une 1ère étape : Il se forme une carboxybiotine, ce qui nécessite
de l’ATP.
Biotine
+ CO2 " Carboxybiotine.
Dans une 2nde étape : La carboxybiotine transfert son groupement
carboxyle sur un acétyl_CoA par une transcarboxylase.
Carboxybiotine
+ acétyl_CoA " Biotine
+ malonyl_CoA
Le CO2 est fournit par le
carbonate (HCO3–)

Ø Régulation
de l’acétyl–CoA réductase :
C’est une
enzyme allostérique. Elle est stimulée par le citrate et inhibée par les acides
gras activés (sous forme d’acyl_CoA)
Les hormones contrôlent
également l’acétyl_CoA réductase. Sa forme active est la forme non
phosphorylée. Sa forme inactive est la forme phosphorylée.
L’insuline l’active via
une phosphatase. Le glucagon et l’adrénaline l’inactive via une protéine
kinase.
Ø Le
complexe AG–synthétase :
La biosynthèse des acides
gras est catabolisée dans le cytoplasme par un complexe enzymatique :
l’AG–synthétase qui utilise l’acétyl_CoA comme point de départ. Au cours des
réactions cycliques, la molécule sera allongée 7 fois d’une unité en C2. Au
final, le produit formé aura C16 : l’acide palmitique CH3–(CH2)14–COOH
Le malonyl_CoA, substrat
de cette réaction d’élongation libère son groupement carboxyle sous forme de CO2 lors de la réaction de
condensation. Le l’agent réducteur utilise le NADPH+H+ pour la biosynthèse des
acides gras. Ce coenzyme peut provenir de différentes sources dont la voie des
pentosesè.
Globalement :
1 acétylCoA + 1
malonylCoA + 14 NADPH+H+ " 1 acide palmitique + 7
CO2 + 8 CoEnzA + 14 NADP + 6 H2O
Chez les
vertébrés, ce complexe enzymatique se compose de 2 chaînes peptidiques
identiques et constituées d’un homodimère.
Chacune de
ces 2 chaînes peut cataboliser 7 réactions enzymatiques partielles distinctes
nécessaires à la synthèse du palmitate. A ces complexes enzymatiques est
associée une protéine de transport d’acyl : ACP
(acyl carrier proteine)
Le complexe de la
synthase est un complexe multienzymatique qui ne peut être subdivisé en
constituants élémentaires sans perdre son activité.
L’existence d’un
polypeptide multienzymatique unique constitue un avantage du fait que
l’ensemble de toutes les enzymes du complexe est coordonné vu que le complexe
est codé par un gène unique.
L’ACP est complexé à un
groupement : Phosphopantéthricine : Pan–SH.
L’ACP_Pan–SH est un long
bras dur lesquels on peut fixer les substrats. A proximité se trouve un autre
groupement thiol d’un résidu cystéine d’une des enzymes du complexe, la cétoacylsynthétase (= enzyme de condensation)
mais de l’autre monomère.
Cette organisation
résulte du fait que 2 monomères sont disposés en « tête bêche ». Les
2 groupements thiols participent à l’action de la synthétase. Seul le dimère
est actif.


Chaque ½ AG–synthétase peut lier
le substrat (résidu acyl ou acétyl_CoA) sous forme d’un thioester au niveau de C3.

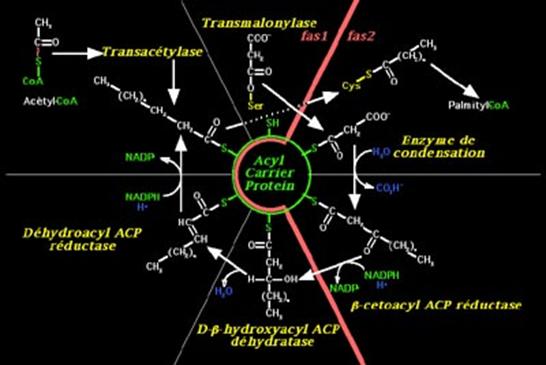
![]()

·
L'acide
gras synthase, chez les animaux, est un multienzyme, formé de deux sous-unités,
catalysant six réactions ou transferts : on distingue une activité de
transacétylase, de transmalonylase, une réaction de condensation, deux
réductions et une déshydratation.
·
Le
substrat est transporté au cours de ces multiples réactions par un seul
coenzyme (4-phosphopantéthéine) lié à une des deux sous-unités (acyl carrier
protein = ACP). La 4-phosphopantéthéine a une structure proche de
celle du coenzyme A et sa partie active est une fonction thiol (-SH) situé
au centre du site actif de
·
Cette
fonction thiol de l'ACP (thiol central) au départ de la réaction fixe un
radical acétyl- provenant de l'acétyl-CoA. Au cours des cycles suivants de
l'activité du multienzyme, elle porte des acyl-CoA dont la chaîne grasse
s'allonge de deux Carbones à chaque cycle.
·
La
transacétylase transfère le radical de ce thiol de l'ACP vers une autre
fonction thiol appartenant à l'enzyme de condensation (thiol périphérique), qui
est une autre sous-unité du multienzyme. Cette action libère le thiol central.

·
La
transmalonylase forme un complexe avec le radical malonyl- du malonyl-CoA,
substrat de
·
Ce
radical malonyl- est ensuite transféré vers le thiol de l'ACP (thiol central),
qui vient d'être libéré par la transacétylase, qui a fixé l'ancien radical sur
le thiol de l'enzyme de condensation (thiol périphérique).

·
L'enzyme
de condensation catalyse alors la décarboxylation du radical malonyl et le
transfert du radical acyl depuis le thiol périphérique sur le malonyl porté par
le thiol central.
·
Le
radical produit de cette réaction est un ß-cétoacyl-ACP.

·
La
sous-unité suivante (ß-cétoacyl-ACP réductase) catalyse la réduction de ce
ß-cétoacyl-ACP en ß-hydroxyacyl-ACP grâce aux Hydrogènes apportés par le NADPH
avec son proton. Le produit est un D-ß-hydroxyacyl-ACP.
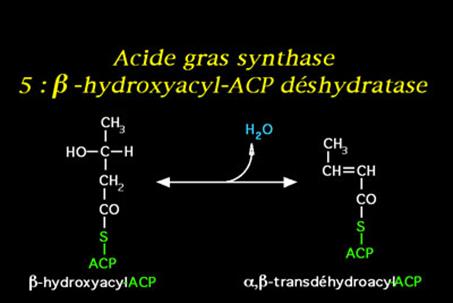
·
Le
ß-hydroxyacyl-ACP est déhydraté par une lyase qui soustrait une molécule d'eau
spécifiquement entre les Carbones ![]() et ß du radical, libérant un
et ß du radical, libérant un ![]() ,ß-trans-déhydroacyl-ACP.
,ß-trans-déhydroacyl-ACP.

·
La
sous-unité suivante (a,ß-déhydroacyl-ACP réductase) catalyse la
réduction de ce a,ß-déhydroacyl-ACP en acyl-ACP grâce aux
Hydrogènes apportés par le NADPH avec son proton.

·
Le
produit porté à ce stade par le thiol central est un radical acyl- dont la
chaîne grasse possède deux Carbones de plus qu'au début des réactions.
·
La
transacétylase peut transférer à nouveau ce radical vers le thiol périphérique
pour libérer le site où va se fixer un nouveau malonyl-CoA. La fixation sur le
thiol périphérique est possible jusqu'à ce que la chaîne grasse possède 16
Carbones (palmityl-ACP). A ce stade, le radical palmityl- est libéré par
l'enzyme et chargé sur un coenzyme A libre : c'est le produit final
de
Le palmitate libre doit
être activé sous forme l’acyl_CoA avant d’être dirigé vers une autre voie
métabolique. Généralement, il est utilisé dans l’estérification des acyls
glycérols.
&(estérification) Acyl glycérol ; cholestérol esters
Palmitate " Palmityl_CoA
( Elongation de la chaîne et désaturation " AGPI
Ø La voie
des pentosesè :
C’est une
source principale du NADPH pour la synthèse d’acides gras. Les 2 voies
métaboliques se trouvent dans le cytosol : il n’y a pas de barrière de
perméabilité pour le transfert du NADPH.
Les autres sources de
NADPH :
-
La
transformation du malate en pyruvate par l’enzyme malique,
-
A
moindre niveau : la transformation de l’isocitrate en a_cétoglutarate par
l’isocitrate déshydrogénase.
Le principal élément de
synthèse des acides gras est l’acétyl_CoA. La synthèse des acides gras se fait
dans le cytoplasme, alors que l’acétyl_CoA est formé au sein des mitochondries.
Et l’acétyl_CoA ne diffuse pas facilement de la mitochondrie vers le cytosol.
L’utilisation
du glucose pour la lipogenèse se fait par l’intermédiaire du citrate. La voie
de biosynthèse implique la glycolyse, suivie
par la décarboxylation oxydative du pyruvate en acétyl_CoA au sein de la
mitochondrie. Puis l’acétyl_CoA se condense avec l’OAA pour former le citrate
dans le cycle de Krebs.
Une fois le citrate
formé, celui–ci sort du compartiment mitochondrial via un transporteur tricarboxique. Puis, il subit un clivage
en acétyl_CoA et OAA. Cette hydrolyse est catalysée par l’ATP citrate lyase. Ainsi, l’acétyl_CoA est disponible pour la
formation du malonyl_CoA et la synthèse du palmitate dans le cytosol.
L’élongation des chaînes d’acides gras :
Elle a lieu dans le
réticulum endoplasmique. Lors de cette synthèse, les acyl_CoA sont transformés
en dérivés possédant
Palmitate_CoA + Malonyl_CoA
" Stéaroyl_CoA + CO2 + CoA~SH
Puis, il y a une
succession de réductions par le NADPH. Tous les acides gras ont un nombre pair
de carbones. Cette élongation peut se faire également pour les acides gras
polyinsaturés.
Ø Régulation :
L’état
nutritionnel régule la lipogenèse. Au cours de la phase anabolique, il y a le
stockage des excès de sucres sous forme de triglycérides.
La vitesse de lipogenèse
est abaissée en dessous d’un certain seuil de calories absorbées lors d’un
régime sans graisse, lors d’une déficience en insuline (diabète) Toutes ces
situations entraînent une augmentation des acides gras libres dans le plasma.
Il existe une relation
inverse entre la lipogenèse hépatique et la concentration en acides gras libres
dans le sérum.
Le citrate et l’acyl_CoA
régulent l’acétyl_CoA carboxylase. L’enzyme clé de la synthèse d’acides gras
est régulée positivement par le citrate et négativement par l’acyl_CoA d’acides
gras à longue chaîne.
L’acyl_CoA peut
également inhiber le transporteur tricarboxique mitochodrial du citrate en
empêchant son trafic de la mitochondrie vers le cytosol.
-
L’acyl_CoA
s’accumule lorsqu’il n’est pas estérifé, ce qui entraîne la réduction de la
synthèse des acides gras.
-
L’acyl_CoA
s’accumule suite à une augmentation de la lipolyse, ce qui entraîne
l’inhibition de la synthèse des acides gras.
Ø Les hormones
régulent la lipogenèse :
L’insuline :
Elle stimule
la lipogenèse par plusieurs mécanismes. Elle augmente le transport du glucose
dans les cellules et donc fait augmenter la disponibilité du pyruvate pour
synthèse des triglycérides et du glucose_3è pour estérifier des
acides gras nouvellement formés.
L’insuline
transforme la forme inactive de la pyruvate
déshydrogénase en forme active dans le tissu adipeux mais pas dans le
foie. Elle active aussi l’acétyl_CoA carboxylase.
Elle fait diminuer la
quantité l’AMPC via l’activation de la phosphatase. Cela
entraîne l’inhibition de la lipolyse dans le tissu adipeux, ce qui diminue les
acides gras libres et les inhibiteurs de la lipogenèse.
Le glucagon et l’adrénaline : Ils inhibent l’acétyl_CoA carboxylase.
-
Les enzymes du complexe de synthèse des acides gras :
Elles s’adaptent aux
besoins. Elles augmentent en quantité lors d’un état nutritionnel normal. Elles
diminuent en quantité lors d’un jeûn, d’une prise alimentaire riche en graisse
ou d’un diabète.
Notions principales à
retenir quant à la régulation :
Quand il y a la
biosynthèse l’acides gras, il n’y a pas d’oxydation. Cette biosynthèse s’inhibe
quand la cellule dispose de suffisamment de glucose et d’ATP pour ses besoins
énergétiques. Elle requiert de l’acétyl_CoA mitochondrial et du NADPH
(provenant de la voie des pentoses ou fournis par la navette malate–pysuvate)
Chez l’homme, le foie
est le site majeur de la synthèse des acides gras (autre site : les
cellules adipeuses)
Les acides gras
polyinsaturés (AGPI) :
Comparés aux végétaux,
les tissus animaux ont une capacité limitée à la désaturation les acides gras.
Ceci nécessite la présence dans l’alimentation de certains acides gras
polyinsaturés.
Les acides gras
essentiels (AGE) :
Ils sont nécessaires à la
synthèse d’acide arachidonique, précurseur des prostaglandines et ils ont nécessaires à la
croissance cellulaires et en partie pour les cellules nerveuses.
Ø Quelques
rappels de nomenclature :
-
Acide
stéarique : 18 : 0
-
Acide
oléique : 18 : 1
= Cis D9 18 : 1
= CH3–(CH2)7–CH=9CH–(CH2)7–1COOH
ou = oléique w9
ou n–9
= w
1CH3–(CH2)7–9CH=CH–(CH2)7–COOH
-
Acide
oléique : 18 : 2
= Cis D9,12 18 : 2
= CH3–(CH2)4–CH=12CH–CH2–CH=9CH–(CH2)7–1COOH
ou = oléique w6 ou n–6
= w 1CH3–(CH2)4–6CH=CH–CH2–9CH=CH–(CH2)7–COOH
Chez la plupart des
animaux, les doubles liaisons peuvent être apportées au niveau des positions D4, D5,
D6, D9 mais jamais au–delà de la position D4.
Au plus, chez les
végétaux, ceux–ci peuvent introduire des doubles liaisons supplémentaires au
niveau des positions D12 et D15. Ils peuvent donc synthétiser des
acides gras dits essentiels pour les mammifères.
-
C16 :
1 n–7 = Acide palmitoléique,
-
C18 :
1 n–9 = Acide oléique,
-
C18 :
2 n–6 = Acide linoléique,
-
C18 :
3 n–3 = Acide linolénique,
-
C20 :
4 n–6 = Acide arachidonique,
-
C20 :
5 n–3 = Acide écosapentaénoïque
(EPA)
Ø Synthèse
des acides gras monoinsaturés :
La 1ère
double liaison introduite dans un acide gras est pratiquement toujours en
position D2. Le système
enzymatique D9 désaturase est présent
dans le réticulum endoplasmique. Il catalyse la conversion :
Du palmitoyl_CoA (C16 :
0) en palmitoléyl_CoA
(C16 : 1 D9)
Acide
palmitique Acide
palmitoléique
Du stéarcyl_CoA (C18 :
0) en oléyl_CoA (C18 :
1 D9)
Acide
stéarique Acide
oléique
L’O2 et le NADH ou le NADPH
sont nécessaires à la réaction. Les enzymes du système énergétique sont
analogues au système mono–oxygénase impliquant le Cyt b5. Les enzymes sont
associées à 3 protéines : le NADH–Cyt b5 réductase, le Cyt b5 et une
désaturase sensible au cyanure contenant du fer.
Stéaroyl_CoA

2
Fe2+ O2 + NADH+H+
D9 désaturase Cyt b5
2
Fe3+ 2
H2O + NAD+
Oléoyl_CoA
Ø Synthèse
des acides gras polyinsaturés :
Il implique
l’intervention de désaturase et élongase. Les doubles liaisons supplémentaires introduites
dans les acides gras monoinsaturés sont toujours séparées les unes des autres
par un groupement méthylène CH2.
Chez les animaux
supérieurs, les doubles liaisons supplémentaires sont toutes introduites entre les
doubles liaisons existantes et le groupement carboxylique. Mais chez les
végétaux, elles peuvent être introduites entre la double liaison existante et
existante et le carbone Cw porteur du groupement
méthyle.
Comme les animaux
possèdent une D9 désaturase, ils sont
capables de synthétiser complètement la famille w9 (acides oléiques)
d’acides gras insaturés par une combinaison d’élongation de chaînes et de
désaturation.
Acide oléique D6 désaturase Elongase
C18 : 1 n–9 " C18 : 2 n–9 " C20 : 2 n–9
D9 D6,9
$ D5 désaturase
C20 :
3 n–3
Acide
éicosatriénoïque
L’acide éicosatiénoïque
s’accumule s’il y a un déficit en acides gras essentiels.
Dans le règne
végétal :
Acide palmitique Elongase D9 désaturase
C16 : 0 " C18 : 0 " C18 : 1 n–9
$ D12 désaturase
C18 :
2 n–6 (D9,12)
Acide
linoléique
$ D15 désaturase
C18 :
3 n–3 (D9,12,15)
Acide
2 linoléique
Dans le règne animal :
Famille des n–6 :
Précurseur :
acide linoléique D6 désaturase Elongase
C18 :
2 (D9,12) " C18 : 3 (D6,9,12) " C20 : 3 (D8,11,14)
Acide
éicosatriénoïque
$ D5 désaturase
C22 : 4 n–6 (D7,10,13,16) Elongase C20 : 4 n–6 (D5,8,11,14)
Acide docosatetraénoïque
! Acide arachidonique
$ D4 désaturase
C22 :
5 n–6
Acide
2 docosapentaénoïque
Famille des n–3 :
Acide a_linoléique D6 désaturase Elongase
C18 : 3 n–3 (D9,12,15) " C18 : 4
n–3 " C20 : 4 n–3
(8,11,14,17)
Acide éicosatétraénoïque
$ D5 désaturase
C20 : 5 n–3 (D5,8,11,14,17)
Acide eicosapentaénoïque (EPA)
$ Elongase
C22 : 6 n–3 (D4,7,10,13,16,19)
D4 désaturase C22 : 5 n–3 (D7,10,13,16,19)
Acide docosahexaénoïque (DHA) ! Acide 2 docosapentaénoïque
![]() Concentration
décroissante : C20 :
4 n–6 AA C22 : 6 n–3 DHA
Concentration
décroissante : C20 :
4 n–6 AA C22 : 6 n–3 DHA
C22 : 5 n–6 C20 :
5 n–3 EPA
C20 :
3 n–6 C22 : 5 n–3
C18 : 3 n–6
Rôle des acides gras polyinsaturés : majeurs des familles n–6 et n–3
L’acide
arachidonique = C20 : 4 n–6
-
Rôle
structural des glycérophospholipides,
-
Synthèse
des prostanoïdes (eicosanoïdes),
-
Signalisation
cellulaire.
L’EPA = C20 : 5 n–3
-
Rôle
crucial et structural des phospholipides membranaires.
Le
DHA :
-
Rôle
important pour le développement du cerveau et de la rétine (phospholipides
membranaires)
L’apport
d’acides gras essentiels :
-
Il
en faut environ 6 à 10 mg/jour
Régulation
de la synthèse des acides gras polyinsaturés :
-
Biodisponibilité
en acides gras essentiels,
-
Proportion
des acides gras essentiels,
-
Les
systèmes de désaturation et d’élongation des chaînes sont diminués au cours
d’un jeûn après une administration de glucagon ou d’adrénaline et en absence
d’insuline comme dans le diabète sucré de type I.
-
La
D6 désaturase est régulée par le taux
n–6/n–3.
-
Une
carence en acides gras essentiels, en particulier de l’acide linoléique C18 : 2 n–6 entraîne :
-
Une
baisse de croissance chez l’animal,
-
Des
altérations cutanées (perte de poils, déshydratation, desquamation),
-
Une
altération de la reproduction (morts nés, stérélité)
-
Chez
l’homme et essentiellement chez le jeune enfant : atteintes cutanées et
troubles de la coagulation sanguine.
-
Altération
de la membrane cellulaire.
Les sels biliaires :
Ils dérivent des acides
biliaires et sont conjugués à un acide aminé. Les acides biliaires sont
exclusivement formés dans le foie. Leur biosynthèse débute par le cholestérol
sur lequel des groupements OH sont apportés.
Leur
structure dérive par le cholestérol :
-
La
chaîne latérale est raccourcie de 3 carbones et le dernier carbone a été oxydé
pour former un groupement carboxyle.
-
La
double liaison du cycle B a été réduite.
-
Sur
le noyau stéroïde 3 groupements OH peuvent être fixer en position 3, 7 et 12.
-
L’acide
cholique et l’acide chenodésoxycholique sont les acides biliaires primaires.
Chez l’homme, l’acide cholique de la flore intestinale donne lieu à 2 acides
biliaires secondaires (acide lithocholique et désoxycholique)
Les acides biliaires :
|
|
C3 |
C7 |
C12 |
|
|
Acides biliaires primaires |
Acide
cholique |
–OH |
–OH |
–OH |
|
Acide
chenodesoxycholique |
–OH |
–OH |
–H |
|
|
Acides biliaires secondaires |
Acide
desoxycholique |
–OH |
–H |
–OH |
|
Acide
lithocholique |
–OH |
–H |
–H |
|
L’étape limitante de la
formation des acides biliaires est leur hydroxylation en position 7 par une 7_a hydroxylase :
Cholestérol + NADPH " 7_a hydroxycholestérol + NADP
L’acide
cholique inhibe la réaction de la 7_a hydroxylase,
constituant un rétrocontrôle. Les acides gras déterminent donc la vitesse de
dégradation du cholestérol.
Avant de quitter le
foie, les acides biliaires vont être conjugués à un acide aminé (glycine,
taurine) La synthèse de la liaison peptidique nécessite une activité des acides
biliaires par le CoA.
A partir de l’acide
cholique : Le cholyl_CoA
![]()
![]() + Glycine + Taurine
+ Glycine + Taurine
Acide glycocholique Acide taurocholique
La bile hépatique est
sécrétée par le foie et ensuite est concentré dans les vésicules biliaires par
l’élimination d’eau.
Fonctions des acides biliaires :
Ils sont amphiphatiques
(apolaires et polaires), ils ont une action de détergent. Leur fonction est de
« rendre solubles » les lipides au cours de la digestion grâce à la
formation de micelles. Ceci fait augmenter l’activité de la lipase
pancréatique.
Ø Le
cholestérol : son métabolisme :
Il peut provenir de 2
sources : la nourriture et la synthèse endogène (une quantité importante
du cholestérol est synthétisée par le foie)
Synthèse :
La voie de synthèse
débute par l’acétyl_CoA. Le cholestérol à
j Le mévalonate composé de cholestérol se forme
à partir de 3 molécules d’acétyl_CoA.
k Le mévalonate est transformé en
isopentenyl_biè (
l 6 de ces molécules en
m Le squalène sera cyclisé et transformé en
cholestérol par le clivage de
Cholestérol
=
L’enzyme
clé de la synthèse du cholestérol est l’HMG_CoA
réductase qui se situe dans l’intestin et
effectue la 1ère étape (la formation du mévalonate)
3 acétyl_CoA " 3 OH_3_méthylglutaryl_CoA " Mévalonate
(3 HMG_CoA)
L’HMG_CoA réductase est
inhibée par apport de cholestérol alimentaire. La forme phosphorylée de
l’enzyme est la forme inactive. L’insuline active l’enzyme et le glucagon
l’inhibe.
Son utilisation :
Une partie du
cholestérol est utilisé pour la formation des sels biliaires. Le cholestérol sert
également comme élément de formation des membranes cellulaires.
Il est déposé sous forme
d’ester d’acides gras dans des gouttelettes lipidiques. Le reste est déversé
dans le sang, en même temps que des triglycérides sous forme de VLDL, et sert à
approvisionner les autres tissus.
Le foie participe
également au métabolisme du cholestérol en capturant les lipoprotéines du sang
qui contiennent le cholestérol (HDL, IDL et LDL) en les dégradant.

Biosynthèse des corps cétoniques
(hépatique) :
Pendant la phase
d’absorption, le foie transforme le glucose en acides gras via l’acétyl_CoA. Le
foie peut également capturer des acides gras qui ont été amenés de l’intestin
via les chylomicrons. Les acides gras de ces 2 origines sont transformés en
triglycérides et phospholipides. Ces lipides s’associent aux apolipoprotéines
pour former les VLDL, approvisionnement des tissus extrahépatiques (muscles et
tissu adipeux principalement)
Durant la phase
post–prondriale, en particulier lors du jeûn ou d’un diabète sucré, aucun
glucose et aucun glucose ni lipide n’est apporté par l’alimentation.
L’organisme utilise ses résesrves. Le tissu adipeux libère les acides gras qui
seront dégradés en acétyl_CoA de façon oxydative et finalement sont transformés
en corps cétoniques dans le foie.
-
En
présence d’une concentration élevée d’acétyl_CoA, les mitochondries hépatiques
vont condenser 2 molécules pour donner de l’acétoacétyl_CoA.
-
Le
transfert d’un groupement acétyl supplémentaire donne du
3_hydroxy_3_méthylglutaryl_CoA = HMG_CoA (cf. cholestérol)
-
Par
élimination de l’acétyl_CoA, il y la formation de l’acétoacétate.
Il peut être transformé par :
-
Réduction
enzymatique en hydroxybutyrate,
-
Décarboxylation
non enzymatique en acétate.

Ces 3
composés sont les corps cétoniques. Ils sont libérés par le foie dans le sang
où ils sont solubles. Le taux sanguin des corps cétoniques augmente durant une
période de faim. Les 3_hydroxybutyrate et acétoacétate servent de source
d’énergie importante.
L’acétone
n’a aucun rôle métabolique, il sera éliminé au niveau pulmonaire.
Le foie produit les
corps cétoniques mais ne les utilise pas par rapport aux tissus extrahépatiques.


Les corps cétoniques sont utilisés par les
tissus extrahépatiques :
L’acétoacétate
produit au niveau du foie ne peut pas être réactivé. Dans les tissus
extrahépatiques, l’activation de l’acétoacétate en acétoacétyl_CoA peut se
faire via le succinyl_CoA et la succinyl_CoA–acétoacétyl_CoA transférase.
L’acétoacétyl_CoA
produit est ensuite clivé si l’acétyl_CoA est oxydé dans le cycle de Krebs.
Le cerveau :
Bien qu’il ne représente
que 2% de la masse corporelle, le cerveau utilise au repos 20% d’O2 et 60% du glucose. Le
glucose est unique source énergétique du cerveau qui doit être fournit en
permanence.
Ce n’est qu’après un jeûn
prolongé (1 à 2 semaines) que le cerveau peut transformer les corps cétoniques.
Spécificités
du cerveau :
-
Le
stock de glycogène des cellules nerveuses est (très) faible.
-
Les
acides gras du plasma ne peuvent pas atteindre les cellules nerveuses à cause de
-
Les
acides aminés ne peuvent pas être dégradés pour le fournir l’ATP car le tissu
nerveux ne réalise pas néoglucogenèse.
Les acides gras libres
étant les principaux substrats conduisent à la formation des corps cétoniques
dans le foie. Tous les facteurs métaboliques et endocriniens qui agissent sur
la libération des acides gras libres à partir du tissu adipeux influencent la
cétogenèse.
Ø L’oxydation
des acides gras :
Au cours du jeûn, les
acides gras libres et les corps cétoniques sont oxydés, de façon à épargner le
glucose au profit du cerveau. Les acides gras sont à la fois produits à partir
de l’acétyl_CoA et oxydés en acétyl_CoA.
Cependant, l’oxydation
des acides gras n’est pas la réaction inverse de leur biosynthèse, même si les
étapes chimiques impliquent sont comparables. La production et l’oxydation des
acides gras se fait dans 2 compartiments différents de la cellule.
L’oxydation
des acides gras a lieu dans les mitochondries. Chaque étape implique des
dérivés de l’acétyl_CoA. Chaque étape est catalysée par une enzyme différente.
Elles utilisent le NAD et le FAD comme coenzyme. Il y a la formation d’ATP.
La biosynthèse des
acides gras (lipogenèse) a lieu dans le cytosol. Elle implique des dérivés acyl
couplés à un complexe multienzymatique. Elle utilise le NADPH comme coenzyme.
Elle nécessite des ions bicarbonates (donneur de CO2) et d’ATP.
Les acides gras
(provenant du tissu adipeux) sont transportés dans le plasma sous forme non
estérifiée : les acides gras libres. Seuls les acides gras à chaînes
courte sont en solution, les acides gras les plus longs sont moins
hydrosolubles et sont liés à l’albulmine.
Lors de leur
utilisation, les acides gras sont prélevés par la cellule et sont couplés à une
protéine.
A l’exception du cerveau
et érythrocytes, tous les tissus sont capables de dégrader les acides gras par b–oxydation. Le
métabolisme des acides gras dans le foie est particulièrement important.
Lorsque la concentration plasmatique en acides gras est élevé (au cours du jeûn
ou alors d’un diabète), il y a principalement formation de corps cétoniques.
Ø Dégradation
des acides gras : b–oxydation :
Les acides gras sont
activés avant d’être dégradés. Les acides gras doivent être activés sous forme
d’acyl_CoA (réaction qui nécessite de l’ATP) avant de réagir avec l’enzyme
responsable de leur dégradation. C’est la seule étape de dégradation qui
nécessite de l’énergie.

La
dégradation des acides gras se fait dans les mitochondries : la carnitine sert de transporteurs d’acides gras à
travers la membrane (extérieur–intérieur) La carnitine est le produit à partir
de la lysine et métabolisé dans le foie et les reins.
Cette dégradation
d’acide gras s’effectue par un cycle de réactions d’oxydation au cours desquels
seront clivés des unités en
" D’où le nom de b–oxydation.
Ce cycle est relié à la
chaîne respiratoire et au cycle de Krebs. Les molécules à 2 carbones formées
sont des acétyl_CoA. Ainsi, une molécule de palmityl_CoA fournit 8 molécules
d’acétyl_CoA.
Plusieurs enzymes sont
dénommées « acides gras oxydases ».
La 1ère étape de la b–oxydation est la déshydratation de l’acide
gras activé en acide gras possédant une double liaison trans : 2 atomes
d’hydrogènes portés par C2 (a) et C3 (b) sont éliminés. Cette
réaction est catalysée par l’acétyl_CoA déshydrogénase.
Il en résulte la formation de D2
transénoyl_CoA.
Les hydrogènes sont transférés à une protéine contenant du FAD. Ce dernier est
réoxygéné via la chaîne respiratoire.
Dans la 2ème étape, de l’eau est
ajoutée pour saturer la double liaison. Cette réaction est catalysée par l’acétyl_CoA
déshydrogénase. La production formée est le 3_hydroxyacyl_CoA.
Dans la 3ème étape, le dérivé
3_hydroxy– subit une déshydratation du C3 pour former de 3_cétoacyl_CoA. Dans
ce cas, le NAD (qui est le coenzyme) est impliqué dans la déshydrogénation,
puis aboutit à la chaîne respiratoire.
Dans la 4ème étape, les 3_acétyl_CoA
est clivé en position 2–3 par une thiolase qui
catalyse la 2ème hydrolyse thiolyticine, impliquant une autre
molécule de CoA.
Les produits formés sont
l’acétyl_CoA et un dérivé acyl_CoA possédant 2 carbones de moins que la
molécule d’origine. L’acétyl_CoA peut être oxydé en CO2 et H2O dans le cycle de
Krebs, ou en cas d’excès il sert à la synthèse de corps cétoniques.




![]()

Ø L’oxydation
des acides gras produit de grandes quantités d’énergie :
Exemple : palmitate C16 : 0 " b–oxydation (7 fois le
cycle)
La chaîne
respiratoire, transport des électrons du FADH2 et NADH conduit à la
production de 5 liaisons è de haute énergie.
Pour le palmitate :
7 x 5 = 35. Pour le palmitate, un total de 8 molécules d’acétyl_CoA est formé.
Une molécule d’acétyl_CoA donne 12 ATP dans le cycle de Krebs soit 8 x 12 = 96.
2 ATP sont nécessaires pour l’activation
initiale de l’acide gras.
" Bilan : 35 + 96 – 2
= 129 molécules d’ATP par
molécule de palmitate.
A titre de comparaison : l’oxydation du glucose
(
Le palmitate a 16
carbones : soit 38x16/6 = 101 ATP
" ~80% du rendement
énergétique de l’acide palmitique.
L’oxydation des acides
gras à nombre impair de carbones conduit à la formation d’acétyl_CoA et propionyl_CoA
(
Ø Régulation
de la dégradation des acides gras :
Le pool
d’acides gras libres provient de la lipolyse. Les tissus utilisent ce pool
d’acides gras plasmatique. Après l’activation en acyl_CoA, ils sont stockés ou
dégradés.
Le stockage se fait sous forme de triglycérides et de
phospholipides qui constituent les réserves énergétiques. Le foie peut
également libéré ces acides gras sous forme de lipoprotéines.
La
dégradation
se fait dans les mitochondries (avec la nécessité d’une navette carnitine) Les
acides gras entrent dans la b–oxydation, qui est conjugué au cycle de
Krebs et la chaîne de respiration. Ce processus permet une grande production
d’ATP. Dans le foie, les mitochondries peuvent produire les corps cétoniques.
La vitesse de
dégradation des acides gras va dépendre de leur transport dans les
mitochondries dont la 1ère étape est catalysée par une transférase,
la carnityl_acyltransférase. L’activité de
cette enzyme (localisée dans la membrane externe) est élevée lorsque
l’organisme « a faim » et que le niveau plasmatique d’acides gras est
élevé et que le niveau plasmatique de glucagon est élevé.
En cas de satiété, la
transférase est inhibée par le malonyl_CoA qui s’accumule au cours de la
lipogenèse. A la suite d’une baisse du transport les acides gras vers les
mitochondries, la b–oxydation est diminuée. Simultanément,
la lipogenèse est stimulée car l’enzyme limitante, l’acétyl_CoA
carboxylase, est elle–même stimulée.
Cette enzyme sera
inhibée en cas d’accumulation des acétyl_CoA, par exemple : si
l’estérification des acides gras avec le glycérol ne se fait pas assez
rapidement.
Dans les mitochondries
hépatiques, il existe un choix possible entre la cétogenèse et l’oxydation
complète de l’acétyl_CoA en CO2 via le cycle de Krebs
et la chaîne respiratoire. La vitesse de ces 2 voies dépend surtout du besoin
énergétique de la cellule. Tout acétyl_CoA superflu participe à la formation de
corps cétoniques.
Les 3
étapes sont cruciales dans la régulation de la cétogenèse :
Lipolyse :
Tissu adipeux " Acides gras libres " Mitochondrie
" [acétyl_CoA]
Ø Voies
secondaires de dégradation des acides gras :
L’a et l’w oxydation : Elles
sont moins importantes sur le plan quantitatif.
L’a oxydation :
Elle permet la
dégradation des acides gras ramifiés. Elle se déroule par élimination
successive de résidus en
L’w oxydation :
C’est une voie très
mineure (pour les acides gras à chaîne courte) Elle est déclenchée par une
hydroxylation par l’enzyme dépendant du Cyt P450 dans le réticulum
endoplasmique. Le groupe w (CH3) est transformé en CH2–OH puis est oxydé en
COOH, ce qui consiste en la formation d’un acide décarboxilique. Celui–ci est
dégradé des 2 cotés par b–oxydation jusqu’à produire des acides en
C6 et C8 qui sont ensuite éliminés dans les urines.
L’oxydation des acides gras à longue chaîne dans
les peroxysomes :
Les
peroxysomes sont des organites intracellulaires qui ressemblent aux lysosomes
qui contiennent beaucoup d’enzymes. Les peroxysomes hépatiques sont spécialisés
dans la dégradation des acides gras à longue chaîne (C>20)
Cette dégradation conduit
à la formation d’acétyl_CoA et d’H2O2 (à partir d’une déshydrogénase à FAD) qui est ensuite scindé par une
catalase en H2O. Elle ne nécessite pas d’ATP.
L’oxydation des acides gras polyinsaturés :
Elle a lieu souvent une
voie modifiée de la b–oxydation. En général, la 1ère
double liaison est en cis_D9, la b–oxydation peut donc se
faire comme pour un acide gras saturé jusqu’à ce point. Puis, il y a la
nécessité d’une étape d’isomérisation pour que la double liaison apparaisse en
trans comme dans le cycle de la b–oxydation.
L’oxydation radiculaire :
Il existe 2 types :
une peroxydation enzymatique et une peroxydation non enzymatique.
Ø Peroxydation
enzymatique :
Certains
acides gras en C20 dont le 20 : 4 n–6 (acide arachidonique) et le
20 : 5 n–3 (EPA) peuvent former par peroxydation les eicosanoïdes :
-
Les
lipoxines (LX),
-
Les
leucotriènes (LT),
-
Les
prostanoïdes : prostaglandines (PG), prostacylclines (PGi), tromboxanes
(TX)
Physiologiquement, ces
composés sont considérés comme des hormones fonctionnant via les récepteurs
liés aux protéines G pour déclencher leur effets biologiques.
Les prostaglandines :
Présentes dans tous les
tissus, elles ont des activités physiologiques et pharmacologiques importantes.
Elles sont synthétisées in vivo par
cyclisation du centre de la chaîne carbonée des acides gras polyinsaturés à
Les thromboxanes :
Elles ont été
découvertes dans les plaquettes. L’anneau cyclopentane est interrompue par un
atome d’O2 (cycle oxane)
Les leucatriènes :
Ils sont formés via la
voie de lipoxygénase plutôt que par cyclisation de la chaîne d’acides gras, ils
se caractérisent par la présence de 3 ou 4 doubles liaisons conjuguées.
3 acides gras eicosanoïques donnent naissance à
3 groupes d’eicosanoïdes caractérisés par le nombre de doubles liaisons dans la
chaîne latérale. Exemple : PG1, PG2, PG3.
Selon les groupes substituant
attachés aux cycles, cela donne les différents types dans chaque séries de PG
ou TX dénommés A, B, …
Exemple : Le type E de PG (comme dans

![]() Le 20 : 4 n–6 est à
l’origine des eicosanoïdes :
Le 20 : 4 n–6 est à
l’origine des eicosanoïdes :
-
Groupe
2
De
série 2 pour les PG et les TX : PGD2, PGE2, PGF2, PGI2, TXA2.
-
De
série 4 pour les leucotriènes : LTA4, LTB4, LTC4, LTD4, LTE4.
![]() Le 20 : 5 n–3 est à
l’origine des eicosanoïdes :
Le 20 : 5 n–3 est à
l’origine des eicosanoïdes :
-
Groupe
3
De
série 3 pour les PG et les TX : PGD3, PGE3, PGF3, PGI3.
-
De
série 5 pour les leucotriènes : LTA5, LTB5, LTC5.
![]() Le linoléate perd 2
hydrogènes et donne g_linoléate qui donne le
dihémo_g_linoléate. Ce dernier
donne :
Le linoléate perd 2
hydrogènes et donne g_linoléate qui donne le
dihémo_g_linoléate. Ce dernier
donne :
-
Groupe
1
La
série 1 pour les PG et les TX : PGE1, PGF1, TXA1.
-
La
série 3 pour les leucotriènes : LTA3, LTC3, LTD3.
L’acide arachidonique :
En général, la position
2 au niveau des phospholipides de membrane plasmatique est libérée suite à
l’action de la phospholipase A2. Il est alors le
substrat pour la synthèse des PG2, TX2 et LT4 mais via des voies
métaboliques différentes.
Ces 2 voies sont connues
sous les noms de voie de la cyclo–oxygénase ou voie de la lipoxygénase.
Activité de la cycloxygénase :
La synthèse des
prostanoïdes implique la consommation de 2 molécules O2 catalysée par la prostaglandine synthase (PGHS)
Le produit de la voie de
la cyclo–oxygénase est une endoperoxyde (PGH)

Les PG
sont des molécules pro–inflammatoires. L’aspirine inhibe l’activité
inflammatoire en inhibant
La synthèse de PG a lieu
surtout au niveau des cellules endothéliales.
La synthèse de TX a lieu
surtout au niveau des plaquettes.
Ø Activités
métaboliques des protanoïdes :
Les prostaglandines :
Elles ont
plusieurs fonctions similaires à des hormones. Elles sont impliquées dans la
régulation de la contraction musculaire (en partie des muscles lisses)
Exemple : le muscle utérin, s’il y a la nécessité de déclencher
l’accouchement, il suffit d’injecter de la prostaglandine.
Au niveau
des organes reproducteurs, les prostaglandines ont été initialement isolées dans
le liquide séminal. Elles régulent les niveaux d’eau et d’électrolytes et font
augmenter l’excrétion urinaire du Na+ et du K+.
-
PGE
et PGA sont de puissants vasodilatateurs.
-
PGE1, PGI2, PGD2 inhibent l’agrégation
plaquette. Effets pro–inflammatoires.
Elles sont
libérées dans le cerveau à la suite d’une stimulation nerveuse. Elles modulent
l’expression des gènes impliqués dans l’oncogenèse. Elles ont des activités
antitumorales et antivirales.
Elles présentent des
diversités d’actions physiologiques et offrent donc des espoirs pour des
applications thérapeutiques, mais… …ces applications restent encore aujourd’hui
limitées.
Les thromboxanes :
TXA2 est un puissant agent
d’agrégation plaquettaire. C’est un ionophore calcique :
le Ca2+ favorise des coagulations sanguines. Le taux
PGI2/TXA2 est important pour la
coagulation sanguine.
Les acides gras
polyinsaturés de la série n–3 permettent la formation des PGI3 et TXA3. Ils font baisser
l’agrégation plaquettaire et augmenter la fluidité sanguine.
La voie de la lipo–oxygénase :
Les
leucotriènes sont transformés à partir des acides eicosanoïques dans les
leucocytes, les mastocytes, les plaquettes et macrophages via la voie de la
lipo–oxygénase, ceci en réponse à des stimuli immunologiques.
Il existe 3 lipo–oxygénases différentes (dioxygénases) insèrent
de l’O2 au niveau du C5, C12 et C15 de l’acide
arachidonique pour former des hydroxyperoxydes
(HPETE = HydroxyPeroxyEicosaTétraEnoïque)
Seule la 5_lipoxygénase conduit à la synthèse de leucotrières.
Actions biologiques des leucotriènes :
Les leucotriènes
augmentent la perméabilité vasculaire et favorisent l’attraction (chimiostatique)
et activent les leucocytes. Leur régulation, dans un cas pathologique, implique
des réactions d’hypersensibilité immédiates comme l’asthme.
Ce sont des puissants
constricteurs de la musculature du pharynx. Ce sont également des modulateurs
de la communication cellulaire.
Peroxydation non enzymatique :
La lipoperoxydation non
enzymatique :
Elle
concerne les acides gras très insaturés. Elle peut conduire à une disrégulation
du métabolisme oxydatif et est à l’origine ou impliqué dans un certain nombre
de pathologie (diabète, athérosclérose, cancer, ischémie, inflammation,
rhumatoïdes, vieillissement physiologique et mort cellulaire.
La longévité d’un
organisme serait dépendante de l’intensité de cette voie.
Dégradations des acides
gras par les radicaux libres :
Un radical libre est une
molécule qui possède un électron non apparié (on le note souvent sous la forme
RŸ)
Les radicaux libres ont le plus d’importance en biosynthèse. Ils sont très
instables. RLO = Radicaux Libres Oxydés
|
Formules |
Dénomination |
Stabilité |
|
O2 |
Oxygène moléculaire |
Stable |
|
O2Ÿ |
Ion peroxyde |
Instable |
|
HOOH (H2O2) |
Peroxyde d’hydrogène (eau oxygénée) |
Instable |
|
OHŸ |
Radical hydroxyde |
Très instable |
|
OŸ |
Oxygène singulet |
Le plus stable |
L’oxygène est un élément vital, mais il peut avoir
également un effet toxique.
Exemple : Si on soumet des cultures de
cellules à des taux d’O2 supérieurs à la normale, la cytotoxicité
y est directement corrélée.
Autres observation in vivo : la réanimation conduit à un apport riche en O2 à l’organisme qui peut
induire des dysfonctionnements cellulaires, dont la dégénérescence des
neurones.
Des rats soumis à un
régime hypercalorique ont un métabolisme de base élevé et ont des durées de vie
plus courtes. Il existe une relation entre l’intensité métabolique énergétique
et durée de vie des axones.
Ø Structure
impliquée dans ces dysfonctionnements :
Certains RLO sont
produits par l’organisme de façon continue et se défendre. Par exemple, les
macrophages produisent O2Ÿ– (superoxyde) via un
complexe protéique : le NADPH–oxydase. L’O2Ÿ– est généré en
transférant un électron du NADPH pour donner de l’O2. L’O2Ÿ– peut produire des
oxydants très puissants tels que le H2O2 pour détruire les
pathogènes (bactéries)
Normalement,
les radicaux libres qui sont produits par réduction monovalence de l’O2 au niveau de la chaîne
respiratoire, n’excédant pas 5% et les substrats formés sont captés par des
piégeurs physiologiques.
Cependant, avec la
vieillesse ou la maladie, l’équilibre peut être rompu et entraîne un
dérèglement de la destruction des radicaux libres. La production d’O2Ÿ– est favorisée par les
UV solaires. Les UV les plus dangereux sont ceux aux plus faibles longueurs
d’onde.
La toxicité des radicaux
libres n’est pas due aux anions O2Ÿ– car ils sont instables
et se transforment dans la réaction de Fenton.
Dismutation oxydative : O2Ÿ– + O2Ÿ– " H2O2 + O2
Réaction de
Fenton : H2O2 + Fe2+ " OHŸ + HO– + Fe3+
Radicaux
hydroxyles très toxiques
Ø Il existe
des piégeurs de radicaux libres :
Système enzymatique : (présents au sein de la cellule)
-
Superoxyde dismutase (= SOD),
-
La
catalase,
-
La
glutathion peroxydase.
Système non enzymatique : (= antioxydants)
-
Vitamine
E, vitamine C, vitamine A,
-
L’acide
urique,
-
Les
flavanoïdes (polyphénols)
Ø Les
systèmes enzymatiques :
Ces systèmes vont
empêcher la formation d’OHŸ, espèce la plus
réductive non détoxifiable par enzyme par l’enzyme (durée de vie du OHŸ = 10–9 sec)
Les SOD : superoxyde dismutase :
Elles
protègent de l’anion superoxyde O2Ÿ–. La réaction de
dismutation correspond à une oxydoréduction entre 2 molécules de même nature
est catalysée par
-
Il
existe des SOD cytosoliques : Cu–Zn SOD.
-
Il
existe des SOD mitochondries : Mn–SOD.
Les enzymes sont décrites dans tous les tissus.
L’ensemble des enzymes qui protègent de l’H2O2.
Les catalases :
Ce sont des
hétéroprotéines constituées de 4 sous–unités, contenant 4 atomes de Fer
chacune. Elles sont localisées dans les peroxysomes.
Quand il y a un
déséquilibre entre la production d’O2Ÿ– et le système de
protection de SOD et la catalase, cela entraîne une hausse de H2O2 qui entre dans la
réaction de Fenton (qui résulte d’OH• initiateur de la
lipoperoxydation)
v Les glutathions peroxydases :
Ils
prennent le relais de la catalase.
Peroxydases
H2O2 + 2GSH
" GSSG +
(ROH + H2O)
Endoperoxydases ROOH
Glutathion Glutathion 2
H2O
réduit oxydé


Ce sont des
métallo–enzymes (Sélémium métal) qui sont présentes au niveau du cytosol et les
mitochondries.
Le 1er facteur limitant
de l’activité des enzymes est la concentration cellulaire des corps cétoniques
de ces systèmes. La répartition de ces systèmes dépend des tissus. Le foie
contient les activités des glutathion peroxydases
(GPX) et catalase les plus élevées.
Remarque : Au niveau du cerveau, la catalase et
Mais l’activité
métabolique du cerveau ne produit pas de radicaux libres. En revanche, en
réponse à une occlusion temporaire des vaisseaux (ischémies cérébrale) entraîne
la hausse de production des radicaux libres et une hausse des lipoperoxydes.
Le 2nd facteur limitant
est l’évolution de la production de ces systèmes qui baisse avec le glucose.
Le 3ème facteur limitant
est la biodisponibilité en glutathion réduit.
Tous ces systèmes des
métallo–enzymes présentent ces métaux Zn, Cu, Mn (oligoéléments) qui sont
nécessaires pour le bon fonctionnement du système de production. Une carence en
ces éléments entraîne le vieillissement et la déshydratation.
Ø Les
systèmes de protection non enzymatique :
La vitamine E (= a_tocophénol) est un
antioxydant, anti ROOŸ (peroxyde)

ROOŸ + vit E –OH " ROOH + vit E –OŸ
Radical peroxyde vitamine
E sous forme radicataire
GSH + vit E –OŸ " GSŸ + vit E –OH " GSSG
+ vit
E –OH
Glutathion réduit Glutathion
oxydé
L’effet antioxydant de la vitamine E est lié en partie à sa
localisation cellulaire. La structure moléculaire se la vitamine E se rapproche
de celle du cholestérol. La vitamine E s’intègre dans les membranes cellulaires
et se trouve ainsi en contact avec les substrats acides gras polyinsaturés.
L’activité antioxydante
de la vitamine E consiste en une stabilisation des radicaux peroxydes ROOŸ qui se transforme en
peroxyde secondaires dégradés par

La vitamine E –OŸ est instable. Elle réagit directement avec le GSH. En 2ème
possibilité, elle agit en synergie avec la vitamine C (= acide ascorbique) qui
est hydrosoluble et cytosolique. Elle régénère vitamine E.
La vitamine C (sous forme d’ascorbate) est un
antioxydant majeur pour les anions superoxydes O2Ÿ–.
Ascorbate
+ O2Ÿ– " semidehydroascorbate + H2O
Ascorbate
+ GSSG ! dehydroascorbate
Mécanisme de protection :
Quand il y a une
déséquilibre entre production d’O2Ÿ– et les systèmes de
protection, il y a une augmentation du H2O2, donc de OHŸ. Cela entraîne de la
lipoperoxydation.
Pour qu’un
acide gras soit dégradé sous forme radicalaire, il faut au moins 2 doubles
liaisons. La position de la double liaison aura une incidence sur la
susceptibilité de la double liaison. Les acides gras de série n–6 sont plus
susceptibles à la liaison que les acides gras série n–9 à nombre de carbones et
de doubles liaisons équivalentes. Les acides gras polyinsaturés sont présents
au niveau de la membrane plasmatique et entraînent des dommages dans la
membrane, causant la mort de la cellule.
La liaison résulte de 3
phases : Initiation, Propagation, Terminaison.
Ø Initiation :
A cause des doubles
liaisons qui les entourent, les groupements CH2 des acides gras
polyinsaturés peuvent être objets de rupture homolytique et d’abstraction de
radicaux hydrogènes pas des espèces radicalaires.
j La molécule d’acide
gras devient à son tour radiculaire, ce qui entraîne une réorganisation des
doubles liaisons sous une forme conjuguée (= diène
conjugué)
LH + RŸ " LŸ + RH RŸ = radical libre
k En condition aérobie (O2), le diène conjugué
réagit avec l’O2 moléculaire pour donner le radical peroxyl très réactif.
LŸ + O2 " LOOŸ LH
= acide gras polyinsaturé
Ø Propagation :
Le radical
peroxyde ROOŸ est très réactif. Il
réagit avec les acides gras voisins en captant les radicaux hydrogènes.
LOOŸ +
L’H " LOOH
+ L’Ÿ L’H = acide gras différent de LH
La
réaction de propagation est facilitée par la proximité des acides gras dans la
structure membranaire.
L’hydroperoxyde
formé est une molécule non radicalaire et peu réactionnelle si le milieu ne
contient pas de traces de … de transition. Or dans les milieux biologiques, il
existe toujours des traces de fer qui déclenchent la dégradation des
hydroperoxydes en de nouvelles espèces radiculaires.
" La chaîne de lipoperoxydation est non
seulement propagée mais aussi amplifiée.
Ø Terminaison :
Elle se produit lorsque
2 molécules radiculaires de même nature ou non réagissent entre–elles. Il y a
la création de liaison covalente qui les stabilise.
Par exemple : LŸ + LŸ
"
LL
LOOŸ + LŸ
"
LOOL
LOOŸ
+ LOOŸ " LOOL + O2

Ø Catabolites
de la lipoperoxydation :
La nature des produits
de dégradation dépend de l’acide gras dégradé et/ou du système pro–oxydant qui
a initié la lipoperoxydation.
Il existe une
multiplicité de substrat avec une prédominance des aldéhydes dont le malondialdéhyde : MDA (CHO–CH2–CHO) Il constitue un
index du …
Donc en plus :
-
Hydroperoxydes,
-
Diènes
conjugués,
-
Aldéhydes
dont le MDA, 4HNE (hydroxynonemal : catabolite des acides gras
polyinsaturés n–6), 4HNE (4_hydroxyhexenal : catabolite des acides gras
polyinsaturés n–3)
-
Cétones
(acétone),
-
Hydrocarbures
volatiles (éthano–pentane)
Au cours du
vieillissement, il est observé l’accumulement de pigments dénommés lipofuscines dans des granules contenant des résidus
de lipides peroxydés et de protéines. Ces lipofuscines présentent la même
propriété … que les complexes MDA–protéines.
Au cours du
vieillissement, les structures cellulaires subissent des dommages oxydatifs,
elles sont phagocytées et dégradées sous forme de lipofuscines. Il existe sur
les macrophages des récepteurs qui reconnaissent les formes modifiées.
Par exemple : LDLOX " Cellule spumeuse " Athérosclérose
Ø Régulation
de la lipogénoxydation :
Régulation de l’initiation : C’est le nombre d’acides gras qui subiront la
lipogénoxydation. Elle est liée à l’équilibre entre la production des radicaux
libres et la synthèse de protection (OHŸ)
Régulation de la propagation : Le radical peroxyde ROOŸ réagit avec un autre
acide gras. La vitamine E (antioxydant naturel) contrôle la propagation.
Régulation de la terminaison : C’est la formation de peroxyde ou endoperoxyde.
Le système est une GPX spécialisée de la dégradation des peroxydes.
Les protéines mais aussi
les acides nucléiques peuvent être également des cibles directes des radicaux
libres. Un grand nombre de pathologies est lié aux radicaux libres.