
Retour au sommaire des cours |

Une version pdf est à votre disposition ici. |
v Nécessité dun contrôle des
voies métaboliques :
Une voie
métabolique est une réaction en chaîne : le produit dune réaction devient
le substrat dune suivante. Il faut donc un contrôle fin.
De plus, les
voies métaboliques cellulaires sont interconnectées : elles doivent
fonctionner de façon coordonnée.
Pour y parvenir,
il y a la mise en place de :
-
Régulations
internes à chaque voie,
-
Régulations
entre les voies métaboliques,
-
Régulations
dépendantes de létat physiologique de lorganisme.
Mais il est
inutile de contrôler toutes les activités enzymatiques. La régulation la plus
importante à contrôler est la réaction la plus lente ; ainsi on contrôle
le débit métabolique.
Ce contrôle
seffectue donc sur des enzymes clés, appelées enzymes allostériques, qui se
situent souvent après un carrefour métabolique.
" Ces enzymes
clés catalysent des réactions irréversibles.
Ladaptabilité
des voies métaboliques se fait grâce à un certain nombre de mécanismes
régulateurs (à court et à long terme)
v Les différents niveaux de
régulation :
.Poly
p 1.
Ø Perméabilité
membranaire :
§ Transport passif à travers
une membrane :
Il se fait en
fonction du gradient de concentration et ne nécessite pas de protéines de
transport.
 Flux
Flux
(Vitesse de
passage Semi
perméable
par unité de
surface)
Le
transport passif est insaturable.
Gradient
de concentration
Exemple de
molécules utilisant ce transport : les stéroïdes.
§ Transport facilité (ou
exergonique) :
Il se fait
toujours en fonction du gradient de concentration et mais nécessite un
transporteur pour facilité le transport.
 Flux
Flux
(Vitesse de
passage Semi
perméable
par unité de
surface)
Gradient
de concentration
Le transport facilité est saturable. Les
protéines transporteurs se comportent comme des enzymes : les sites de
fixation peuvent tous être saturés.
Exemple déléments utilisant ce
transport : les ions, nucléotides, acides aminés et métabolites.
ê Attention !
Ne pas confondre avec le transport actif. Ce dernier est un
transport qui se fait contre le gradient de concentration ; cest donc un
processus endergonique.
Les différents types de transport
facilités :
Leur
classification se fait selon la stoechiométrie du processus :
-
Uniport,
-
Symport,
-
Antiport.
Ø Disponibilité
en substrat et coenzymes :
Il sagit dune
régulation indirecte qui permet la disponibilité des éléments de la réaction.
Ø Régulateurs
exogènes du métabolisme cellulaire :
Les agents
sont :
-
Les
hormones (présentes dans la circulation),
-
Les
facteurs de croissance (action locale, produits par les cellules proches),
-
Les
cytokinines (dans le processus antiinflammatoire, même mécanisme que les
facteurs de croissance),
-
Les
médiateurs nerveux.
§ Les régulateurs hormonaux de
lhoméostasie glucidique :
-
Insuline,
sécrétée par les cellules b des îlots de Langerhans
pancréatiques ;
-
IGFI,
glucocorticoïde sécrété par le cortex surrénalien (= couche externe de la
glande surrénale) ;
-
Glucagon,
sécrété par les cellules a des îlots de Langerhans
pancréatiques ;
-
Adrénaline
(ou épinéphrine), catécholamine sécrétée par la médulla surrénalienne (= partie
intérieure de la glande surrénale) ;
Catécholamine = Adrénaline (ou épinéphrine) &
Noradrénaline (ou norépinéphrine)
-
Hormone
de croissance (GH), sécrétée par lhypophyse antérieure, rôle important dans la
mobilisation des voies du métabolisme glucidique.
§ Régulation hormonale de la
glycémie :
|
Hormone |
Action |
|
|
Insuline |
(
Glucose |
Hormone
hypoglycémiante |
|
Glucocorticoïdes |
& Glucose |
Hormones hyperglycémiantes |
|
Glucagon |
& Glucose |
|
|
Hormone de
croissance |
& Glucose |
|
|
Adrénaline |
& Glucose |
|
Les cibles
tissulaires principales : le foie,
les muscles squelettiques et le tissu adipeux.
La sensibilité
de la cellule aux agents de régulation est fonction de sa disponibilité en
récepteurs à ceuxci.
§ Transmission de linformation
de lextérieur vers lintérieur de la cellule :
Hormone

![]() Récepteur
Récepteur
Transducteur (par exemple : protéine G)
![]() Effecteur
(par exemple :
Adénylate cyclase)
Effecteur
(par exemple :
Adénylate cyclase)
ATP "
Activité enzymatique
Messager
secondaire
ou
2nd messager (exemple :
AMPc)
![]()
Apport des informations
dans la cellule par ActivationStimulation
de :
Protéine
kinase A (activée)
$
Phosphorylation de protéines
$
Modification
dactivité
$
Effets
biologiques
La transduction
du signal hormonal à travers la membrane plasmique induit une cascade
dévènements intracellulaires qui servent à amplifier le signal et à le
distribuer aux différents compartiments cellulaires pour modifier plusieurs
fonctions cellulaires en parallèle.
.Poly
p 1.
Les hormones
induisent des réponses cellulaires lentes et rapides.
.Poly
p 1.
·
Voie
de signalisation de ladrénaline :
.Poly
p 2.
Fixation
de lhormone sur le récepteur
$
Changement
conformationnel
$
Communication
de ce changement à la protéine G
= hétérotrimère à activité ATPasique
$
Perte de
conformation
$
Activation
de ladrénylate cyclase
$
Synthèse
en grande quantité dAMPc à partir de lATP
$
Activation
de la protéine kinase A par lAMPc
+
Hydrolyse
de la partie GTP de la sousunité a par les
propriétés intrinsèques de celleci
" Verrou de sécurité évitant une situation permanente
Activation de la protéine kinase A par
lAMPc :
.Poly
p 2.
Sousunité
régulatrice
Sousunité catalytique
![]()
Séquence
« Pseudosubstrat »
AMPc
Fixation
de lAMPc
$
Changement
conformationnel
au niveau du la
séquence « Pseudosubstrat »
$
Libération
de la sousunité catalytique

" Phosphorylation de protéines sur la séquence peptique :
Arg
Arg quelconque Ser ou Thr
La
phosphorylation se fait sur le dernier acide aminé de cette séquence (Ser ou
Thr).
" Cette protéine kinase A est donc appelée
Ser_Thr kinase.
Au final, la
sousunité catalytique est libérée.
·
Voie
de signalisation de linsuline :
Il y a une
réponse dimérisée reliée par un pont disulfure :

ß
Activité de
ß
Phosphorylation
de
Et
Cascade de
déphosphorylation
ß
Activités
phosphoasique et kinasique altérées
ß
Effets
biologiques terminaux :
-
Synthèse
de glucose, de protéines, lipides, glycogène ;
-
Croissance
et transport ;
-
Synthèse
de lexpression des gènes.
·
Les
stéroïdes :
Il nexiste que
des récepteurs intracellulaires.
Une fois que
lhormone est fixée, il intègre le noyau de la cellule et active un certain
nombre dexpressions de gènes (transcription)
Ø Régulation
du nombre de molécules enzymatique actives :
Transcription Traduction Régulation postsynaptique
ADN ARN Enzyme
(épissage
alternatif " Isoenzymes)
 Dégradation
Dégradation
·
Régulation
par phosphorylationdéphosphorylation,
·
Transition
allostérique,
" Les plus
importantes.
·
Activation
par protéolyse limitée
" Suppression du précurseur protéique,
·
Régulation
par combinaison des sousunités.
§ Contrôle
transcriptionnel :
Le contrôle se
fait sur la vitesse de la transcription et sur la stabilité de lARN.
·
Isoenzymes
:
Elles diffèrent
dans leurs séquences peptidiques mais catalysent la même réaction.
Elles possèdent
des cinétiques enzymatiques différentes et/ou
ont des affinités différentes visàvis du substrat et/ou sont régulées de manières différentes.
Lutilisation
différentielle de ces isoenzymes permet une régulation fine du métabolisme
adaptée à chaque organe ou tissu cellulaire.
Exemple : la lactate
déshydrogénase :
Cest une
protéine tétramérique possédant 2 types de sousunités (avec 75%
dhomologie) : une appelée H
(Heart) et une autre appelée M (Muscle)
Il existe
différentes combinaisons possibles : H4 ; H3M ; H2M2 ; HM3 ; M4
(cur) (foie)
-
H4 a une forte
affinité pour le pyruvate et est inhibée allostériquement par des
concentrations élevées de pyruvate.
" Dans le cur, la glycolyse est importante,
donc H4 nest quasiment pas active.
-
M4 a une faible
affinité pour le pyruvate mais elle nest pas inhibée.
" La sousunité M prédomine dans les tissus
supportant les conditions anaérobies (muscle, foie) alors que la sousunité H
prédomine dans les tissus aérobies.
Intérêt des isoenzymes :
-
Obtenir
des profils métaboliques différents des différents organes.
Exemple : Les 2 isoformes de la phosphorylase du
glycogène présentes dans les muscles et le foie possèdent des régulateurs
différents.
-
Assurer
des localisations subcellulaires différentes et donc des rôles métaboliques
différents dans la cellule.
Exemple : Lisocitrate déshydrogénase.
-
Adapter
les activités enzymatiques aux différentes étapes du développement.
Exemple : Les tissus embryonnaires et ftaux sont
différents des tissus adultes ;
Les cellules cancéreuses
sont différentes des cellules normales.
-
Assurer
des réponses différentes (suivant les organes) aux effecteurs
allostériques :
Exemple : La glucokinase hépatique et les
hexokinases extrahépatiques ont des sensibilités différentes à linhibition
par le glucose_6è.
§ Contrôle traductionnel :
Il se fait sur
la vitesse de traduction et sur la ½ vie de la protéine.
§ Contrôle
posttraductionnel :
·
Régulation
allostérique :
Exemple denzyme allostérique : Laspartate
transcarboxylase (ATCase) :
Elle catalyse la
1ère étape de la voie de synthèse des bases pyrimidiques :
![]()
![]()
![]() Carbamoylè
+ Aspartate N_Carbamoylaspartate Cytidine_Triè
Carbamoylè
+ Aspartate N_Carbamoylaspartate Cytidine_Triè
Sa cinétique est
non mickaellienne : la courbe a une allure sigmoïdale (et non
hyperbolique)
 Taux de
formation
Taux de
formation
de
N_Carbamoylaspartate
[ Aspartate ] en
mM
10 20 30 40
Cette cinétique
est due à la structure polymérique : 6
sousunités catalytiques
+ 6
sousunités régulatrices
LATCase oscille
entre 2 états conformationnels :
-
Un
état R (relâché) possédant une forte affinité pour le substrat (Km faible),
-
Un
état T (tendu) possédant une faible affinité pour le substrat (Km élevé)
Létat
R présente une dilatation de la conformation permettant un meilleur accès pour
les sites de réaction.
Le passage dun
état conformationnel à lautre sappelle la transition allostérique.
Il
existe 2 modèles de transition allostérique :
-
Un
modèle dit concerté, dans lequel la
liaison de leffecteur allostérique modifie la conformation de toutes les
sousunités (cest le cas de lATCase),
-
Un
modèle dit séquentiel, pour lequel
il existe des états intermédiaires où certaines sousunités sont sous la forme
R et dautres sous la forme T.
 Taux de
formation
Etat R
Taux de
formation
Etat R
de
N_Carbamoylaspartate si toutes les enzymes restaient dans létat R
Courbe
réelle
Etat
T
si toutes les enzymes restaient dans létat T
[ Aspartate ]
10
20 30 40
La courbe
sigmoïde typique de lenzyme allostérique est une combinaison des courbes de
lenzyme à létat R (forte affinité pour le substrat) et de lenzyme à létat T
(faible affinité pour le substrat)
Régulation allostérique de lactivité
enzymatique (modèle concerté) :

Inhibiteur
Forme R
(état
catalytique)
Substrat Affinité plus
importante
pour les
activateurs
![]()
![]()
Activateur Equilibre tenu par
les concentrations
des effecteurs
activateurs
et inhibiteurs
Forme T (état
inhibé)
Affinité
plus importante
pour les inhibiteurs
Leffecteur
allostérique peutêtre :
-
Homotrope :
il modifie sa propre affinité visàvis de lenzyme. Cest le cas du substrat.
-
Hétérotrophe :
il modifie laffinité dune autre molécule, en général le substrat, visàvis
de lenzyme.
-
Si
leffecteur déplace léquilibre conformationnel de lenzyme vers la forme R, il
est dit activateur.
-
Si
leffecteur déplace léquilibre conformationnel de lenzyme vers la forme T, il
est dit inhibiteur.
Pour lATCase :
-
Laspartate
(substrat) est un activateur allostérique homotrope,
-
LATP
est un activateur allostérique hétérotrope,
-
Le
CTP est un inhibiteur allostérique hétérotrope.
 Taux de
formation + 2mM
dATP
Etat R
Taux de
formation + 2mM
dATP
Etat R
de
N_Carbamoylaspartate
Courbe
réelle
(
Km ; &
affinité
(
Km ; &
affinité Etat
T
+
[ Aspartate ]
10
20 30 40
Intérêt biologique de la régulation
allostérique de lATCase :
-
Rétroinhibition
du CTP sur lATCase :
Elle permet de
freiner la synthèse des bases pyrimidiques et déviter une accumulation de ces
bases quand les conditions propices à la production dARNM et à la
duplication de lADN sont absentes (par exemple : ATP faible)
-
Lactivation par
lATP :
LATP, par ce
mécanisme, va promouvoir la production de lADN quand lénergie et les bases
puriques sont présentes en abondance.
Système K : Affinité de lenzyme pour R > T
Il suppose que
le substrat a plus daffinité apparente pour lune des formes (R) que lautre
(T) : " La constante de Mickaelis de R est inférieure
à celle de T.
" Des sites de T
peuvent aussi fixer le substrat et
-
Le
substrat se comporte comme un effecteur homotrophique ;
-
La
saturation de lenzyme par le substrat nest pas mickaelienne ;
-
La
fixation du substrat par lenzyme est mickaelienne.
 Vitesse Avec activateur Sans effecteur Avec
inhibiteur
Vitesse Avec activateur Sans effecteur Avec
inhibiteur
Vm
[
Aspartate ]
Système V : Même affinité apparente de lenzyme
pour R et T par rapport au substrat mais KCAT de R > KCAT de T
Il suppose que
le substrat a la même affinité apparente pour les formes R et T ; mais
cellesci sont différentes par leur KCAT .
-
La
forme R a
-
Le
substrat ne se comporte pas comme un effecteur allostérique ;
-
La
saturation de lenzyme par le substrat est mickaelienne ;
-
Par
contre, les fixations coopératives des activateurs et inhibiteurs allostériques
ne sont pas mickaelienne.
·
Régulation
par modification covalente :
La liaison dune
molécule à une enzyme peut modifier son activité.
-
La
plus part de ces modifications sont réversibles (phosphorylation, acétylation)
-
Dautres
sont irréversibles (modifications lipidiques permettant la localisation de
lenzyme à la membrane.
¨ Régulation par phosphorylation
déphosphorylation :
Laction de
nombreuses protéines est modifiée par phosphorylation (= addition dun
groupement phosphoryle sur la fonction hydroxyle des résidus Sérine, Thréonine
ou Tyrosine.
Les
phosphorylations sont catalysées par des protéines kinases, ellesmêmes
soumises à régulations.
Dans les
conditions physiologiques, les réactions de phosphorylation sont irréversibles.
Lexistence de phosphatases, elles aussi régulées, assure les réactions de
déphosphorylation.
" Le niveau de
phosphorylation dépend donc des activités relatives des kinases et des
phosphatases.
¨ Spécificité des kinases :
Résidu Sérine
O H
O
![]()
![]() ││
│ ││
││
│ ││
Protéine non phosphorylée C N C C N
│ │
│
H CH2OH H
![]()
![]()
![]()
![]() ATP Pi
ATP Pi
Kinase Phosphatase
ADP H2O
O H
O
![]()
![]() ││ │ ││
││ │ ││
C N C C N
│ │
│
H CH2Oè
H
Résidu Tyrosine
O H
O
![]()
![]() ││ │ ││
││ │ ││
Protéine non phosphorylée C N C C N
│ │
│
H CH2 H
│
![]()
│
OH
![]()
![]()
![]()
![]() ATP Pi
ATP Pi
Kinase Phosphatase
ADP H2O
O H
O
![]()
![]() ││ │ ││
││ │ ││
C N C C N
│ │
│
H CH2 H
│
![]()
│
Oè
Certaines
protéines kinases sont multifonctionnelles et peuvent phosphoryler différentes
protéines cibles. Dautres ne peuvent phosphoryler quune protéine particulière
ou une famille de protéines structurellement proches.
Par exemple :
-
Arg Arg (petit acide aminé comme Gly)
Ser (acide aminé hydrophobe de grande taille)
-
Arg Arg (petit acide aminé comme Gly)
Thr (acide aminé hydrophobe de grande taille)
¨ Sérine Thréonine protéines
phosphatase :
-
Phosphatases de
type 1 (PP1) :
Elles sont
inhibées par 2 protéines cytosoliques thermostables ( I1 et I2)
Elles
déphosphorylent préférentiellement la sousunité b de la
phosphorylase kinase.
-
Phosphatases de
type 2 (PP2) :
Elles sont
insensibles aux 2 protéines cytosoliques thermostables ( I1 et I2)
Elles
déphosphorylent préférentiellement la sousunité a de la
phosphorylase kinase.
Elles ont été
subdivisées selon leurs différences dans les mécanismes dactivation :
-
PP2A
(spontanément actives),
-
PP2B
(dépendantes du Ca2+),
-
PP2C
(dépendantes du Mg2+),
¨ Comment la phosphorylation
modifietelle lactivité enzymatique ?
-
Par laddition de charges négatives,
modifiant les interactions électrostatiques ;
-
Par formation de liaisons H, pouvant
altérer les capacités de liaison de la protéine ;
-
En se comportant comme un effecteur
allostérique, déplaçant léquilibre entre les formes T et R de lenzyme.
Intérêt biologique dune telle
régulation :
-
Mécanisme
rapide,
-
Amplification,
-
Liaison
du mécanisme à létat énergétique de la cellule.
v Les transporteurs du
glucose :
Le transport est
facilité par les transporteurs de glucose : GLUT.
" C'estàdire que le transport se fait dans le
sens de la concentration.
Il existe 5
membres principaux : GLUT_1 à GLUT_2.
Ce sont des
glycoprotéines de 500 acides aminés possédant 12 régions hydrophobes :
" Insertion dans la membrane plasmique par 12
domaines transmembranaires.
Représentation dun GLUT :
y
 Glycosylation pour
protéger des glycoprotéines.
Glycosylation pour
protéger des glycoprotéines.
Ext
Int
NH3+ COO
Dans les
érythrocytes, il y a environ 500 000 molécules de GLUT_1.
La famille des transporteurs de
glucose :
|
Nom |
Localisation
tissulaire |
Km |
Fonction |
|
GLUT_1 |
Erythrocytes, Dans tous les
tissus Faible
concentration dans le foie et les reins |
|
Prélèvement
basal de glucose (minimum vital
pour le glucose) |
|
GLUT_2 |
Cellules b
pancréatiques, Foie |
15 à |
Entrée de
glucose proportionnelle à la glycémie dans le foie et les cellules b pancréatiques |
|
GLUT_3 |
Environ tous
les tissus |
|
Prélèvement
basal (presque même
fonction que GLUT_1) |
|
GLUT_4 |
Cellules
musculaires, Adipocytes |
|
Prélèvement
insulinodépendant du glucose |
|
GLUT_5 |
Intestin grêle |
|
Transporteur
de fructose |
Biocapteurs du taux de glycémie : GLUT_2
 Flux de glucose
Flux de glucose
Flux max
![]() 1 5 10 15 20
1 5 10 15 20
Glycémie normale
GLUT à faible Km : Par exemple
GLUT_1
" Il
a une forte affinité au glucose.
Dans les conditions physiologiques :
il y a une quasisaturation des ces transporteurs.
" Dans le cas dune augmentation de la
glycémie, il ny a aura pas une grande entrée de glucose par ces transporteurs.
GLUT à moyen Km : Par exemple GLUT_4
Il sert à faire entrer du glucose quand
les récepteurs GLUT_1 saturent.
Il est le seul à être stimulé par linsuline
pour le stockage spécifique du glucose dans les cellules musculaires et
adipocytes.
GLUT à fort Km : Par exemple GLUT_2
" Il
a une faible affinité au glucose.
Il sert à faire entrer du glucose quand
les récepteurs GLUT_1 saturent. Lentrée est proportionnelle à la concentration
du glucose.
v Mécanisme de transport du
glucose :
.Poly
p 3.
Il est dit du
« pore à soupape ».
" Les protéines transmembranaires alternant
entre les 2 états conformationnels.
v Régulation de lentrée du
glucose par linsuline :
Linsuline
stimule lentrée du glucose dans les cellules (adipocytes et cellules
musculaires) en modifiant la distribution subcellulaire des transporteurs du
glucose.
Son action est très rapide : en 15
min, le flux (= vitesse de passage par unité de surface) est augmenté de 6 à 12
fois.
Cette
stimulation nest pas affectée par les inhibiteurs de la synthèse protéique
(transcription ou traduction) Elle ne requiert pas de la synthèse protéique.
.Poly
p 3.
GLUT_4 :
Ces
transporteurs sont dans le cytosol. Linsuline provoque la mobilisation des
GLUT_1 vers la membrane plasmique et donc leur exocytose. Les transporteurs
sintègrent à la membrane mais ny restent pas : quand il ny a plus de
stimulation, il y a une endocytose des vésicules transportant les
transporteurs.
Linsuline a un
caractère hypoglycémiant car elle provoque lentrée du glucose dans les tissus
périphériques.
Régulation de la séquestration
intracellulaire de GLUT_4 :
.Poly
p 3.
Hypothèse :
Les vésicules
contenant GLUT_4 sont séquestrées hors du système constitutif de recyclage des
endosomes par lassociation avec des « récepteurs de rétention » (RR)
localisés sur des structures tubulovésiculaires situées à proximité de la
membrane.
v Le transport du glucose
dans lépithélium intestinal :
.Poly
p 3.
v Identification des enzymes
régulatrices :
Mise en évidence des mécanismes
contrôlant le flux dune voie métabolique :
-
Identification
des réactions à vitesse limitante ;
-
Mesure
des DG des différentes réactions :
" Les réactions loin de léquilibre sont des
points de contrôle potentiel ;
-
Identification,
in vitro, des effecteurs allostériques
des enzymes catalysant ces réactions :
" Mécanismes mis en jeu ;
-
Mesure
des concentrations in vivo des régulateurs présumés :
" Compatibilité des changements de
concentrations dans différentes concentrations avec le mécanisme de contrôle
proposé.
v Régulation de lactivité
des enzymes clés :
Ø Régulation
de lhexokinase et de la glucokinase :
§ Inhibition allostérique par
le G6è :
La
phosphorylation est assurée par des kinases :
-
Le
Km pour le glucose :
Hexokinase
"
Glucokinase
"
-
Comportement de
lenzyme :
Lhexokinase : mickaelien
Glucokinase : allostérique
La glucokinase
est lexception des enzymes allostériques car la glucokinase est monomérique.
Stimulation par le glucose :
Vitesse / Vmax

1 Hexokinase (ubiquiste)
Glucokinase (cellules
hépathiques,
0,5 cellules b
pancréatiques)
[Glucose] en mM
0 5 10 15
Inhibition par le glucose6è :
Vitesse

Glucokinase (indifférente)
Hexokinase
[Glucose6è]
Le glucose_6è ne présente aucune inhibition
sur lactivité de la glucokinase, donc lactivité glucokinase est
proportionnelle à la quantité de glucose qui entre dans la cellule.
§ Activation allostérique par
le phosphate minéral Pi :
Elle ne concerne
que lhexokinase.
Cette activation
est indirecte : le Pi fait diminuer laffinité pour le glucose_6è et donc permet la levée de
linhibition par le glucose_6è de
lhexokinase.
§ Régulation de la glucokinase
hépatique :
Exemple de cycle futile : le cycle Glucose Glucose_6è :

Pi Glucose ATP
Glucose_6_phosphatase Glucokinase
H2O Glucose_6è ADP
Þ ATP + H2O " ADP
+ Pi
La chaleur
dépensée dans ces réactions permet à lorganisme de maintenir sa température
corporelle.
Le foie est
consommateur et producteur de glucose. Ce dernier ne doit donc pas être
consommé par la glucokinase (GK) ; il faut éviter la mise en place de ce
cycle.
Pour cela, la cellule hépatique a mis en
place un mécanisme de régulation particulier où elle séquestre cette activité
dans le noyau.
-
-
Laugmentation
de la concentration intracellulaire en glucose entraîne la translocation de
-
-
Il
y a ensuite une séquestration nucléaire grâce à la fixation à une GKRP
(Glucokinase Regulatory Proteins)
Ce mécanisme
permet la limitation de laction catalytique de
(le cycle futile
est minimisé)
Il y a ainsi une
sécrétion hépatique du glucose.
Ce rôle régulateur est limité :
-
Le
glucose_6è est à lorigine
de plusieurs voies métaboliques (synthèse du glycogène, voies des
pentosesphophates)
-
Il
ny a pas de rôle si le glucose est fourni par la dégradation du glycogène, car
la glycogénolyse fournit du glucose_1è.
Le glucoseè est un carrefour métabolique :
Glucose
 ATP
ATP
Hexokinase
ADP
Glucose_6è
Glucose_1è Fructose_6è 6_phosphogluconate
Glycogène Pyruvate Ribose
" Stockage " ATP,
Biosynthèse " NADPH, Synthèse
nucléotidique
§ La glucokinase = détecteur de
glucose dans les cellules b pancréatiques :
.Poly
p 4.
Þ Cest une
véritable sonde métabolique qui renseignent sur la glycémie des cellules b.
Le glucose entre
dans la cellule
ß
Il est
transformé en pyruvate avec la création dATP ;
ß
LATP entraîne
la fermeture de canaux K+ (sensibles à
lATP) ;
ß
Une
dépolarisation membranaire est déclenchée ;
ß
Des canaux Ca2+ souvrent,
permettant lentrée des ions Ca2+ ;
ß
Le Ca2+ provoque
lexocytose de vésicules (migration vers la membrane) ;
ß
Libération
dinsuline.
Des mutations de
-
Aux
USA, 1 individu sur 2400 hétérozygotes porte des mutations de gène de
-
Ces
mutations seraient une des principales causes de lapparition de diabète non
insulinodépendant.
Baisse
dactivité de
ß
Augmentation du
seuil de sensibilité visàvis du glucose (pour la synthèse dinsuline)
ß
Diminution de la
synthèse dinsuline
ß
Baisse du
prélèvement hépatique du glucose et du catabolisme glucidique hépatique
concomitant à une augmentation de la production hépatique de glucose.
Ø Régulation
de la phosphofructokinase 1 (PFK 1) :
Glycolyse :
Glucose
![]()
![]() ATP
ATP
Hexokinase
ADP
Glucose_6è
![]()
Phosphoisomérase
Fructose_6è
![]()
![]() ATP
ATP
PFK 1 (=
PhosphoFructoKinase 1)
ADP
Fructose_1,6 diè
![]()
Aldolase
Glycéraldéhyde
![]()
DHAè
-
Elle
catalyse la réaction la plus lente ;
-
Elle
oscille entre 2 états conformationnels T et R.
Elle se situe
dans le cytosol et est composée de 4 sousunités identiques (=
homotétramère) :
-
4
x 83 000
Da (chez les eucaryotes),
-
4
x 41 000
Da (chez les procaryotes)
§ Inhibition
allostérique :
Il sagit dun
rétrocontrôle négatif par des indicateurs de charge énergétique forte :
ATP, citrate, NADH.
·
ATP :
Fructose_6è
![]()
![]() ATP
ATP
PFK 1 (=
PhosphoFructoKinase 1)
ADP
Fructose_1,6 diè
Vitesse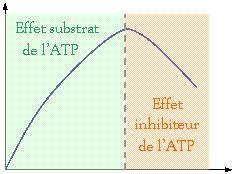
[
ATP ]
Sur
-
Un
site catalytique avec une forte affinité, pour de faibles concentrations de
glucose et dATP ;
-
Un
site allostérique avec une faible affinité, pour de fortes concentrations de
glucose et dATP ;
Quand il y a de
fortes concentrations en ATP, ce dernier se fixe uniquement sur le site
allostérique.
Vitesse
Faible
[ATP]
Vm
Forte
[ATP]
[fructose_6è]
Km1 Km2
LATP est un
inhibiteur allostérique hétérotrope de
 " Quand il y a
fixation de lATP sur
" Quand il y a
fixation de lATP sur
Charge
énergétique =
 Vitesse relative
des réactions
Vitesse relative
des réactions
Réaction utilisation de lATP
Réaction
produisant de lATP
Charge
énergétique
0
0,25 0,5
0,75 1
" La glycolyse se réalise dans nimporte quelle
condition ; elle régule la charge énergétique de la cellule.
La concentration en ATP est maintenue à
peu près constante grâce à 2 réactions :
![]() Créatine
kinase
Créatine
kinase
ATP +
créatine phosphocréatine + ADP
DG » 0
![]() Adénylate
kinase (ou myokinase)
Adénylate
kinase (ou myokinase)
2
ADP ATP
+ AMP
|
|
Concentration avant la
consommation dATP |
Concentration après la
consommation dATP |
Changement
relatif (en %) |
|
ATP |
|
|
10 % |
|
ADP |
|
|
0 % |
|
AMP |
|
|
600 % |
Problème :
La concentration
dATP varie peu (± 10%) mais le
flux glycolytique varie de 1 à 100.
" Il y a dautre(s) mécanisme(s) que la
régulation allostérique par lATP.
·
Citrate
et NADH :
Ce sont 2
inhibiteurs allostériques de PFK 1 qui renforcent leffet inhibiteur dATP.
§ Activation
allostérique :
·
AMP :
Cset un
activateur hétérotrope : il modifie, en diminuant, laffinité de lenzyme
visàvis de son inhibiteur allostérique : lATP.
 Vitesse
Vitesse
Faible
[ATP] Fort [ATP] + Faible [AMP]
Forte
[ATP]
[fructose_6è]
LAMP se lie
préférentiellement à létat R.
Un signal
métabolique consistant en la diminution de la concentration de lATP,
insuffisant pour lever linhibition exercée sur
Mais
lamplification de la stimulation de
" Il existe donc un autre mécanisme activateur.
·
Fructose
2,6biphosphate :
¨
Activateur
allostérique majeur de
Activité de

100
+
Fruct 2,6 diè
75
Fruct
2,6 diè
50
25
0
0,5 2 [Fructose 6è]
(en mM)
Ce nest pas la
vitesse de réaction qui change, mais laffinité de lenzyme pour son substrat.
"
Vitesse Vitesse

![]() + Fruct 2,6 diè
+ Fruct 2,6 diè


+ Fruct 2,6 diè
Fruct 2,6 diè
Fruct 2,6 diè
![]()
[AMP] (en mM) [ATP]
" Augmentation
de laffinité de lenzyme pour son autre activateur allostérique, lAMP.
" Diminution
de laffinité de lenzyme pour son inhibiteur allostérique, lATP.
¨
Métabolisme
assuré par une enzyme fonctionnelle :
ATP ADP
 Phosphofructokinase
2 (PFK 2)
Phosphofructokinase
2 (PFK 2)
Fructose_6è Fructose_2,6
diè
Fructose 2,6 diphosphatase
Pi H2O

ß
Absence
dactivation de
ß
Diminution
de lutilisation cellulaire du glucose
ß
Diminution
du prélèvement du glucose circulant
ß
Augmentation
de la glycémie

Linsuline
favorise lactivation de
&
La
diminution de lactivité du catalyseur de
ß
Augmentation
de la glycolyse
ß
Augmentation
de lutilisation cellulaire du glucose
ß
Diminution
de la glycémie
Les 2 activités
enzymatiques distinctes sont portées par une enzymatique unique bifonctionnelle.
Il sagit dune enzyme bifonctionnelle est un dimère (2 sousunités de 55 kDa),
dont chaque sousunité est bifonctionnelle.
La
bifonctionnalité est démontrée par :
-
Lutilisation :
-
Des
agents oxydants :
" Diminution de lactivité kinase, mais lactivité
phophatase est épargnée.
-
Des
agents alkylants (paramercuribenzoate) :
" Augmentation de lactivité kinase, mais diminution
de lactivité phophatase.
-
De
lADP :
" Diminution de lactivité kinase, mais
lactivité phophatase est épargnée.
-
Lapplication
dune protéolyse limitée (thermolysine, trypsine) :
" Absence de lactivité kinase, mais lactivité
phophatase est épargnée.
-
La
détermination de la séquence primaire :
" Mise en évidence de 2 domaines indépendants.
¨
Régulation par
phosphorylationdéphosphorylation des activités kinasiquephosphatasique :
AMPc
ß
PKA
ß
Phosphorylation
dune sérine par sousunité
ß
Diminution de
lactivité kinasique
&
Augmentation de
lactivité phosphatase
Activité kinasique
Activité phosphatasique

Vmax
Vmax
Km Km Km (constant)
Inhibition compétitive
Inhibition non compétitive
Propriétés de
-
Elle
a une stricte spécifique par rapport au D_Fructose_6è.
-
Il
ny a pas dinhibition par lATP, à la différence de

Inhibition compétitive
Inhibition non compétitive
Double rôle du citrate :
Il est
linhibiteur allostérique de
 Propriété du fructose2,6 diè :
Propriété du fructose2,6 diè :
Régulation du
taux du F_2,6 diè :
.Poly
p 4.
Le Pi entraîne
une augmentation du KInhibiteur du frutcose_6è
ß
Levée partielle
de linhibition exercée par la fructose_6è
Þ Lactivation de
cet inhibiteur allostérique va stimuler la glycolyse.
Le niveau de
phosphorylation va régler les activités phosphatasiques et kinasique.
Intérêt dune régulation concertée dans
les cycles futiles :
![]()
![]()
12 10
A B A B
![]()
![]() 13 16
13 16
Flux net
= 1
Flux net = 6
" Une modification de 25% des activités
enzymatiques induit une augmentation de 500% du flux métabolique. Cela permet
une régulation très fine des métabolismes cellulaires.
Régulation hépatique de la
glycolyse :
.Poly
p 5.
2
hormones hyperglycémiantes (adrénaline et glucagon) vont activer la protéine
kinase A (PKA) qui va phosphoryler lenzyme bifonctionnelle :
-
Diminution
de lactivité kinasique,
-
Augmentation
de lactivité phosphatasique.
Le fructose_2,6
diè est incapable dagir comme
inhibiteur allostérique car sa concentration est trop faible.
" Il participe à une étape limitante.
La chute de la
vitesse du flux glycolytique permet de préserver le glucose formé pour le
relarguer dans la circulation.
.Poly
p 5.
Le récepteur insuline entraîne une
cascade de signaux « kinasiques » et lactivation de certaines
activités enzymatiques dont la phosphatase.
-
Linsuline
régule lactivité phosphodiestérase formant lAMP non cyclique incapable
dactiver
-
Elle
soppose au glucagon et ladrénaline :
-
En
diminuant le taux de lAMPc.
En
déphosphorylant lenzyme bifonctionnelle, son activité phosphatasique est
diminuée.
Des
fortes concentrations [F_2,6 diè] stimulent
" Linsuline a
un rôle hyperglycémiant car elle favorise lutilisation du glucose.
Régulation hépatique de la
glycolyse :
.Poly
p 5.
Structure primaire des enzymes
bifonctionnelles dans le foie et le cur :
.Poly
p 5.
Dépendance du flux glycolytique
visàvis de quelques enzymes :
 Flux glycolytique :
Flux glycolytique :
0,09
Glucokinase
0,06
0,04
PFK
1
0,02
Phosphokinase
isomérase
0
1 2
3 Quantité denzyme ajoutée
Le facteur
limitant de la glycolyse (dans le foie) est la 1ère réaction,
c'estàdire la transformation du glucose en glucose_6è.
Conditions expérimentales :
-
Homogénat
de tissu hépatique (quantité fixe),
-
Additions
de concentrations croissantes denzymes purifiées,
-
Mesure
de la quantité de fructose_1,6 diè formé
Plus on ajoute
de la glucokinase, plus on stimule la transformation du glucose en fructose_1,6
diè.
Ø Régulation
de pyruvate kinase (PK) :
§ Les isoenzymes de
On trouve 3
isoenzymes : M localisée
dans le muscle et le cerveau,
A localisée
dans les tissus adipeux,
L localisée
dans le foie et le rein.
Seule
lisoenzyme L est soumise à régulations allostérique et par
phosphorylation.
§ Régulation
allostérique :
·
Inhibiton
allostérique (ATP, NADH, citrate, alanine) :

Le mécanisme de rétrocontrôle négatif
par lalanine est très important dans la période de jeûne.
Cycle glucose alanine :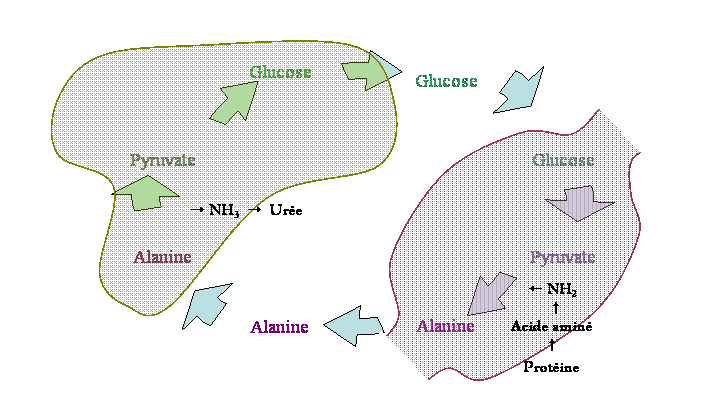
Lalanine va
servie de substrat dans la néoglucogenèse et inhiber fortement la glycolyse
hépatique
·
Activation
allostérique (ADP, fructose1,6 diè) :
Vitesse
 +
Fructose_1,6 diè
+
Fructose_1,6 diè
Fructose_1,6 diè
"
Augmentation de lactivité de lenzyme
[
PEP ]
Le
fructose_1,6 diè permet une activation par
anticipation.
§ Régulation par
phosphorylationdéphosphorylation :
 Régulation de
Régulation de
.Poly
p 4.
Vitesse

Pyruvate kinase
déphosphorylée
Pyruvate kinase phosphorylée
[
PEP ]
" Lactivation
fait augmenter laffinité pour le substrat.
-
La
forme déphosphorylée est plus sensible aux activateurs allostériques comme le
fructose_1,6 diè,
-
La
forme phosphorylée est plus sensible aux inhibiteurs allostériques comme
lalanine.
-
La
phophatase est stimulée par linsuline,
-
Le
fructose_1,6 diè freine la
phosphorylation de
Ø Régulation
à long terme des enzymes clés :
Elle se fait sur
la glucokinase,
Influence de lalimentation :
|
|
Glucokinase |
PFK 1 |
PK |
|
Alimentation glucidique |
& Augmentation |
& Augmentation |
& Augmentation |
|
Jeûne glucidique |
(( Forte
baisse |
( Baisse |
( Baisse |
Rôle des hormones dans la régulation
transcriptionnelle des enzymes clés de la glycolyse :
|
|
Glucokinase |
PFK 1 |
PK |
Enzyme bifonctionnelle |
|
Glucagon |
( (induction
par linsuline) |
? |
( (induction
par linsuline et le glucose) |
( |
|
Insuline |
& |
& |
& (+
glucose) |
Restauration de lactivité |
|
Diabète |
(( |
( |
( |
( |
N. B :
La glucokinase
des cellules pancréatiques est insensible à linsuline.
La glucokinase
pancréatique est un détecteur de glucose.
ß
Contrôle du flux
glycolytique
ß
Contrôle du
ratio ATP /ADP responsable de la synthèse dinsuline.
v Rappels :
Ø Structure
du glycogène :
Le glycogène
constitue la principale forme de stockage des glucides chez les animaux.
Réserves glucidique chez lhomme adulte
normal :
-
Glycogène
hépatique : 4%
du poids frais soit
-
Glycogène musculaire
: 0,7%
du poids frais soit
-
Glycogène
extracellulaire : 0,1% du poids frais soit
Contenu hépatique en glycogène :
![]() Variation nycthémérale du contenu
hépatique en glycogène
Variation nycthémérale du contenu
hépatique en glycogène
(à partir dune population américaine
normale)
![]() 8H 12H 16H 20H 24H 4H 8H
8H 12H 16H 20H 24H 4H 8H
Réserves énergétiques dun homme normal
(en kCal) :
-
Glycogène
hépatique : 280
-
Glycogène
musculaire : 480
-
Glycose
extracellulaire : 80
-
Lipides : 135 000
-
Protéines : 24 000
Il existe 2 types de liaison
glucosidique :

-
 Liaison a_1,4 :
Liaison a_1,4 :

-
Liaison
a_1,6 :
La structure
ramifiée du glycogène est due à ses 2 types de liaison.
Le glycogène est
stocké dans le cytosol sous forme de granules. Ces dernières présentent un
diamètre de 100 à 400 Å et contient
jusquà 120 000 unités de glucose.
Le PM du glycogène va jusquà 2.107 Da.
Lintérêt
physiologique du glycogène est sa dégradation rapide.
Mais alors,
pourquoi stocker le glucose pour les réserves énergétiques,
alors que lon a
beaucoup plus de lipides ?
-
Mobilisation
plus rapide du glycogène dans le muscle,
-
Pas
de métabolisme des AG en anaérobiose,
-
Pas
de conversion des AG en glucose.
" Le métabolisme
des lipides ne peut assurer seul le maintien de la glycémie.
Ø Réaction
de la glycogénolyse :
Phosphorylase du glycogène
![]() (glucose)N + Pi (glucose)N+1 +
Glucose_1è
(glucose)N + Pi (glucose)N+1 +
Glucose_1è
Dans
la cellule : [Pi] / [G_Iè]
= 100
" Réaction est
pratiquement irréversible.
DG = 0 quand [Pi] / [G_Iè]
» 3,5
.Poly
p 6.
La phosphorylase
catalyse la coupure des liaisons a_1,4 du
glycogène des extrémités non réductrices (= absence du C1OH)
Il ne sagit pas dune hydrolyse, mais
dune phosphoralyse.
Laction de la
phosphorylase du glycogène sarrête au voisinage dans les liaisons a_1,6 (quand il
reste 4 résidus glucose avant une ramification)
Dautres enzymes
interviennent :
-
a_1,4 glucanne
transférase : Transfert des 3
unités sur la chaîne linéaire,
-
a_1,6 glucosidase : Elimination du glucose lié à la chaîne en a_1,6.
Ce sont des
enzymes bifonctionnelles. Elles sont dites des enzymes débranchantes.
Dégradation du
glycogène :
-
90%
en glucose_1è,
-
10%
en glucose.
v Régulation des enzymes de
la glycogénolyse :
Ø Phosphorylase
du glucogène musculaire :
.Poly
p 6.
La
phosphorylase du glycogène est un dimère constitué de 2 sousunités.
Le site de
fixation du glycogène peut être loin du site catalytique. La distance entre ces
2 sites correspond à 4 unités de glucose.
§ Régulation allostérique de la
phosphorylase b :
.Poly
p 6.
La
phosphorylase b correspond à létat
déphosphorylé de la phosphorylase du glycogène.
§ Régulation par
phosphorylationdéphosphorylation :
.Poly
p 7.
Phosphatase
![]() Phosphorylase a
Phosphorylase b
Phosphorylase a
Phosphorylase b
La phosphatase kinase
phosphoryle les résidus Sérine.
Il faut que la
phosphorylase b soit sous sa forme T pour quelle soit phosphorylée. Il y a, en
plus, des régulations allostériques.
La phosphorylase
a phosphorylée est très sensible à lAMP.
§ Régulation de la phosphorylation
(phosphorylase kinase) :
La phosphorylase kinase phosphoryle les
résidus a
et b.
Par
cette cascade, il y a une forte amplification de
.Poly
p 7.
La
phosphorylase kinase est un hétérotétramère
(4 sousunités)
.Poly
p 7.
La sousunité d est la calmoduline (CaM) :
Sa fonction est
de fixer le Ca2+ de
lorganisme ; elle donc très importante.
Elle est
constituée de 148 acides aminés et est présente dans toutes les cellules de
lorganisme.
 Ca2+ Ca2+
Ca2+ Ca2+
Ca2+ Ca2+
Les
4 ions Ca2+ viennent se fixer.
Le
Ca2+ qui se lie induit des
changements conformationnels :
-
Dévoilement
dune plage hydrophobe riche en Métionine,
-
Formation
de liaison de forte affinité avec le domaine de liaison à la calmoduline de certaines
protéines,
-
Modulation
de lactivité de ces protéines.
La sousunité g porte le site
catalytique qui permet la phosphorylation de certains substrats.
Fixation du Ca2+ fixé avec la
sousunité d
ß
Modification de
lactivité de la sousunité g
ß
Les résidus
Sérine des sousunités a et b deviennent
accessibles
ß
La protéine
kinase A peut alors phosphoryler la sousunité b
ß
Autre changement
conformationnel
ß
Phosphorylation
de la sousunité a
ß
Dévoilement plus
important de
ß
Inhibition
de lactivité de la phosphatase kinase
Þ Laction des phosphatases (PP1) qui
déphosphorylent le résidu Sérine entraîne linhibition de lactivité de la
phosphatase kinase.
A Noter :
La
structure de la calmoduline est similaire à celle de la troponine C (70%
dhomologie)
" Lactivation de la glycolyse et linduction
de la contraction musculaire sont réalisées par des protéines similaires liant
le Ca2+.
Þ Il y a
synchronisation des 2 processus.
§ Régulation de la déphosphorylation
(PP1) :
.Poly
p 7.
·
Activation
:
Elle doit être
phosphorylée sur au moins 1 des 2 sites. Elle est phosphorylée par la protéine
kinase A sous laction de linsuline.
Mais il existe
un 2ème mode de phosphorylation par
Elle conduit à
une double phosphorylation qui entraîne des modifications
ß
ß
Inactivation de
&
Activation de la
glycogénolyse
·
Inactivation
de
.Poly
p 8.
Elle se fait par
laction dune protéine inhibitrice qui fixe avec une forte affinité la
sousunité catalytique quand cette protéine est phosphorylée.
§
·
Considérations
générales sur les (Ser/Thr) phosphatases :
Il existe
beaucoup plus de Ser/Thr kinases (pour la phosphorylation) que de Ser/Thr
phosphatases (pour la déphosphorylation) différentes chez les vertébrés.
Chez lhomme, le
rapport kinases/phosphatases = 20
" Lévolution
saccompagne dune diversité croissante des Ser/Thr kinases mais pas des
Ser/Thr phosphatases (dont le nombre reste à peu près constant au cours de
lévolution)
Comment assurer
une spécificité daction de ces phosphatases ?
Il y a peu de
diversité des sousunités catalytiques mais chaque sousunité catalytique est
capable de réagir avec de multiples sousunités régulatrices.
Exemple :
" Génération
dholoenzymes différentes avec des spécificités daction et des localisations
différentes.
·
Ciblage
subcellulaire des phosphatases :
Le contrôle
précis du large spectre dactivité des phosphatases est obtenu en restreignant
laction de ces enzymes in vivo.
Ce contrôle est
exercé par des protéines de nature variée qui, en interagissant à la fois avec
dautres molécules et avec des phosphatases, vont se comporter comme des sousunités
de ciblage (targeting subunit) des phosphatases.
La phosphatase
ne pourra déphosphoryler que les substrats situés à proximité immédiate de la
sousunité de ciblage sur laquelle elle est fixée.
Ces sousunités
de ciblage contrôlent lactivité catalytique des phosphatases.
Ciblage subcellulaire :
.Poly
p 8.
1)
En
confinant lenzyme dans les zones précises de la cellule.
2)
En
modifiant allostériquement les propriétés catalytiques et/ou régulatrices de
lenzyme.
" Ces 2 effets étant réversibles.
D Il ny a pas de régulation par le Ca2+ de la phosphorylase kinase,
contrairement à
Ø Phosphorylase
du glucogène hépatique :
Elle
présente une structure différente de la phosphorylase musculaire mais a une
régulation quasi identique :
-
Régulation
par phosphorylation déphosphorylation,
-
Régulation
allostérique :
-
De
la phosphorylase b (comme avec la phosphorylase musculaire),
-
De
la phosphorylase phosphatase.

Phosphorylase a Phosphorylase b
Phosphorylase
phosphatase
Inhibition
AMP Glucose
Activations
Insuline Glucocorticoïdes (cortisol)
Laction inhibitrice est majeure par
rapport aux autres actions.
v Rappels :
Ø Réactions
de la glycogenèse :
.Poly
p 9.
Ø Mécanisme
de ramification du glycogène :
.Poly
p 9.
Lenzyme
branchante transfère une partie du glucose de la chaîne latérale sur la chaîne
linéaire en formant une liaison a_1,6.
Ø La
glycogènine :
Il sagit du
« primer » de la synthèse du glycogène, en permettant linitiation de
la glycogénogenèse.
Cest un
polypeptide de 332 acides aminés.

8
(UDP_glucose)
Glycosylation
spontanée
8
UDP
n
(UDP_glucose)
Glycogène synthétase et
Enzymes
débranchantes n UDP
v Régulation de la glycogène
synthétase :
Ø Par
phosphorylation :
.Poly
p 9.
-
La
glycogène synthétase (GS) est active quand elle est déphosphorylée : GS a.
-
Quand
elle est phosphorylée, elle est inactive :
GS b.
-
§ Sites de phosphorylation
multiples dur
.Poly
p 10.
Tous les sites
de phosphorylation nont pas le même poids. Il existe :
-
Des
sites primaires,
-
Des
sites secondaires.
Les sites IAIRES entraînent
aucune modification apparente de lactivité de
" Inactivation
de
Différences
entre
-
La phosphorylation entraîne la baisse de
la vitesse max.
-
La phosphorylation entraîne la baisse
daffinité pour lUDPglucose.
Il y a aussi une
absence de 2 sites de phosphorylation apr
Ø Par
phosphorylation :
.Poly
p 10.
N.B :
Linsuline
stimule
Ø Par
contrôle allostérique :
.Poly
p 10.
Seule la forme b
(phosphorylée) est contrôlée allostériquement.

La concentration
en glucose_6è, dans le
muscle, est de 0,2 à
" La glycogène
synthétase b in vivo est quasiment
inactive.
Þ Lactivité de
v Régulation coordonée de la
glycogénolyse et de la glycogénogenèse :
.Poly
p 10.
La
mobilisation des réserves glucidiques entraîne une augmentation de la
glycogénolyse et donc une inhibition de la glycogénogenèse par les enzymes.
On observe le
phénomène inverse avec linsuline :
Glycogénogenèse favorisée,
Glycogénolyse inhibée.
v Action glycogénogenèse du
glucose :
.Poly
p 11.
Ø Inactivation
de la phosphorylase a et activation de
Dans le foie, la
phosphorylase a joue le rôle de la glucokinase : Détecteur de glucose.
Une
fois le glucose fixé sur la phosphorylase a :
-
Inhibition
compétitive du glucose,
-
Fixation
sur le site allostérique.
" Changement conformationnel : Meilleure accessibilité des résidus Serè pour les phosphatases.
Les phosphatases
accèdent à leur substrat "
Déphosphorylation de la phosphorylase a.
En même temps de
linactivation de la phosphatase a :
"
Þ Il ny a pas dinstauration simultanée de la
synthèse et de la dégradation du glycogène.
Lactivation
de
Certains
analogues non métabolisables du glucose entraînent une diminution dactivité
sur la phosphatase mais nont pas daction sur
Le 2_désoxyglucose agit comme le
glucose : Baisse dactivité de la
phosphatase,
Augmentation
dactivité de
" Le glucose_6è
est requis.
Linhibiteur
de la glucokinase entraîne une baisse de
Le
glucose_6è stimule de la
déphosphorylation de
Important : Linactivation de la phosphatase a est un pré
requis pour lactivation de
Le glucose
augmente la transcription des gènes impliqués dans son métabolisme.
Ø Augmentation
de lexpression de GLUT2 :
Le
glucose crée une augmentation de lexpression de GLUT2.
Les effets
transcriptionnels du glucose sont médiés par le xylulose_5è (intermédiaires du cycle des
pentosesphosphates)
Ø Régulation
des voies de signalisation :
Le
glucose activerait certaines voies de signalisation.
Lactivation
de
Ø Contrôle
de la localisation subcellulaire de certaines enzymes glycogénogenèses :
Le glucose
contrôle la localisation subcellulaire de certaines enzymes glycogénogenèses
(glucokinase, GS) et de la glycogénine.
" Création
dun complexe glycogénogenèse regroupant la glycokinase, GS et glycogénine
associé aux microfilaments dactine.
v Rappels sur les réactions
de la gluconéogenèse :
Schéma simplifié des voies de la
gluconéogenèse :
.Poly
p 12.
La
gluconéogenèse se déroule principalement dans le tissu hépatique et le rein.
2 cycles impliqués dans la
gluconéogenèse hépatique :
.Poly
p 12.
Néoglucogenèse :
.Poly
p 12.
La
gluconéogenèse est un gaspillage énergétique indispensable.
+
6 ATP
![]() 2 Lactate 1 Glucose
2 Lactate 1 Glucose
Mais
lATP requis est fourni par oxydation des acides gras (AG)
Les conditions
métaboliques requises pour linitiation de la gluconéogenèse correspondent aux
conditions, ellesmême, correspondant à une liberté accrue dAG dans la circulation.
" Oxydation
mitochondriale hépatique :
" Corps cétoniques,
" ATP (glucose)
Voies de la gluconéogenèse :
.Poly
p 13.
GOT = Glutamate
Oxaloacétate Transaminase
MDH = Malate
DéHydrogénase
LDH = Lactate
DéHydrogénase
Régulation transcriptionnelle
coordonée de la glycolyse et de la gluconéogenèse :
.Poly
p 13.
v Régulation des activités
des enzymes de la gluconéogenèse :
Ø
Cest une enzyme
mitochondriale (chez les mammifères) ou cytosolique (chez les levures et
bactéries)
Chez les
mammifères :
Cest
une protéine homotétramérique, avec 4 chaînes identiques de 1178 acides
aminés, et un PM de 4 x 130 kDa (= 520 kDa)
Elle
est régulée par lacétyl_CoA, comme la quasitotalité des carboxylases.
§ Activation allostérique :
·
Par
lacétyl_CoA :
Chez les
mammifères.
Enzyme_biotine + ATP + HCO3
![]() + Acétyl_CoA
+ Acétyl_CoA
+ Mg2+
Enzyme_biotineCO2 + ADP + Pi
![]() + Pyruvate
+ Pyruvate
Enzyme_biotine + OAA
La
biotine permet la catalyse.
Par contre, chez
la levure, lactivation de
Vitesse +
Acétyl_CoA
 Vmax
Vmax
Acétyl_CoA
[HCO3]
Km Km
" Implication
dans lautorégulation du métabolisme intermédiaire.
-
Une
charge énergétique crée un ralentissement du cycle de Krebs et donc une
augmentation de la concentration de lacétyl_CoA.
" Activation
de la pyruvate carboxylase (PC) et augmentation de la synthèse du glucose.
-
Un
déficit en OAA entraîne augmentation de la concentration de lacétyl_CoA.
" Activation
de la synthèse dOAA et augmentation du cycle de Krebs.
-
La
b_oxydation
(en période de jeûne) entraîne augmentation de la concentration de
lacétyl_CoA.
" Activation
de la pyruvate carboxylase (PC) et inhibition de la pyruvate déshydrogénase
(PDH)
·
Par lATP
:
§ Inhibition allostérique par
lADP :
Ø La
fructose1,6 diphosphatase :
Cest une enzyme
tétramérique.
Il nexiste pas
de coopérativité visàvis du substrat (fructose_1,6 diè)
" Comportement
mickaelien visàvis du sbstrat.
Elle a un comportement allostérique visàvis des
effecteurs allostériques.
Il y a la
nécessité de Mn2+ et Zn2+ pour la
catalyse.
Vitesse
 Vmax
Vmax
[Fructose_1,6
diè]
§ Activation
allostérique :
Elle
se fait par lATP, le NAD réduit et le citrate.
Elle
favorise la transformation allostérique de lenzyme vers sa forme catalytique.
De plus, il y a une stabilisation de la
forme R (active) favorisée par le substrat (fructose_1,6 diè) et le fructose.
§ Inhibition
allostérique :
Elle se fait par
lAMP (et non lAMPC) et le
fructose_2,6 diè.
·
LAMP
:
Elle
favorise la transition de la forme R vers la forme T (moins active)
Leffet
est variable suivant les espèces.
LAMP
est efficace chez les mammifères, mais sa concentration varie peu.
Vitesse
 Vmax
Vmax
[AMP]
·
Le
fructose2,6 diè :
Vitesse
 Vmax
Vmax
Cest
linhibiteur allostérique majeur.
[AMP]
Le fructose_2,6
diè est à la fois activateur de la
glycolyse et inhibiteur de la gluconéogenèse.
Cette
double régulation par la même molécule fait que la glycolyse et gluconéogenèse
ne peuvent coexister.
Linhibition
allostérique par le fructose_2,6 diè est due
à :
-
Linhibition
compétitive par rapport au substrat (analogie avec le fructose_1,6 diè)
-
Linduction
dune coopérative négative pour la fixation du substrat,
-
Le
renforcement de linhibition induite par lAMP, par augmentation de laffinité
pour lAMP :
" Le fructose_2,6è
agit comme un effecteur allostérique hétérotrope
Vitesse
 Vmax
Vmax
fructose_2,6 diè
+ fructose_2,6 diè
[AMP]
-
La
fragilisation (avec lAMP) de la liaison protéinemétaux (MN2+ et Zn2+) dans les sites
catalytiques, créant une baisse dactivité.
Régulation indirecte par lAMPc de la
fructose_1,6 diphosphatase :
![]()
![]() Adrénaline Glucagon
Adrénaline Glucagon
( [AMPc]
”
Phosphorylation
de
”
( [Fructose_2,6
diè]
”
Restauration
de lactivité du fructose_1,6 diphosphatase
”
Baisse
de la glycolyse
&
Augmentation
de la glyconéogenèse
Ø La
glucose6 phosphatase :
§ Structure de lenzyme :
Lune des
principales fonctions hépatiques est la fourniture de glucose.
La
glucose_6 phosphatase joue un rôle essentiel dans lhoméostasie glucidique
car :
![]() Gluconéogenèse
Gluconéogenèse
Glucose_6è
Glycogénolyse
Le glucose_6 è doit être
hydrolysé par la glucose_6 phosphatase pour être libéré dans la circulation.
§ Localisation intracellulaire
de la glucose6 phosphatase :
Il y a un
subfractionnement cellulaire : elle est associée au RE. Cest un caractère
la distinguant de la plupart des phosphatases qui sont plutôt cytosoliques.
Ses propriétés
dépendent de lintégrité des membranes des lysosomes (majoritairement de
RE) :
-
Microsomes
intacts " Activité phosphatasique 10 fois plus élevée
avec le glycose_6è quavec le
mannose_6è,
-
Traitement des microsomes
par des détergents " Activité phosphatasique identique mais qui
porte une spécificité au glycose.
" La glucose_6 phosphatase isolée serait une
phosphatase relativement non spécifique.
Þ Sa spécifique visàvis du glucose dans la
cellule est due à sa localisation subcellulaire.
Complexe multienzymatique :
.Poly
p 13.
Le complexe est constitué par T1, T2 et T3.
Il sert à la déphosphorylation du
glucose.
GLUT_2 se charge de la libération du
glucose.
v Régulation de la synthèse
des enzymes clés de la néoglucogenèse :
Ø Régulation
à court terme de la glucose6 phosphatase :
Le Km visàvis
du glucose_6è vaut 2 à
" Laction de
lenzyme va dépendre essentiellement de la concentration en substrat.
Le
glucose :
Cest
linhibiteur compétitif in vitro,
mais le Ki =
" Importance physiologique mineure ?
Le Pi :
Cest
linhibiteur non compétitif dans le cas des microsomes intacts, et un
inhibiteur compétitif dans le cas dajout de détergents.
" Divergence
interprétée comme indicateur de la présence dun transporteur de Pi dans les
microsomes.
§ Régulation allostérique de la
glucose6 phosphatase :
Linhibition
se fait par le fructose_1è, mais sa
concentration physiologique est faible et nentraîne quune petite inhibition.
Elle
se fait aussi par la_cétoglutarate et les AG :
-
Tous
les acyl_CoA " Inhibition de la glucose_6 phosphatase,
-
Les
AG insaturés (arachidonate) " Aussi inhibition,
-
Les
AG saturés " Pas deffet.
Il y a des
effets inhibiteurs pour des concentrations faibles, mais ces effets sont nuls,
voire activateurs, pour des concentrations élevées.
Ø Régulation
à long terme :
Régulation
transcriptionnelle coordonnée de la glycolyse et de la gluconéogenèse :
.Poly
p 13.
" Régulation hormonale.
§ Déficience de lactivité
glucose6 phosphatase :
Une telle
déficience entraîne la maladie de Von Gierke, ou Glycogen Storage Disease (GSD)
de type 1.
-
Dues à laccumulation de glycogène
![]() Hépatomégalie
Hépatomégalie
-
Néphromégalie
-
Hypoglycémie
-
Acidose
lactique
v Rappels de la
réaction :
Les 5 réactions du complexe
multienzymatique de
.Poly
p 14.
Chez
les bactéries, ces enzymes ont une localisation cytosolique, ce qui les rend
plus sensibles aux arséniates que les enzymes humaines.
" Les arséniates ont été utilisés comme « antibiotiques »
au 19ème siècle. Ils sont rapidement abandonnés en raison des
effets secondaires.
v Organisation structurale du
complexe PDH dE. coli :
PM = 4600 kDa.
-
E2 : 24
sousunités associées en trimères localisés au coin dun cube ;
-
E1 : 24
sousunités PDH formant des dimères disposés au centre de chacune des arêtes du
cube ;
-
E3 : 12
sousunités de dihydrolypoyl déshydrogénase formant des dimères disposés au
centre de chacune des 6 faces.
Complexe
multienzymatique PDH deucaryote :
-
30
dimères E1,
-
6
dimères E3,
Þ Ils entourent un noyau central de 60
monomères E2.
Ø Intérêt
des complexes multienzymatiques :
Ils
permettent laccroissement de lefficacité catalytique car :
j La distance que
doivent parcourir les substrats entre les sites actifs est minimisée.
’ Augmentation de
la vitesse de réaction.
k Les
intermédiaires métaboliques sont guidés dune enzyme à lautre (évitant aussi
quils soient utilisés dans des réactions annexes)
l Les réactions
catalysées par ces complexes multienzymatiques peuvent être régulées de façon
coordonnée.
v Régulation de
Ø Régulation
allostérique :


Ø Régulation
par phosphorylationdéphosphorylation :
.Poly
p 14.
Régulation des activités PDH kinase et
PDH phosphatase :
.Poly
p 14.
-
La
kinase est insensible à lAMPc ;
-
Lactivité
phosphatasique est stimulée par linsuline ;
-
Le
CoASH et le NAD+ activent la
kinase ;
-
La
phosphatase est dépendante du Ca2+ ;
-
Lacétyl_CoA
joue un rôle central dans la régulation.
Glucose
Ý
Gluconéogenèse
Ý
OAA
 PC Ý
PC Ý
Pyruvate
PDH ß m CO2
Acétyl_CoA
ß
Cycle
de Krebs
ß
Energie
v Rappels des réactions et
identification des étapes limitantes :
" Caractère amphibolique du cycle de Krebs
(anabolique et catabolique)
Identification des étapes
limitantes :
Citrate
synthase
-
![]() OAA + Acétyl_CoA Citrate
OAA + Acétyl_CoA Citrate
Citrate synthase
-
![]() Isocitrate a_Cétoglutarate
Isocitrate a_Cétoglutarate
a_Cétoglutarate déshydrogénase
-
![]() a_Cétoglutarate Succinyl_CoA
a_Cétoglutarate Succinyl_CoA
Ces réactions sont
exergoniques : DG < 0
v Régulation :
Ø Disponibilité
en substrats :
Dans les
mitochondries, lacétyl_CoA et lOAA sont en concentrations non saturantes pour
la citrate synthétase.
PDH (pyruvate déshydrogénase) " Acétyl_CoA
MDH (malate déshydrogénase) " OAA
La concentration
en OAA dépend du rapport [NADH]/[NAD+]
![]()
![]()
![]()
![]() Malate
+ NAD+ OAA + NADH
Malate
+ NAD+ OAA + NADH

Passage dune faible activité à une
activité intense :
-
Diminution
de [NADH] = Réoxydation par la chaîne
respiratoire ;
-
Augmentation
de [NADH] = Loi daction de masse ;
-
Augmentation
de la synthèse de citrate ;
-
Diminution
de [Citrate] = Utilisation plus
importante que la synthèse ;
-
Diminution
de linhibition exercée par la citrate sur la citrate synthétase
" Augmentation de lactivité de la citrate
synthase.
-
Augmentation
de lactivité a_cétoglutarate déshydrogénase
= Levée de linhibition exercée par le
NADH et le succinyl_CoA
Passage dune activité intense à une
faible activité :
-
Phénomènes
inverses initiés par laugmentation des concentrations en NADH et ATP.
Passage dune activité intense à une
faible activité :
.Poly
p 15.
-
ADP : Activateur allostérique de lisocitrate
déshydrogénase (= diminution du Km pour lisocitrate)
-
ATP : Inhibiteur allostérique de lisocitrate
déshydrogénase
-
Ca2+ : 2 rôles distincts :
-
Augmentation de
-
Activateur
allostérique de lisocitrate déshydrogénase et de laCG
déshydrogénase.
Þ Dans le muscle, il y a un même signal pour
stimuler la contraction musculaire et une augmentation de la synthèse dATP.
v Rappel des réserves
énergétiques et évolution de la glycémie :
Réserves énergétiques dun homme
normal :
.Poly
p 16.
Evolution des concentrations
plasmatiques :
.Poly
p 16.
Quand
il y a une baisse de la glycémie, il y a la mise en place des corps cétoniques
qui peuvent être utilisés par de nombreux organes.
Le taux
Insuline/Glucagon régule le mécanisme glucidique.
v Les mécanismes impliqués
dans la conversion du foie lipogène en foie glucogène :
Ø Caractère
métabolique du tissu hépatique :
Foie
« alimenté »
Glycogénique
Glycolytique
Lipogénique
Foie « à
jeun »
Glycogénolytique
Gluconéogénique
Cétogénique
Protéolytique
ß
Mise en réserve
des calories
ß
Mobilisation des
réserves calorifiques
Ø Régulation
allostérique :
Contrôle du métabolisme hépatique par
les effecteurs allostériques (alimentation normale) :
.Poly
p 17.
Contrôle du métabolisme hépatique par
les effecteurs allostériques au cours du jeûne :
.Poly
p 17.
" Mécanisme du glucose
orienté vers la gluconéogenèse.
Ø Régulation
des activités enzymatiques :
Régulation des
activités enzymatiques (foie « lipogène ») :
.Poly p 17.
Régulation des
activités enzymatiques (foie « glucogène ») :
.Poly
p 17.
Ø Régulation
par induction de la synthèse protéique :
Enzymes inductibles dans le foie
nourri :
.Poly
p 18.
" Augmentation
importante dacides gras.
Enzymes inductibles dans le foie à
jeun :
.Poly
p 18.
" Gluconéogenèse
hépatique Þ
Synthèse de glucose.
v Diabète
insulinodépendant :
Pathologies associées au diabète :
-
Hypertension,
-
Athérosclérose,
-
Néphrosclérose,
glomérulosclérose, artériosclérose, pyclonéphrite,
-
Neuropathie
périphérique,
-
Rétinopathie,
cataracte, glaucomie,
-
Infarctus
du myocarde,
-
Pertes
de cellules pancréatiques,
-
Athérosclérose
périphérique,
-
Microangiopathie,
accidents vasculaires cérébraux, hémorragie, etc.
Þ Maladies graves.
Le diabète est une maladie multifonctionnelle.

Masse des
cellules j k
b
pancréatiques : l
m
n
0 5 10 15 20 25
j Prédisposition
génétique ;
k Evènement
déclencheur ?
l Désordre
immunologique, sécrétion dinsuline normale ;
m Perte
progressive de la sécrétion dinsuline (glycémie encore à peu près
normale);
n Diabète
déclaré.
Þ Un défaut de synthèse de linsuline entraîne
une forte diminution des cellules b pancréatiques.
Diabète insulinodépendant :
.Poly
p 18.
La cause est la
synthèse pancréatique, des cellules b, dinsuline
déficiente.
Les
conséquences :
-
Hyperglycémie,
-
Cétoacidose,
-
Hypertriglycéridémie.
Dans le tissu
hépatique, le taux de glucose augmente, comme si on était en période de jeûne.
La protéolyse musculaire augmente quand il y a un déficit dinsuline.
De plus, il y a
la mobilisation des réserves lipidiques :
-
Beaucoup
dacides gras,
-
Augmentation
des VLDL dans les triglycérides " Excès de
triglycérides,
-
Augmentation
massive de lipides circulants.
Ce sont les
lipides qui sont à lorigine des problèmes de santé.
La synthèse
massive de corps cétonique, combinée à une diminution du volume sanguin,
entraîne une acidification du sang à lorigine du coma diabétique.
v Diabète non insulinodépendant :
.Poly
p 18.
Il est dû à la
résistance des tissus à laction de linsuline (mutations)
" Foie glycogène (foie orienté vers la mise en
réserve des lipides)
La diminution de
lentrée du glucose dans les tissus périphériques est à lorigine du diabète
non insulinodépendant.
Les
conséquences :
-
Hyperglycémie,
-
Hypertriglycéridémie,
v Glycosylation des protéines
ou code sucré :
Ø La
glycosylation, principale modification posttraductionnelle des protéines :
Il
y a plus de 500 modifications différentes répertoriées, dont les principales
sont :
-
Modifications
Nterminales :
-
Acylation
(acétyl, formyl, myristoyl),
-
Méthylation.
-
Modifications
Cterminales :
-
Amidation.
-
Modification
des chaînes latérales des acides aminés :
-
Adénylation,
-
Prénylation,
-
Acylation,
-
Hydroxylation,
-
Carboxylation,
-
GLYCOSYLATION.
Les principaux
types de glycosylation des protéines (protéines O_glycosidées et N_glycosidées)
sont des résidus osidiques ajoutés sur un résidu Sérine ou Thréonine.
Parfois,
laddition dun glycosyl_phosphatidyl inositol se fait sur des protéines
ancrées dans la membrane. Cette addition fait que des protéines sans segment
hydrophobe peuvent sancrer dans la membrane.
Ces
modifications posttraductionnelles entraînent des modifications :
-
Des
propriétés chimiques de la protéine,
-
Et/ou
sa localisation cellulaire,
-
Et/ou
sa protection contre les activités protéolytiques.
Toutes
les protéines membranaires et les protéines sécrétées sont glycosylées.
Lintensité de la glycosylation est variable :
-
De
moins de 3%, comme les immunoglobulines (IgG)
-
A
plus de 40% de la masse totale, comme la crypthropoiétine
?
Les protéines ne
sont pas les seules molécules à être glycosylées, comme les glycolipides.
![]()
Glycoprotéines
=
Glycoconjugués membranaires
Glycolipides
Ø Les
oligosaccharides comme molécules informatives :
§ Les oligosaccharides comme
molécules dinformation : le code sucré :
Les
cellules utilisent des modifications oligosaccharidiques pour coder des
informations importantes concernant :
-
Le
ciblage intracellulaire des protéines,
-
Les
interactions cellulecellule,
-
Le
développement tissulaire,
-
Les
signaux extracellulaires.
Le code sucré
reste un code secret. La structure ramifiée entraîne une extrême complexité.
Par
exemple :
-
20
monosaccharides " 1,44.1015 oligosaccharides
hexamériques,
-
20
acides aminés " 6,4.107 hexapeptides,
-
4
nucléotides " 4096 hexanucléotides.
Si
on prend en compte la sulfatation affectant un ou plusieurs
oligosaccharides :
" 1017
oligosaccharides hexamériques différents.
La densité
dinformations contenue dans une molécule de petite taille est très largement
supérieure à celle contenue dans les acides nucléiques.
Chaque
oligosaccharide va constituer un mot du code qui va pouvoir être déchiffré par
les protéines interagissant avec eux, les lectines.
§ La glycosylation modifie les
propriétés physicochimiques des protéines :
-
Elle
intervient dans lacquisition de la conformation tridimensionnelle des
protéines,
-
Elle
fait augmenter le caractère hydrophile des protéines,
-
Elle
modifie la charge électrique globale de la protéine
Exemple : Glycoprotéine à
acide sialique " groupe COO à pH neutre.
§ Les conséquences biologiques
dune altération de la glycosylation sont très variables :
·
Approche
:
-
Inhibition
de la glycosylation,
-
Déglycosylation
chimique ou enzymatique,
-
Manipulation
génique (élimination de site de glycosylation, extonction de gènes),
-
Etude
des variants ou des mutations naturelles.
·
Effets
observés très variables :
-
Dans
lamplitude (indétectable " perte de
fonction),
-
Dans
les effets à léchelle de la protéine glycosylée (" disparition)
-
In
vivo versus in vivo,
-
Suivant
le type cellulaire,
-
Suivant
le stade embryonnaire,
-
Suivant
la situation physiologique.
Þ Il est difficile
de prédire à priori la (ou les) fonction(s) assurée(s) par un oligosaccharide
donné.
·
Rôles
biologiques des oligosaccharides :
-
Rôle
protecteur,
-
Rôle
stabilisateur de la matrice extracellulaire (maintient de lintégrité
tissulaire),
-
Rôle
antiprotéasique (protection du domaine extracellulaire),
-
Rôle
dans le repliement et le trafic intracellulaire des glycoprotéines,
-
Dans
la transcription de certains signaux hormonaux :
bhCG peut être
glycosylée ou non ; elle a la même affinité pour récepteur. Mais quand la bhCG est deglycosylée,
il ny a pas de stimulation de ladénylate cyclase.
-
Dans
les interactions cellulecellule et cellulematrice cellulaire,
-
Dans
la fixation péricellulaire des virus, bactéries, parasites, toxines (végétales
et bactériennes)
-
Dans
le système immunologique (par exemple : les antigènes des groupes
sanguins)
Ø Les lectines, protéines de
reconnaissance des oligosaccharides :
Loligosaccharide
est un élément de reconnaissance qui interagit avec des protéines
spécialisées : les lectines.
Les 2 plus grands types de lectines
animales :
Les lectines de
type S :
-
Leur
localisation est intracellulaire.
-
Elles
présentent une distribution très large.
-
Ce
sont des protéines solubles.
-
La
liaison est spécifique aux glucides, indépendante du Ca2+.
Les lectines de
type C :
-
Leur
localisation est membranaire ou extracellulaire.
-
Elles
présentent des domaines CRD (Carbohydrate Recognition Domain) plus ou moins
préservés (~120
aa)
-
La
liaison est dépendante du Ca2+.
v Introduction à la
glycosylation :
Ø Les
organites cellulaires impliqués :
Ce sont le
réticulum endoplasmique et lappareil de Golgi.
Dans lappareil
de Golgi, il y a 3 compartiments qui se caractérisent par un jeu
denzymes :
-
Citernes
cis,
-
Citernes
médianes,
-
Citerne
trans.
Ø Les
principales liaisons :
Les principales types de liaison
saccharidepolypeptides :
.Poly
p 19.
-
La
liaison N_glycosidique " Les plus nombreuses,
-
La
liaison O_glycosidique,
-
La
liaison O_glycosidique avec le collagène (plus
rare),
-
Lancre GPI (=
Glycosyl Phosphatidyl Inositol),
Les grandes familles selon le type de
liaison :
.Poly
p 19.
-
Type
mannose prédominant (structure minimale),
-
Type
hybride,
-
Type
complexe.
Ø Les
différents types de liaisons dans un oligosaccharide Nlié :
.Poly
p 19.
Ø Les
dérivés nucléotidiques impliqués dans la biosynthèse des oligosaccharides :
La
formation dune liaison glycosidique demande un apport dénergie libre.
Dans les
conditions physiologiques : DG = +16 kJ.mol1.
Cette
énergie libre est acquise par la transformation des unités monosaccharidiques
en dérivés nucléotidiques, comme lUDPglucose qui est nécessaire à
lallongement des chaînes de glycogène.
Ces dérivés
nucléotidiques permettront ensuite le transfert de lunité monosaccharidique
sur la protéine en cours de glycosylation, transfert catalysé par une
glycosyl_transférase.
Synthèse cytosolique des dérivés
nucléotidiques glucidiques :


Problème :
La glycosylation
sopère dans le réticulum endoplasmique et lappareil de Golgi.
Importation des
dérivés nucléotidiques dans les vésicules de lappareil de Golgi :
.Poly
p 19.
v La biosynthèse des
oligosaccharides Nliés :
Ø Les
grandes étapes :
La
synthèse des glycoprotéines Nliées se passe dans le réticulum
endoplasmique, puis dans lappareil de Golgi.
Cest un
phénomène cotraductionnel qui se déroule en 4 étapes :
j Synthèse dun précurseur oligosaccharide lié
à un lipide,
k Transfert de ce précurseur au groupe NH2 dun résidu
Asparagine du peptide en croissance,
l Elimination de quelques résidus glucidiques,
m Addition de résidus glucidiques au noyau
oligosaccharidique restant.
Ces étapes ont
pu être définies grâce à létude du virus de la stomatite vésiculaire (VSV » grippe bovine)
Ø Construction
de dolichol :
.Poly
p 20.
Chez
les animaux : 17 à 21
unités isopréniques ;
Chez
les végétaux : 14 à
24 unités isopréniques ;
Le précurseur du
dolichol est le mévalonate ; il est aussi le précurseur du cholestérol.
Synthèse du
dolichol_PP_oligosaccharide :
j .Poly
p 20.
1
Addition de N_acetylglucosamylè
2
Idem
3
Addition de 5 résidus mannose (sous forme de GTPmannose)
k .Poly
p 20.
-
Puis,
il y a un basculement total de la molécule qui ne baigne plus dans le cytosol mais
dans la lumière du RE (flipflop),
par une lectine.
-
Puis,
il y a laddition successive de résidus mannose. Cette addition se fixe sur un
dolicholè et entre par
flipflop. Ce mannose fixé est transféré sur le dolichol_PP_oligoszccharide
pour allonger la chaîne.
l .Poly
p 20.
Il y a ensuite
addition de résidus glucose. Le dolicholè_glucose bascule
à lintérieur de la lumière du RE.

Ø Transfert
de loligosaccharide sur la protéine :
.Poly
p 21.
Cet
oligosaccharide est transféré sur un résidu AsparagineaaX(sauf proline)Sérine
(séquence consensus)
du peptide en croissance.
Il sagit dun phénomène
cotraductionnel. Loligosaccharide est transféré sur lAsparagine.
Loligosaccharide protéine transférase
(OPT) :
.Poly
p 21.
Les
ribophorines se lient facilement au ribosome. Il y a la formation dun canal
par lequel la chaîne peptidique entre dans le RE.
LOST se situe
sur la membrane interne de la mitochondrie, proche du substrat de la réaction
et de la chaîne peptidique en croissance. Elle transfert loligosaccharide sur
la protéine.
Ø Remaniement
de loligosaccharide :
.Poly
p 21.
Il consiste en
la libération de 3 glucoses et 1 mannose.
" Loligosaccharide est donc constitué de 2
N_acétylglucosamines et 8 mannoses.
Le rôle des 3
résidus glucose est de signaler que loligosaccharide est complet et prêt
à être transféré sur la protéine.
Il existe des
transformations ultérieures dans lappareil de Golgi.

v La biosynthèse des
oligosaccharides Oliés :

UDP_GlcNAc

UDP
UDP_Gal
UDP
CMP_SA
CMP
GDP_Fruc
GDP
-
Addition
successive de résidus sur le peptide déjà synthétisé.
-
Il
ny a pas de séquence peptidique consensuelle.
" Les sites de
glycosylation seraient déterminés par les structures IIAIRE et IIIAIRE du polypeptide.
v Facteurs contrôlant la
glycosylation des protéines :
j La structure IAIRE détermine le
nombre et la localisation des sites potentiels de glycosylation. La séquence
consensus pour
k Il y a une spécificité despèce et
tissulaire. Le type cellulaire influence la glycosylation par un équipement
enzymatique particulier.
l La structure tridimensionnelle de la protéine
influence lampleur et le type de glycosylation. 10 à 30 % des sites de
glycosylation ne sont pas occupés.
La
répartition des différentes classes des oligosaccharides Nliés est souvent tributaire
de sites particuliers de la protéine.
v Inhibition de la
glycosylation et de la synthèse des glucoprotéines :
Inhibition des
principales étapes :
-
Synthèse
de dolicholè,
-
Synthèse
de loligosaccharide au dolicholè,
-
Synthèse
de la protéine,
-
Action
des glucosidases et des mannosidases,
-
Inhibition
du transport entre les différents compartiments cellulaires et du transport
vers la membrane.
Ø  Inhibition
de la synthèse du dolichol :
Inhibition
de la synthèse du dolichol :
Les cellules,
cultivées en présence de 25_OH Cholestérol ou de compactine, présentent une
réduction de 75 à 90% de la glycosylation des protéines simultanément à une
réduction de même amplitude de la synthèse de cholestérol et de dolicholè.
Linhibition est
levée par laddition exogène de mévalonate.
" Le dolicholè est synthétisé de novo à partir de lacétate.
Ø Inhibition
de la synthèse de loligosaccharide :

La tunicamycine
inhibe da réplication des virus à enveloppe. Elle est très spécifique de lUPPGlcNAc.
Cest un inhibiteur compétitif de très forte affinité pour lenzyme (plus forte
affinité que le substrat naturel)
Elle présenterait une structure
analogue à celle de létat de transition du substrat.
UDPGlcNAc : KM = 2,9 . 106 M
Tunicamycine :
KI = 5 . 108 M
Il y a 2
problèmes dans lemploi de la tunicamycine :
Linhibition
de la synthèse protéique (dépend du type cellulaire),
Les cellules sont +/ sensibles à la
tunicamycine. Par exemple, les cellules tumorales ou transformées présentent
une grande sensibilité.
Les analogues structuraux
du glucose peuvent être convertis par les cellules animales en
UDP2_désoxyglucose, GDP2_désoxyglucose et en dolicholP2_désoxyglucose.
Linhibition de
la glycosylation des protéines par le 2_désoxyglucose est due principalement au
GDP2_désoxyglucose qui exerce une inhibition compétitive sur laction de
Cette inhibition est levée par
laddition de mannose qui va agir à la fois en augmentant la concentration en
substrar (GDPmannose) et en diminuant la synthèse de GDP2_désoxymannose.
Le
GDP2_désoxyglucose peut également servir de donneur de glucide pour la
formation de dolicholPP(GlucNAc)2DOG :
" Pas délongation ultérieure possible,
" Inhibition de la glycosylation en détournant
le dolicholP vers la synthèse de cet oligosaccharide normal qui ne peut être
transféré aux protéines.
Remarque :
-
Il
faut se méfier lors de lutilisation de ces analogues structuraux.
-
Les
effets observés peuvent être métaboliquement induits par ces molécules qui,
indirectement, perturbent la glycosylation.
Ø Inhibition
du trafic golgien :
-
Monensine
(ionophores)
-
Brefeldine
(antibiotique)
" Inhibition de
la glycosylation terminale en bloquant le transport intracellulaire entre le RE
et lappareil de Golgi.
Inhibition de lancre GPI :
-
Le
mannosamine (compétiteur du mannose)
v Contrôle qualité des
protéines glycosylées :
La dégradation
des glycoprotéines Nliées par
Contrôle qualité du repliement des
protéines dans le RE :
.Poly
p 22.
La
formation de ponts disulfure dans les protéines par ERP57 stabilise la
structure IIIAIRE des protéines.
Les lectines
reconnaissent loligosaccharide.
v Aiguillage et adressage des
protéines glycosylées :
Ø Rôle
des résidus mannose6è dans
laiguillage des protéines :

.Poly
p 22.
Dans
le cisgolgi, les enzymes subissent des phosphorylations.
Cela leur sert à
être reconnu par des récepteurs spécifiques : récepteurs de mannose_6è.
.Poly
p 22.
Puis, il y a un bourgeonnement grâce à
des molécules : les clathrines.
Les
clathrines forment des tuskelions, qui sassemblent entre eux. Il y a la
formation de molécules qui se détachent. " Les vésicules
sont recouvertes de clathrine.
 La molécule est
dirigée vers le CURL (Comportement of Uncoating Receptor and Ligand), où les pH
sont plus acides.
La molécule est
dirigée vers le CURL (Comportement of Uncoating Receptor and Ligand), où les pH
sont plus acides.
Puis,
le mannose est recyclé et va vers le transgolgi.
Ø Adressage
des protéines glycosylées : pôle basal contre pôle basolatéral :
Une
cellule polarisée présente des interactions par rapport au pôle basal et 2
domaines principaux séparés en fonction des jonctions serrées (le domaine
apical et le domaine basolatéral)

Tri
des protéines apicales et basolatérales dans les cellules épithéliales
MDCK :
Au transgolgi, on retrouve des
vésicules destinées à aller au pôle apical et des vésicules destinées à aller
au pôle basolatéral.
Tri
des glycoprotéines apicales et basolatérales dans les hépatocytes :
Toutes les protéines sont expédiées à un
seul des pôles de la cellule.