
Retour au sommaire des cours |

Une version pdf est à votre disposition ici. |
v La microscopie :
Méthode d’étude morphologique et d’investigation fonctionnelle :
Ø Rappels :
La
microscopie est une méthode morphologique et d’investigation fonctionnelle.
L’observation est restreinte aux objets laissant passer :
-
La
lumière pour la microscopie photonique :
-
Cellules
vivantes (1 à quelques couches),
-
Coupes
fines de tissu : 5 à 10 µm.
-
Les
électrons pour la microscopie électronique à transmission :
-
Coupes
ultrafines : 50 à 100 nm de tissu,
-
Objet
entier : virus isolés, macromolécules isolées.
L’observation
d’objets entiers :
-
Lumière
réfléchie (loupe binoculaire = appareil stéréostopique) : objets vivants
ou fixés,
-
Electrons
réfléchis (microscopie à balayage ou SEM en anglais) : objets entiers
fixés.
Ø Limite
de résolution d’un microscope :
Elle est liée
aux phénomènes de diffraction de la lumière ou des électrons :


n :
indice de réfraction
a : moitié
de l’angle d’ouverture de la lentille de l’objectif
l : longueur
d’onde
L’huile d’immersion
a un indice de réfraction supérieur à 1, d diminue donc.
La microscopie
optique utilise la lumière visible :
400 < l < 800 nm.
Pour la
microscopie électronique à transmission, l est associée
aux électrons en mouvement.
![]()
V :
potentiel appliqué pour l’accélération des électrons
Dans le meilleur
des cas :
Pour
la microscopie optique : d
»
2 µm
Pour
la microscopie électronique : d » 1 nm
Plus d est
faible, plus on peut observer d’objets proches entre eux.
Le microscope
photonique utilise des lentilles de verre ; alors que le microscope
électronique à transmission utilise des lentilles électromagnétiques.
La microscopie à
fond clair nécessite souvent une coloration. La microscopie à contraste permet
l’observation vitale de cellule en culture (monocouche)
La méthode
morphologique permet de tissu en microscopique optique et microscopie
électronique à transmission.
v Méthodes morphologiques :
Ø Fixation
du tissu :
Elle se fait
avec un mélange d’acide – éthanol (dénaturation et précipitation des protéines)
et d’aldéhyde (fixation)
Microscopie
optique : Acide acétique +
Formaldéhyde
Microscopie électronique à
transmission : Tétroxyde
d’osmium + Glutaraldéhyde
Le
glutaraldéhyde réagit avec 2 fonctions amides de protéines. Il y a la formation
de réseaux inter–protéines qui emprisonnent les autres macromolécules,
permettant la conservation de la structure cellulaire.
Ø Inclusion
et confection de coupes :
L’objectif est
de solidifier le tissu fixé pour réaliser des coupes fines et régulières.
-
Pour
la microscopie optique, l’inclusion se fait dans la paraffine.
-
Pour
la microscopie électronique à transmission, l’inclusion se fait dans de la
résine (Epon)
Ces produits
sont hydrophobes (miscibles dans les hydrocarbures) Il est donc nécessaire de
faire une déshydratation préalable avec de l’éthanol qui a cet avantage d’être
miscible dans l’eau mais aussi dans les hydrocarbures.
Milieu
aqueux "
Ethanol à 70% " Ethanol à 95%
" Ethanol à 100% "
Xylène ou Toluène
=
hydrocarbures (2 bains)
Puis : – Soit de la paraffine à
– Soit de la résine liquide " Polymérisation à chaud.
Confection des coupes :
-
Pour
la microscopie optique, on utilise un microtome (rasoir) pour obtenir des
coupes sériées de 5 à 10 µm que l’on récupère à l’aide d’un pinceau.
-
Pour
la microscopie électronique à transmission, on utilise un ultramicrotome
(diamant taillé) pour obtenir des coupes que l’on récupère dans une
« piscine » par le biais d’un éclairage oblique (irisation des coupes
comme une trace d’hydrocarbure dans une
flaque d’eau) et que l’on « pêche » au pinceau.
Les coupes sont ensuite déposées sur une
grille de cuivre ou d’or.
Ø Coloration
– contraste :
-
Pour la
microscopie optique, on utilise la coloration.
" Absorption de
certaines longueurs d’onde de la lumière par un groupement chromophore (phore = qui génère) Le chromophore est
un groupement moléculaire constitué de doubles liaisons conjuguées, de composés
aromatiques.
" Colorants
basiques (cations), comme le bleu de toluidine ou l’hématoxyline, qui se fixent
sur les molécules du tissu chargées négativement.
" Colorants acides
(anions), comme l’éosine, qui se fixent sur les molécules du tissu chargées
positivement.
" Autres
colorants : molécules hydrophobes (comme les lipides) ou intercalant de
l’ADN.
-
Pour la
microscopie électronique à transmission, on utilise le contraste.
" Contrastants
(cations), comme l’acétate d’uranyl ou l’acétate de plomb, qui se fixent sur
les molécules du tissu chargées négativement.
Il se pose un
problème pour les colorants (MO) : ce sont des molécules hydrophiles.
" Il faut un déparaffinage et une
hydratation :
Xylène
" Ethanol à 100% " Ethanol à 90%
" Ethanol à 70%
" Eau " Solution de colorant " Lavages
" Ethanol à 70%
" Ethanol à 95%
" Ethanol à 100% " Xylène ou Toluène
Pour la
microscopie électronique, on garde la résine. On pose le contrastant et on fait
des lavages. La tétrodoxine d’osmium réagit surtout avec les phospholipides
membranaires, ce qui permet un beau marquage délimitant la cellule (avec un
double trait au fort grossissement : marquage sur les surfaces de la
membrane)
v Etude
de surface en microscopie électronique à transmission (MET) :
Ø Cryofracture
et cryodécapage :
Le
tissu doit être dur comme un caillou. On donne un coup entraînant une cassure là
où c’est le plus fragile :
-
Entre
2 cellules (quand il y en a plusieurs),
-
Ou
au sein de la membrane (pour une seule cellule), entre les 2 couches de
phospholipides.
Puis, le
cryodécapage consiste en la sublimation de l’eau à l’endroit de la cassure.
Ø Ombrage
puis obtention d’une réplique :
L’ombrage
consiste en la projection de gaz de métal de manière oblique.
La réplique est
ensuite obtenue avec la pose d’un film de carbone et la dissolution de
l’échantillon biologique.
Ø Observation
d’objets entiers en MET :
Elle
est possible pour peu qu’ils soient de petite taille (quelques dizaines de nm),
tels que les virus isolés, les organites isolés, les macromolécules isolées
(comme l’ADN)
Il faut un contraste négatif :
Goutte
de solution de métaux lourds = phosphotungsate
![]()
Séchage sous vide
Grille
+ film fin de carbone " Etude de la
forme de l’objet
v Localisation
cytoplasmique de molécules spécifiques :
Ø Cytochimie :
= Utilisation de
réactions chimiques sur des coupes histologiques pour mettre en évidence des
grandes classes de macromolécules (acide nucléique, polysaccharide, lipide,
etc.)
Ø Histoenzymologie
– Cytoenzymologie :
-
Détection
d’enzymes in situ,
-
Réaction
enzymatique effectuée sur des coupes de tissus.
On utilise des
tissus congelés (coupes à congélation réalisées à l’aide d’un cryostat) On
incube les coupes de tissus avec une substance spécifique S générant un produit
P qui précipite et qui est soit coloré (MO), soit opaque aux électrons (MET)
La phosphatase
permet de différencier les lysosomes des autres vésicules qui leur ressemblent
comme les peroxysomes.
Ø Immunohistochimie
– immunocytochimie :
Elle consiste à
détecter sur des coupes de tissu ou des cellules entières (préalablement fixées
et perméabilisées) un antigène cellulaire spécifique à l’aide d’un antisérum (=
anticorps) dirigé contre cet antigène.
Le déterminant
antigénique est appelé épitote. Il
s’agit d’une protéine reconnue par l’anticorps.
Le plasma
correspond au sérum pourvu des protéines permettant la coagulation.
Sang " Centrifugation " Plasma
Sang " Coagulation
" Sérum
Un peptide n’est
pas immunogène en soi : il faut le coupler à une grosse protéine (=
protéine porteuse)
On
préfère la méthode indirecte à la méthode directe. En effet, la méthode directe
est moins sensible. La méthode indirecte permet d’amplifier le signal.
Un autre avantage est que l’anticorps IIAIRE marqué
fonctionne sur toutes les immunoglobulines du lapin. C’est pratique pour les
préparations quand on sait que le couplage d’une protéine à une autre molécule
est une réaction chimique complexe et que la protéine est fragile à différents
traitements.
Un lavage après
l’ajout et l’incubation de chaque anticorps est nécessaire pour éviter les
liaisons non spécifiques.
-
Le
fluorochrome est une molécule qui
absorbe une longueur d’onde (souvent dans les UV) et restitue une partie de
l’énergie absorbée sous forme d’une autre longueur d’onde (souvent dans le
visible)
E1 = h.n1 = h . c/l1 "
Fluorochrome " E2 = h.n 2
= h . c/l2
E1 > E2 Þ l1 < l2
-
Une
enzyme peut être utilisée en MO et
en MET.
-
Les
particules d’or colloïdal présentent
une masse atomique qui a tendance à être opaque aux électrons (utilisation en
MET)
§ Immunofluorescence :
Le
faisceau lumineux (laser) balaie la surface de l’échantillon. La lumière
réfléchie ou émise (fluorescence) provenant de chaque point de la surface
balayée est recueillie par un détecteur, numérisée et stockée dans la mémoire
de l’ordinateur.
Seuls les
rayons–image venant du plan focal (qui est confocal avec le plan du pinhole =
trou d’aiguille) parviennent au détecteur. Cela permet une galerie de sections
optiques qui permettent de construire une image 3D. et l’élimination du signal
fluorescent provenant d’autres plans.
Ø Hybridation
in situ :
Elle consiste à
détecter sur des coupes de tissu ou des cellules entières (préalablement fixées
et perméabilisées) des ARNM spécifiques
avec une sonde nucléique complémentaire marquée radioactivement (= oligonucléotide
antisens)
-
Sonde
radioactive " Détection par autoradiographie,
-
Sonde
fluorescente " Détection au microscope à fluorescence (avec
un microscope confocal)
La sonde est une
séquence d’ADN. Une sonde antisens va s’hybrider alors qu’une sonde sens ne
présentera pas d’hybridation spécifique (= témoin négatif nécessaire)
Pour marquer
radioactivement une sonde, on utilise de l’ATP marqué au 32P en position g et une oligonucléotide–kinase
qui transfert ce phosphate radioactif vers un oligonucléotide :
Lame
+ coupes sériées de tissu déparaffinés et réhydratés
$
Ajout
de la sonde et de tampon salin d’hybridation
$
Incubation à
50–65°C (selon la longueur de la sonde)
" Environ la température de fusion de la sonde
$
Lavages à la
même température
Pour enlever
tout ce n’est pas lié de manière spécifique
$
Soit une
autoradiographie
$
Soit une
observation au microscope à épifluorescence (ou confocal)
$
Soit une
réaction immunochimique
§ Autoradiographie :
Cette
technique permet la détection de molécules radioactives. Si on incube un tissu
ou des cellules en culture avec :
-
De la leucine
tritiée (3H–Leu) :
Les protéines
synthétisées pendant l’incubation sont radioactives suite à l’incorporation de
la leucine tritiée.
Pourquoi la
leucine ? Parce qu’elle est retrouvée dans toutes les protéines et qu’elle
est peu métabolisée (contrairement à la glycine qui est un glucoformateur)
-
De la
désoxythymidine tritiée :
L’ADN
synthétisée pendant l’incubation est radioactive.
Pourquoi la
désoxythimidine ? Parce qu’elle est retrouvée dans toutes les protéines et
qu’elle est peu métabolisée (contrairement à l’adénosine qui peut être
transfomée pour l’ARN)
-
De l’uridine
tritiée :
Les ARN
synthétisés pendant l’incubation sont radioactifs.
-
Des oses
tritiés :
Les polyosides
ou les oligosaccharides synthétisés pendant l’incubation sont radioactifs (mais
pas de glucose tritié parce qu’il est trop métabolisable)
Tissu " Incubation" Fixation" Déshydratation" Inclusion" Coupe" déparaffinage
 $
$
Révélation et observation! Exposition! Lame recouverte
d’une
fine couche d’émulsion photo
v Le microscope électronique
à balayage (MEB) :
(= SEM en
anglais)
Il
permet d’étudier :
-
La
surface d’objets fixés entiers,
-
La
structure 3D de ces objets.
Il repose sur
l’analyse des électrons réfléchis à partir d’objets fixés, déshydratés et
recouverts d’un film fin de métal lourd (dans le vide)
v Fractionnement
subcellulaire et cellulaire :
Ø Fractionnement
subcellulaire :
Ø Fractionnement
cellulaire :
j Dissociation du tissu :
Dans
un milieu isotonique
-
Incubation
en présence de protéases (qui hydrolysent les protéines des jonctions
intercellulaires)
-
Incubation
dans un tampon en présence de chélateurs de Ca2+ (EDTA)
k Centrifugation de la suspension cellulaire sur
un gradient préformé de Percoll* :
Les cellules sédimentent
en fonction de leur densité.
v Culture cellulaire :
Il
faut tout d’abord une dissociation des cellules à partir d’un tissu :
-
Soit
avec un traitement par des enzymes protéolytiques (pronase, collagénase,
trypsine),
-
Soit
avec un traitement par un tampon en présence d’EDTA.
Puis,
on effectue des lavages par centrifugation. La suspension est ensuite déposée
sur des boîtes de culture. Si ce milieu de culture est adéquat, les cellules
s’attachent au plastique et se divisent.
= Culture IAIRE
(de fibroblastes,
de cellules épithéliales, etc. de vertébrés.
Pour les
invertébrés, on n’y arrive que chez la drosophile)
A confluence, on
peut détacher des cellules (traitement à la tripsine) et le répliquer à moindre
densité.
= Culture IIAIRE
NB : On peut réaliser ce processus un nombre de
fois fini (50 à 100 fois)
Au
cours de la culture, quelques cellules (altérées) acquièrent une capacité à se
diviser rapidement, et une capacité de se répliquer de manière non limitée.
= Lignée cellulaire
(Cellules
néoblastes, cellules cancéreuses,
cellules
transformées par un oncogène, cellules souches)
Une
lignée cellulaire constitue une source homogène de cellules. Elle permet :
-
L’étude
de la réponse cellulaire aux signaux extracellulaires (hormones, facteurs de
croissance) au niveau de :
-
La
prolifération cellulaire,
-
La
synthèse protéique,
-
Le
transport cellulaire,
-
La
sécrétion de protéines.
-
L’étude
des mécanismes moléculaires de transduction du signal extracellulaire (manière
dont la cellule intègre et traduit ces signaux) :
-
Voie
de signalisation,
-
Acteurs
moléculaires mis en jeu.
Ø Milieu
de culture :
Il doit être
stérile, présenter une osmolarité et un pH compatibles ainsi que des ions
inorganiques et des métabolites essentiels au métabolisme cellulaire.
Exemple :
-
Tampon
(Hepes), pH 7,2,
-
Ions NaCl, KCl,
NaH2PO4, NaHCO3…
-
Métabolites
: glucose (10mM), acides aminés, vitamines, etc.
-
10%
de sérum de veau fœtal (pour la présence de facteurs de croissance),
-
Rouge
neutre (indicateur de pH),
-
Antibiotiques
et antifongiques.
Les cultures se
font dans un atmosphère stérile, humide, avec 5% de CO2 et
Exemple :
On
peut également étudier l’effet du facteur de croissance sur :
-
La synthèse
protéique totale : étude de l’incorporation de leucine tritiée (même
protocole),
-
La synthèse
d’une protéine particulière : électrophorèse de l’extrait cellulaire,
puis « Western blotting » et détection par un anticorps spécifique et
autoradiographie
-
La transcription
d’un gène particulier : extraction des ARN, électrophorèse, « Northern
blotting », hybridation avec une sonde spécifique et autoradiographie.
v Introduction de molécules
dans les cellules vivantes :
(Molécules pour
lesquels la membrane plasmique n’est pas perméable)
j Micro–injection à l’aide d’une micropipette
:
" Injection
d’ADN, d’anticorps, de fluorochromes (quelques mL)
Elle nécessite un appareillage particulier
et une adresse de manipulation.
k Electroporation :
Les
cellules, dans une solution (avec le moins de sels possibles) contenant la
molécule à transférer, sont placées dans une cuvette au niveau de laquelle un
bref choc électrique est appliqué (décharge de condensateur)
-
Formation
de pores transitoires dans les membranes plasmiques,
-
Entrée
de la molécule dans la cellule,
-
La
membrane se reforme.
l Lipofection :
Il
s’agit de la formation de vésicules (phospholipides) ou de peptides capables de
contenir ou de s’associer avec les molécules à transférer.
En présence de cellules, ces composants
s’associent aux membranes plasmiques, puis fusionnent et délivrent les
molécules à l’intérieur de la cellule.
m Bombardement :
Des particules
s’or recouvertes de l’ADN à transférer sont bombardées vers les cellules. Les
particules et l’ADN sont ainsi introduites dans la cellule.
v Applications :
Ø Transfert
d’ADN (plasmide) dans des cellules eucaryotes :
La transfection = introduction d’ADN.
j Construction plasmidique :
Le vecteur est
un élément capable de se répliquer de manière autonome. Le plasmide est un
vecteur bactérien.
k Production du plasmide :
Cette
expérience montre qu’il est possible de produire une protéine dans une cellule
eucaryote dès lors que l’on possède son ADNC.
Si on ajoute des
séquences étiquettes ou si on fusionne l’ADNC codant une
protéine à l’ADNC de
Promoteur / Région transcrite :
-
Tout
gène chez un eucaryote est de l’ADN double brin : un brin matrice (ou
antisens), un brin sens. L’ARN polymérase se sert du brin matrice pour faire un
brin complémentaire.
-
La
région non transcrite se situe en amont de la région transcrite. C’est souvent
une région régulatrice (= promoteur) avec la présence de facteurs de
transcription.
-
La
région transcrite d’un gène de type II génère un ARNM, c’est–à–dire
un ARN traduit en protéine.
-
La
transcription commence au site d’initiation et se termine au site de
terminaison. Avant la terminaison, il y a un signal de poly–adénylation.
Elle amène à la
création d’un ARN prémessager, coiffé et poly–adénylé. Il est labile,
c’est–à–dire qu’il a une durée de vie très courte.
-
L’intron
est d’une région transcrite du gène mais qui n’est pas conservée au niveau de
l’ARN mature. Il est éliminé lors de l’épissage. Il existe un épissage
alternatif : une région peut être un intron dans une cellule et un exon
dans une autre.
-
En
ce qui concerne la traduction, il existe une région 5’UTR qui est une région
non traduite. Elle est en amont du codon AUG utilisé, qui n’est pas forcément
le 1er rencontré. Par contre, le 1er codon STOP rencontré
marque la fin de la traduction.
Ces régions
servent essentiellement à la stabilité de l’ARN.
-
La
traduction conduit à la synthèse d’une ribonucléoprotéine qui passe dans le
cytosol et donne une protéine (en général, un précurseur protéique) qui va
encore subir des modifications post–traductionnelles. Les précurseurs
protéiques sont souvent non fonctionnels et leur durée de vie est limitée.
-
Pour
connaître la séquence du précurseur, il faut connaître la séquence de l’ARNM mature.
ADN génomique " Banque d’ADN génomique Þ Etude de l’organisation du gène
(nombre
d’exons, d’introns, etc.)
ARNM " Banque d’ADNC pour un tissu
Þ Etude de la séquence de précurseur de
protéine,
Þ Etude de l’expression du gène correspondant
(par Northern Blotting, par hybridation in
situ),
Þ Production de la protéine dans des cellules
procaryotes ou eucaryote (protéines recombinantes)
La
majorité des protéines cellulaires sont synthétisées sous forme de protéines
précurseurs plus longues par rapport à la protéine mature et fonctionnelle.
Ces séquences supplémentaires, qui sont
ensuite clivées, sont généralement des séquences « d’adressage
cellulaire » servant à l’adoption d’une structure 3D ou permettant un
stockage sous forme de protéines inactives.
v Construction d’une banque
d’ADNC :
v Clonage d’un ADNC par criblage d’une banque
d’ADNC :
Elle
nécessite de disposer d’une sonde :
-
Soit un ADNC codant une
protéine homologue chez une autre espèce (proche d’un point de vue
phylogénétique), comme l’ADNC codant la
pro–insuline chez le rat pour cribler une banque d’ADNC de pancréas
humain.
-
Soit, si on dispose
de la séquence partielle de la protéine, un oligonucléotide synthétisé à partir
de cette séquence.
-
Soit par une
approche PCR, si on dispose de la séquence partielle de fragment peptidique de
la protéine.
v Le transit intracellulaire :
les séquences d’adressage :
Les protéines
doivent avoir une structure 3D adéquat et être localisées dans le bon
compartiment cellulaire.
Les protéines
nucléaires sont des enzymes impliquées dans la réplication du génome et dans sa
transcription. Certaines protéines doivent être transloquées suite à une
activité donnée. Certaines font la navette, comme les protéines qui habillent
les ARN.
Les
mitochondries et les plastes sont qualifiées de semi–autonomes car ils ont un
génome et de la machinerie permettant la réplication, la transcription et la
traduction.
90% des protéines sont codées par des
gènes nucléaires. Pour ces protéines, il existe un signal d’adressage qu’elles
puissent rejoindre la mitochondrie ou le chloroplaste.
De
plus, différents compartiments existent :
-
La
mitochondrie :
la protéine synthétisée peut être destinée à la membrane mitochondriale externe
ou interne ou à la matrice ou à l’espace intermembranaire. La protéine, sous
forme de précurseur, doit être accompagnée de l’information d’adressage.
-
Le
peroxysome :
le contenu biochimique renferme des enzymes de type oxydase qui oxydent le
substrat en utilisant l’O2. Le peroxysome
est impliqué dans l’oxydation de nombreux substrats (détoxication de l’éthanol,
etc.) Il est important dans l’oxydation des acides gras.
Chez les végétaux :
Ils sont capables
de faire des oses à partir des lipides et présentent des glycoxysomes. Le
glycolate est un intermédiaire de la photosynthèse et donne du glycoxylate (=
carburant pour la mitochondrie)
Le
peroxysome est l’organe de la photosynthèse. Les enzymes intervenant sont
synthétisées dans le hyaloplasme.
D’autres enzymes importantes sont
destinées à être sécrétées par la cellule, les protéines membranaires, les
protéines du REG, du golgi, des lysosomes. Toutes ces enzymes sont synthétisées
sous forme de précurseurs.
L’adressage
des protéines dans le bon compartiment cellulaire est crucial pour le
fonctionnement cellulaire. Les ARN étant traduits dans le hyaloplasme, où se
trouvent tous les éléments de la machinerie traductionnelle (ribosomes,
ARNT, acides aminés, facteurs de
traduction, etc.)
Il y a la nécessité de séquence
d’adressage.
L’examen de la
comparaison de séquences de divers précurseurs de protéines ayant une même
localisation cellulaire a permis de définir les possibles « séquence
d’adressage ».
Séquences signalisatrices :
|
Organite cible |
Nature de la séquence Motif d’adressage |
Localisation |
Présence dans la protéine mature |
|
Noyau |
Groupe de 5
acides aminés ou 2 groupes d’acides aminés basiques séparés par ~10 acides
aminés |
Interne |
Oui |
|
Mitochondrie |
3 à 5 acides
aminés basiques non consécutifs plus souvent Sérine ou Thréonine |
N–terminale |
Non |
|
Chloroplaste |
Pas de motif
précis, riche en Sérine, en Thréonine et en acides aminés
hydrophobes pourvus en Glutamate
et en Aspartate. |
N–terminale |
Non |
|
Peroxysome |
Sérine –
Lysine – Leucine |
C–terminale |
Oui |
|
REG : Protéines
lysosomyales Protéines
sécrétées Protéines membranaires |
Peptide signal
variable en taille : 15 à 30
acides aminés et en séquence : 1
ou quelques acides aminés chargés et 6 à 12 acides aminés hydrophobes
(important pour la translocation dans la lumière du REG) |
N–terminale |
Non |
La
séquence d’adressage peut être :
-
Une
séquence additionnelle sur le précurseur de la protéine mature,
-
Un
motif peptidique intrinsèque dans la protéine mature.
v Transit
noyau–hyaloplasme :
Ø Le
complexe de pore nucléaire :
Ø Mécanisme
d’adressage :
Il
y a 4 protéines différentes :
-
L’inportine
a,
-
L’importine
b,
-
Un
facteur de transport nucléaire,
-
Une
protéine G qui se lie au GTP (ou GDP) et qui adopte 2 conformations
différentes.
Il
y a aussi des enzymes :
-
-
Un
facteur d’échange de nucléotides = RCC1.
Les
protéines qui font la navette entre le noyau et le hyaloplasme ont 2
étiquettes. La protéine qui est transportée d’un endroit à un autre est appelée
protéine cargo, et présente une séquence de localisation nucléaire (SLN)
Elle est transportée par association des
importines a
et b
via les pores nucléaires. Une fois dans le noyau, il y a dissociation par
l’interaction d’une protéine G associée à un GDP qui l’échange avec un GTP. La
protéine présente alors une conformation permettant l’association avec
l’importine b.
L’association de l’importine b permet d’envoyer à nouveau dans
le noyau. L’enzyme Ran GAP hydrolyse le GTP en GDP.
v Transport vers la
mitochondrie :
Il
existe une séquence d’adressage au niveau d’une protéine précurseur.
Pour que la
protéine traverse des canaux protéiques, elle doit être non conformée. Pour
cela, au niveau du hyaloplasme, il y a des liaisons avec des protéines caperons
qui aident d’autres protéines à adopter leur conformation 3D. Ces chaperons
sont des Heat Shock Cognate (HSC)
Les HSP (Heat Shock Protein) servent à empêcher
la dégradation des protéines. Elles ne sont pas régulées en cas de stress.
Elles se fixent à la protéine synthétisée et l’empêchent d’être conformée de
manière 3D.
Les MSF (Mitochondrial import Stimulation Factor)
conduisent à envoyer la protéine à la mitochondrie. Il existe un récepteur
mitochondrial qui peut interagir avec le MSF ou avec la séquence
initialisatrice, il s’agit du TOM (Transport
outler membrane)
Une protéine
canal, le translocon, assure le transfert de la protéine mitochondriale dans la
matrice car il existe des sites de contact entre les membranes interne et
externe via ces translocons.
Arrivée dans la
matrice, la séquence étiquette est clivée par une protéase.
Transport vers les membranes
mitochondriales :
-
Vers la membrane
interne :
Il y a un transport dans la matrice puis le mécanisme d’intégration est
inconnu.
-
Vers la membrane
externe :
Il y a une séquence étiquette de la matrice qui ne sera pas clivée en position
N–terminale.
Transport vers l’espace intermembranaire
des mitochondries :
Le
transfert dans la matrice se fait comme celui des protéines matricielles.
Soit la protéine est complètement
transférée et intégrée dans l’espace intermembranaire, soit il y a un blocage
du transfert entraînant une intégration dans la bicouche et une coupure pour
libérer la protéine.
v Transport vers les
peroxysomes :
Il y a la
présence d’une étiquette C–terminale dont le motif est
sérine–lysine–leucine (S–K–L)
La catalase est
composée de 4 sous–unités avec un atome de fer mais sans hème.
Un récepteur au niveau de la membrane du
peroxysome permet l’entrée du complexe au niveau de la lumière du peroxysome.
Puis le récepteur retourne dans le hyaloplasme.
v Rappel – généralités :
Ø Expérience
de Pulse Chase :
Le REG,
l’appareil de Golgi et les vésicules de sécrétion ont un rôle dans la synthèse
et la sécrétion des protéines.
L’expérience
est réalisée sur des pancréas exocrine de mammifères. Si on incube des
fragments de pancréas sur un milieu de culture avec de la leucine tritiée. Les
protéines synthétisées sont radioactives suite à l’incorporation.
Le pulse chase
nécessite un marquage court car on veut montrer le transport des protéines au
cours du temps.
On transfert ensuite des fragments
d’organes dans un même milieu de culture contenant en excès de la leucine non
radioactive. Cela permet de noyer complètement la leucine tritiée résiduelle
non incorporées.
Pendant le
chase, les protéines nouvellement synthétisées ne sont plus radioactives.
Seules sont radioactives les protéines qui ont été synthétisées pendant le
pulse.
On prélève un
fragment de tissu après 30 à 60 minutes de chase dans un milieu de fixation, on
effectue des coupes sur lesquelles on pratique une autoradiographie.
" On localise la
radioactivité et donc le parcours de cette radioactivité au cours du temps.
Les protéines
destinées à être excrétées sont synthétisées au niveau du REG, sont
transportées dans le golgi puis au niveau des vésicules de sécrétion.
Il
existe 2 voies de sécrétion dans une cellule dont la sécrétion
constitutive (= sécrétion continue de protéines) que l’on retrouve dans :
-
Les
hépatocytes qui sécrètent de manière continue de l’albumine, des lipoprotéines,
etc.
-
L’intestin
qui sécrètent des lipoprotéines.
-
Les
lymphocytes B (= plasmocytes différenciés dans la sécrétion d’immunoglobulines)
-
Les
fibroblastes.
-
Les
cellules du foie qui sécrètent les protéines de
La
synthèse continue constitue :
-
Un
réservoir pour les hormones et les facteurs de différenciation,
-
Un
trayage protéique nécessaire à la migration cellulaire,
-
Cohésion
entre les cellules,
-
Sécrétion
régulée (par exocytose de vésicules de sécrétion déclenchée par un stimulus
extracellulaire)
Sécrétion de protéines ou de
peptides :
-
Les
cellules a
et b
des îlots de langerhans (pancréas), la neurohypophyse sécrétant de l’oxytocyne,
la prolactine,
-
Les
cellules exocrines du pancréas (cellules acineuses sécrétant les enzymes
digestives, suite à un stimulus de nature hormonale)
-
Les
cellules trypsinogènes et chymotrypsinogènes,
-
Les
cellules de glandes mammaires qui sécrètent la caséine, la lactalbumine.
Les levures :
Ce sont des
cellules primitives qui se manipulent comme les bactéries. Il existe un certain
nombre de mutants thermosensibles déficients pour la sécrétion des protéines.
Ces mutants sécrètent les protéines selon la température du milieu de culture.
Ils sont
fonctionnels à une température permissive et non fonctionnels à une température
non permissive :
-
S’ils
sont cultivés à une température permissive, il y a une croissance normale.
-
S’ils
sont cultivés à une température permissive, il y a un arrêt de la croissance.
-
Pour
certains mutants, les protéines sont synthétisées au niveau du hyaloplasme et
sont transportées dans le REG.
-
Pour
d’autres, les protéines sont synthétisées au niveau du REG.
-
D’autres
accumulent des protéines au niveau des vésicules de transition entre le REG et
le golgi. Ces mutants présentent une déficience s’ils sont dans l’incapacité de
fusionner les vésicules de transition avec les sacs golgiens.
-
D’autres
accumulent des protéines au niveau du golgi. Ces mutants présentent une
déficience s’il y a absence de transfert entre le golgi et les vésicules de
sécrétion.
" Ces différents mutants permettent de
décortiquer les mécanismes moléculaires impliqués la sécrétion de protéines
dans une cellule.
Ø Clonage
par complémentation (chez la levure) :
Il y a la
construction d’une banque d’ADNC de levure
fonctionnelle dans un plasmide d’expression chez la levure.
Il
s’agit d’un plasmide avec :
-
Un
promoteur qui permet la transcription du gène,
-
Un
site de clonage pour l’insertion,
-
Une
origine de réplication (ORI),
-
Un
gène de résistance à l’ampicilline pour la production de beaucoup de protéines
dans les bactéries (mais dans une cellule de levure, il se répliquera en même
temps que la levure),
-
Un
marqueur de sélection de levure : une enzyme permettant la synthèse d’acides
aminés. Leu2 code une enzyme permettant à la levure de pousser sur un
milieu de culture dépourvue de leucine.
Si les levures
accumulent les protéines au niveau du REG,
quel gène
empêche le transfert ?
Jamais 2
molécules de plasmides n’entrent dans la cellule. Seule une molécule sur 1000
est transformée.
De la boîte
mère, on réplique 2 boîtes sans leucine : une boîte à
Si les levures poussent : la
mutation n’existe plus.
Si la mutation
des levures établit un blocage de croissance et la protéine lève la mutation,
alors cette protéine est impliquée dans le transfert. On effectue un séquençage
du gène pour identifier cette protéine.
Ø Synthèse
des protéines membranaires :
Pulse
chase :
" Isolement des
différents organites cellulaires,
" Incubation des
extraits d’organites en présence anticorps,
" Comptage de la
radioactivité associée au culot.
Conclusion :
La radioactivité
spécifique est maximale dans la fraction « REG » puis dans la
fraction « appareil de golgi » puis dans la fraction « membrane
plasmique ».
Ø Structure
des membranes biologiques :
Les protéines transmembranaires :
Avec un ou
plusieurs domaines transmembranaires.
D Il faut faire l’orientation de la
membrane : la lumière du RE correspond à l’extérieur de la cellule et le
cytoplasme correspond à l’intérieur de la cellule.
La protéine
possède une orientation N et C–terminale. Elle peut être N–terminale au domaine
extérieur et C–terminale au domaine intérieur, ou l’inverse.
Les protéines
périphériques :
Elles sont
attachées à la membrane via une liaison avec un lipide. Seuls les domaines en
contact avec le milieu extérieur être glycosylés.
Exemple :
Les GLUT sont
des protéines à 7 domaines transmembranaires et sont les récepteurs de la
majorité des hormones.
-
La
liaison co–traductionnelle se fait en même temps que la synthèse des protéines.
-
La
liaison post–traductionnelle se fait quand la protéine est synthétisée.
Le flip–flop
correspond au transfert d’un feuillet à l’autre.
Schéma général
du transfert des protéines :
REG " Golgi " Vésicule (l’inverse
= transport rétrograde)
Il
n’y a jamais de changement de la polarité physique de la membrane.
Cis–Golgi
réticulum " Cis–Golgi
" Golgi médian
" Golgi médian " Trans–Golgi réticulum
Le trans–Golgi
réticulum génère des vésicules qui fusionnent avec la membrane plasmique.
Le transport
rétrograde sert à rapatrier les protéines qui sont allées trop loin dans leur
cheminement.
v Le REG :
Ø Transfert
des protéines de la lumière du REG :
Traduction in
vitro
(extrait cytosolique)
$
Ajout de microsomes
$
Absence de
transfert
Le peptide
signal n’est pas clivé
Traduction in
vitro
(extrait
cytosolique+microsomes)
d’un ARNM codant une
protéine sécrétée
$
Transfert et
clivage du peptide signal
Þ Mécanisme co–traductionnel
-
-
La
fixation de la protéine HSC 70 est nécessaire pour avoir une conformation
fonctionnelle.
-
Il
y a la présence d’un oligosaccharide : pendant le transfert, un autre
mécanisme se réalise : la glycosylation.
Ø Insertion
membranaire des protéines :
Insertion de protéines à un domaine
transmembranaire :
Le système le
plus simple est une orientation de la région C–terminale dans le cytosol.
Le système le
plus complexe est une orientation de la région C–terminale dans la lumière. Il
n’y a pas de peptide signal N–terminal, mais il est interne et il est capable
de se lier à
Insertion de protéines à plusieurs
domaines transmembranaires :
Il y a des séquences
signal interne. Les parties en contact avec la lumière peuvent être
glycosylées.
Ø Modification
post–traductionnelle et co–traductionnelles :
§ Clivage du peptide
signal :
Dès son entrée
dans la lumière, le peptide signal est clivé par une signal–peptidase, une
enzyme associée au translocon.
§ Synthèse de l’oligosaccharide
sur le dolichol :
Le dolichol est
un lipide membranaire. Après flip–flop, le peptide se retrouve coté de la
lumière. Grâce à des enzymes membranaires (glycosyltransférases), la partie
glycosidique est transférée sur une protéine.
§ Transfert de
l’oligosaccharide sur la protéine :
Le transfert
s’effectue grâce à une glycosyltransférase sur un résidu asparagine. Il s’agit
d’une N–glycosylation dont la séquence cible est : Asparagine – X –
Sérine/Thréonine.
Ne seront
glycosylées que les protéines en contact avec la lumière du REG. Les protéines
du cytosol ne sont jamais glycosylées (sauf exceptions)
§ Hydroxylation :
Elle
n’est pas effectuée sur toutes les protéines. Elle est faite notamment
sur :
-
L’élastine
qui assure une élasticité du tissu conjonctif et qui sont reliées entre elles
par des liaisons covalentes, formant un réseau,
-
Le
collagène qui est une molécule abondante dans
Le procollagène
subit des hydroxylations. Le motif GPX est très répété dans le collagène :
de nombreux sites d’hydroxylation vont transformer une proline en
hydroxyproline.
L’hydroxylation
ne se fait que dans la lumière du REG. Elle nécessite de l’O2, une
hydroxylase, une co–enzyme : la vitamine C et de l’a_cétoglutarate.
Puis le
procollagène subit une maturation pour devenir le collagène. Cette maturation
consiste en la formation de liaisons covalentes par une lysyl–oxydase qui fait
des ponts entre les lysines.
§ Repliement des
protéines :
Toute protéine
n’ayant pas de structure 3D ne sera pas fonctionnelle. Cela implique les
protéines chaperons.
Au
niveau de la lumière du REG, des enzymes permettant l’oxydation des groupements
SH pour permettre la formation de ponts S–S qui consolident la structure 3D
mais ces ponts ne sont pas indispensables.
Seules les
protéines destinées à être sécrétées auront des ponts S–S car le milieu
cytosolique (intérieur de la cellule) est réducteur : les cystéines
restent sous la forme SH. La lumière est un milieu oxydé.
Les protéines disulfides isomérases
assurent la formation des ponts S–S.
Les
protéines mal–conformées restent associées aux chaperons et sont retenues au
REG puis exportées par le translocon dans le cytosol où elles seront dégradées
par le protéasome.
-
Les
protéasomes concernent les protéines intracellulaires,
-
Les
lysosomes concernent les protéines extracellulaires.
Il s’agit d’un
système relativement complexe que l’on trouve dans le cytosol et le
nucléoplasme. Il consiste en la dégradation des protéines qui vont subir une
ubiquitisation.
Ubiquine =
dans toutes les cellules et dont la structure est très conservée.
L’ubiquitine
marque les protéines destinées à la dégradation. Ce marquage requiert des
enzymes et de l’ATP. Elle se lie au NH2 d’une lysine et
non au NH2 terminal.
Le protéasome
est constitué d’un assemblage de protéines, particules régulatrices. Ces
particules reconnaissent l’ubiquitine et renferment des ATPases qui dénaturent
les protéines qui sont ensuite envoyées dans la structure centrale qui contient
des protéases. Au final, on obtient des petits peptides et de l’ubiquitine. Les
peptides sont ensuite dégradés en acides aminés par une peptidase cytosolique
ou par une intervention du système immunitaire.
v L’appareil de Golgi :
C’est
un empilement de saccules aplatis. La lumière des saccules correspond à
l’extérieur de la cellule. Il y a aussi des vésicules golgiennes qui fusionnent
avec les saccules.
Il s’agit d’un
organite polarisé qui présente :
-
Une
face de formation = le cis–Golgi (là où se forme le golgi),
-
Une
face de maturation = le trans–Golgi.
Ø Modification
post–traductionnelles dans l’appareil de Golgi :
§ Glycosylations :
·
N–glycosylations
:
La
glycosyl–transférase élimine 3 mannoses.
§ Synthèse de
glycolipides :
Il
est lié à des résidus glucidiques. Il y a une O–glycosylation sur un groupement
OH appartenant à une sérine ou une thréonine ou une hydroxyproline. Les
O–glycosylations sont faites uniquement dans l’appareil de golgi et de manière
séquentielle par ajout d’oses.
Elles sont très variables et concernent
la séquence des oses. Ces O–glycosylations débutent dans le cis–Golgi et se
terminent dans le trans–Golgi.
Le système ABO
consiste en une O–glycosylation.
§ Phosphorylation des
glycoprotéines lysosomiales :
La
protéine va dans le lysosome si elle est reconnue par
La phosphodiestérase permet le clivage
du N–acétylglucosaime et la protéine est phosphorylée. Il y a la présence d’un
système d’étiquetage.
§ Clivages protéolytiques et
amidation :
L’arginine est
reconnue par la trypsine qui coupe après un acide aminé basique. Les protéases
de l’appareil de golgi peuvent être des prohormones convertases.
v Les vésicules de
sécrétion :
La
pyroglutamination permet le blocage de certains peptides. Cela concerne les
peptides dont le 1er acide aminé est une glutamine. Présente dans
les vésicules de sécrétion, une enzyme catalyse la cyclisation de l’acide
aminé. Ce peptide cyclisé est le pyroglutamate (pGln)
Les
vésicules de sécrétion sont les lieux de stockage des produits de sécrétion de
la voie régulée.
Pour emballer les produits de sécrétion,
il y a la présence de protéines d’emballage : la sérotogranine 1 et la
chromogranine. Ce sont des protéines riches en acides aspartiques et en
glutamiques (acides aminés chargés négativement) et qui contiennent un complexe
de Ca2+.
Dans les
vésicules, on peut avoir plusieurs produits différents stockés dans la même
cellule. On peut aussi rencontrer des neuropeptides.
v Les lysosomes :
Ils contiennent
des enzymes hydrolytiques acides (pH optimal acide) Il faut donc maintenir une
acidité grâce à une pompe à protons : ATPase H+.
Les hydrolases
que renferment les lysosomes sont souvent glycosylées et phosphorylées. Elles
peuvent dégrader toutes les macromolécules.
v Les compartiments de
l’endocytose :
Ils
proviennent des invaginations de la membrane plasmique au moment de
l’endocytose. Ils sont dans le hyaloplasme périphérique (= endosomes précoces)
La dissociation entre le récepteur et le
produit de l’endocytose se réalise à cet endroit.
Les endosomes
tardifs sont près de l’appareil de golgi : lieu de concentration des
produits de l’endocytose avant qu’ils ne fusionnent avec un lysosome IAIRE pour donner un
lysosome IIAIRE.
v Transport, tri et adressage
des protéines dans le système sécréteur de la cellule :
Pour qu’il y ait
communication entre 2 compartiments, il faut qu’il y ait bourgeonnement de la
membrane du compartiment donneur, fission par pincement du bourgeonnement,
postage et arrivage de la vésicule bourgeonnée au compartiment receveur cible.
Approches expérimentales :
-
Utilisation de mutants de levure déficients pour
certaines étapes de la sécrétion :
Par
clonage, on a pu identifier des protéines cruciales impliquées dans le trafic
intracellulaire des protéines. On a pu déterminé les protéines homologues chez
les autres cellules eucaryotes les plus évoluées.
-
Etudes biochimiques après la purification de
vésicules et de protéines :
" Etude des
interactions entre les protéines purifiées.
-
Utilisation des coupes ultrafines en s’intéressant à
des cellules endocrines ou exocrines :
On
observe un REG développé, un golgi développé et de nombreuses vésicules de
tailles différentes, certaines d’entre–elles sont présentes du coté
hyaloplasmique avec un aspect opaque, assez dense.
-
Observation de puits recouverts d’un matériau
fibreux et dense du coté …
Ø Mécanisme
du bourgeonnement :
Il
résulte d’une interaction entre les protéines membranaires ou luminales du
compartiment donneur avec des protéines cytosoliques qui constituent le manteau
(aspect dense)
Ces protéines sont responsables de la
déformation mécanique de la membrane et, en même temps, elles piègent les
protéines à transporter dans le compartiment receveur
=
Tri des protéines
On
ne connaît que 3 types de vésicules recouvertes :
-
Les vésicules
« COP I »
qui sont impliquées dans le transport rétrograde, c’est–à–dire du trans–golgi
vers le cis–golgi et aussi du cytoplasme vers le REG.
-
Les vésicules
« COP II »
qui assurent le transport antérograde, c’est–à–dire du REG vers le cis–golgi puis vers le
trans–golgi.
-
Les vésicules à
clathrine
qui sont rencontrées lors de l’endocytose : du golgi vers l’endosome, du
golgi vers le lysosome et de la membrane plasmique vers l’endosome précoce.
Elles
impliquent la polymérisation avec l’interaction de certaines sous–unités du
manteau = interaction des protéines adaptateur avec le domaine cytosolique des
protéines membranaires du compartiment donneur.
Cela permet la sélection des protéines
qui seront transportées.
Ce système de
polymérisation/dépolymérisation permet la régulation par des enzymes de liaison
au GTP. Ces associations au GTP/GDP sont contrôlées par des enzymes
cytosoliques : GAP.
§ Vésicules « COP I »
des étapes précoces du transport :
Dans le manteau,
on a déterminé 8 protéines dont 7 COP I (a, b, b’, g, d, e, z = cotmère) et
une protéine de régulation (= ARF)
Au niveau
golgien, les vésicules recouvertes de COP I capturent des protéines qui
possèdent le motif C–terminal cytoplasmique avec le motif lysine–lysine–X–X.
Les
protéines qui subissent un transport rétrograde sont les protéines qui résident
du REG et qui sont transportées plus ou moins par erreur dans l’appareil de
golgi au cours du transport antérograde.
C’est un moyen de rapatrier ces
protéines dans le compartiment adéquat.
Les protéines
luminales du REG ont souvent un motif KDEL
(lysine–asparagine–glutamine–leucine) en position C–terminale.
§ Vésicules « COP
II » :
Elles ont été
identifiées chez les levures. On a identifié des mutants.
Il y a la
formation d’un cotmère comme avec les vésicules COP I. Une protéine G (= SAR)
sélectionne un certain nombre de protéines qui peuvent subir le transport, dont
la séquence DXE (asparagine–X–glutamate)
Le mécanisme est similaire aux vésicules
COP I, mais il permet un transport antérograde.
§ Vésicules à clathrine :
C’est une
protéine fibreuse, un complexe multiprotéique constitué de 3 chaînes lourdes et
2 chaînes légères qui s’assemblent pour former un triskèle.
Quand
il y a polymérisation, cela forme un trayage polygonal, c’est–à–dire la
formation d’une sorte de cage.
De nombreux complexes protéiques
referment un adaptateur (= protéine d’assemblage)
La régulation de
l’assemblage est assurée par une protéine G (= facteur de type ARF spécialisé
pour les clathrines) Cet ARF contrôle la fixation des particules d’assemblage
qui vont à leur tour déclencher le phénomène de polymérisation de la clathrine.
Ces particules
d’assemblage, en fonction de la protéine adaptateur qu’elles renferment,
déterminent la nature des protéines membranaires qui vont être transportées. On
distingue 3 types de protéines adaptateurs : AP1, AP2 et AP3.
-
Les protéines
d’assemblage à AP1 lient les protéines membranaires du trans–golgi et
sont destinées aux lysosomes.
-
Les protéines
d’assemblage à AP2 lient les protéines de la membrane plasmique au
cours de l’endocytose via des motifs qui peuvent être :
-
Tyrosine–X–X–(phenylalanine
ou trypsine)
-
Leucine–leucine.
-
Les protéines
d’assemblage à AP3 envoient vers les vacuoles (qui correspondent aux
lysosomes)
Ø Accostage
et fusion des vésicules au compartiment accepteur :
Il
y a un échange de GTP au niveau de la protéine.
La
vésicule dénudée peut fusionner avec la membrane du compartiment accepteur.
Cela implique de nombreuses protéines solubles et membranaires.
-
Les
protéines solubles :
-
NSF
(N–éthyl Mallemide Sensitive Factor)
-
SNAP
(a, b et g)
-
Les
protéines membranaires = les SNARES (Soluble NSF Acceptor Receptor)
-
V–SNARES
(Vesicular),
-
T–SNARES
(Target)
Chaque
type de vésicule possède sa propre adresse et chaque membrane cible possède un
ou plusieurs T–SNARES complémentaires de V–SNARES spécifiques. Il existe des
protéines régulatrices de cette association V et T–SNARES :
-
Le
complexe NSF–SNAP,
-
Le
N–SEC qui peut se complexer avec le T–SNARE et inhiber l’association de V et
T–SNARE.
Les toxines
botuliniques ont des effets inhibiteurs sur la libération des
neurotransmetteurs. Elles ont pour cible les V et T–SNARES des vésicules
synaptiques.
Ø Mouvements
de vésicules :
Dans
une cellule interphasique, les microtubules irradient à partir de la zone COMT,
qui est un centre de nucléation.
COMT = Centre Organisateur de
MicroTubules, qui renferme de la tubuline.
Les
microtubules ont une polarité (+/–) et il y a un allongement vers le pôle +.
-
Quand
les vésicules vont du REG vers le golgi, elles se déplacent en se guidant sur
les microtubules. Il s’agit du transport antérograde (du + vers le –)
-
Quand
il s’agit du transport rétrograde, elles se déplacent du – vers le +.
Le système
moteur est constitué d’une dynéine cytosolique (= complexe dynamique) qui
peut se déplacer du + vers le –. Le transport du – vers le + se fait grâce au
système de kinésine.
Il y a
l’existence de microtubules qui interviennent dans des régions pauvres en
microtubules (= régions juxtambaires) Dans ce cas, il y a l’intervention
d’actine filamenteux (= polymère d’actine globulaire) et de myosine non
musculaire (qui a une action ATPasique)
v Exemple de trafics
intracellulaires :
Ø Transport
de protéines lysosomiales vers les lysosomes :
Ø Exemple
d’endocytose :
Les
puits recouverts de clathrine renferment LDL. Il y a formation d’une vésicule
qui fusionne avec une vésicule pour former un endosome tardif.
Il y a un
recyclage des récepteurs par exocytose.
La particule
libre fusionne avec un lysosome IAIRE pour former un
lysosome IIAIRE.
L’Apo B est
hydrolysé en acides aminés.
Les esters de cholestérol sont hydrolysé
en cholestérol et acides gras.
Exemple d’endocytose médiée par des
récepteurs :
Le complexe
apotransferrine–récepteur va être libéré par exocytose. Les récepteurs sont
captés car ils possède un motif.
Ø Exemple
de fusion membranaire : infection d’une cellule eucaryote par un virus à
enveloppe :
Tous
les virus possèdent un acide nucléique et un capside. Ceux à enveloppe ont, en
plus, une bicouche de phospholipides.
Un virus infecte des cellules via des
récepteurs membranaires.
Pour les virus à
membrane, ils se retrouvent dans une vésicule d’endocytose. Dans cette
vésicule, il y a fusion de la membrane de la vésicule et de l’enveloppe du
virus. Le génome (ADN ou ARN) du virus se retrouve dans le cytosol.
Ces virus à
membrane ne conduisent pas toujours à une lyse mais une mort plus ou moins
programmée due au détournement du métabolisme.
v Généralités :
Ø Contacts
intercellulaires :
Les
organismes pluricellulaires doivent percevoir des sources de nourriture uni– ou
pluricellulaires, de même les substances ou stimuli physiologiques favorables à
leur survie.
Pouvoir
communiquer entre les individus permet des stratégies collectives et donc la
survie de l’espèce face à des changements d’environnement (par reproduction
sexuée la plus souvent)
Il peut avoir la sécrétion de substances
chimiques (= phéromones) dans le milieu externe qui permet la communication.
Il
y a la mise en place de nombreux mécanismes qui assurent la coordination des différentes
activités cellulaires.
Les protéines d’adhésion servent aussi
de message (dont
Ø Contacts
protéines membranaires – matrice extracellulaire :
Les protéines
membranaires sont souvent reliées à des protéines du cytosquelette ou à des
kinases, etc.
Ø Messagers
circulants :
Il
existe différents mécanismes :
-
Sécrétion
autocrine (cytokines
du système immunitaire) :
La cellule sécrète une protéine
(messager) et s’autorégule.
-
Sécrétion
paracrine :
Instruction des cellules à proximité qui
possède les récepteurs spécifiques (régulation locale)
-
Sécrétion
endocrine :
La cellule
sécrète son produit qui est disséminé dans l’organisme via la circulation
sanguine.
Les
molécules sécrétées peuvent être des hormones, des facteurs de croissance ou
des cytokines. Elles peuvent être aussi :
-
Des
acides aminés
-
Des
amines biogènes (= dérivés d’acides aminés), comme le GABA (dérivé du
glutamate), l’adrénaline, la noradrénaline, l’histamine, la mélatonine.
-
De
l’acétylcholine,
-
Des
hormones thyroïdiennes,
-
Des
lipides (acides gras, stéroïdes, prostaglandine)
-
Certains
nucléotides (ATP)
-
Et
des protéines (grosses molécules)
Les
grosses molécules ne peuvent pas traverser la membrane. Les acides aminés, les
peptides, les protéines et les glycoprotéines agissent par des récepteurs au
niveau de la membrane.
Les molécules hydrophobes peuvent agir
via des récepteurs intracellulaires car ils peuvent diffuser au travers de la
bicouche (hormones stéroïdes, thyroïdiennes, prostaglandine, NO)
v Différentes classes de
récepteurs et leurs modalités de transduction du signal :
Ø Récepteurs
canaux activés par des ligands :
§ Récepteurs canal ionique –
récepteur nicotinique de l’acétylcholine :
La liaison du
ligand (= messager IAIRE) à son
récepteur spécifique déclenche des cascades d’activation (= transduction du
signal) et conduit à une réponse cellulaire adaptée (contraction, synthèse
d’enzyme, activation d’enzymes et de voies métaboliques, sécrétion de
protéines, différenciation cellulaire, prolifération cellulaire, etc.)
Il
existe 4 grandes familles de récepteurs :
-
Les
récepteurs canaux,
-
Les
récepteurs couplés aux protéines G (RCPG),
-
Les
récepteurs à activité enzymatique intrinsèque ou associée,
-
Les
récepteurs intracellulaires à activité facteur de transcription.
Le
récepteur nicotinique est important au niveau des jonctions neuromusculaires des
muscles striés. Le 1er récepteur nicotinique cloné possédait 4
gènes : a, b, g et d. La
stoechiométrie du récepteur contient 4 sous–unités différentes mais avec 2
sous–unités a.
La sous–unité a lie le ligand
naturel : l’acétylcholine. L’ouverture du canal dépend de la liaison du
ligand.
Ces
5 sous–unités sont constituées de 4 domaines transmembranaires avec une
strucutre en hélice. Ces sous–unités sont constituées sous le même schéma.
Elles sont incrustées dans la membrane mais il y a 3 surfaces hydrophobes et 1
hydrophile.
Ces sous–unités s’assemblent pour former
un canal.
Ce canal est
ionique : la face hydrophile se trouve vers le canal.
La liaison de l’acétylcholine provoque
un changement de conformation qui est de type coopératif et qui laisse passer
des ions Na+–K+. Les ions sont
hydratés.
Ce canal
sélectionne les ions positifs car 2 zones sont riches en acides aminés acides
(chargés négativement) sur les bords du canal.
L’ouverture
du canal provoque un gradient de Na+ massifs qui
entre dans la cellule. Cette dépolarisation membranaire entraîne un changement
de conformation des canaux ioniques dépendants du potentiel.
La dépolarisation atteint un niveau tel
que les canaux dépendants s’ouvrent entraînant une entrée encore plus massive
de Na+ et créant ainsi un potentiel
d’action qui se propage (contraction de la cellule)
§ Autres récepteurs canaux
pentamériques :
-
Les récepteurs
GABA :
Le GABA est un
neuromédiateur qui se fixe sur un récepteur pentamérique, mais c’est un canal
Cl–, entraînant une hyperpolarisation.
Ces récepteurs sont
présents au niveau de l’encéphale.
-
Les récepteurs à
la glycine :
La glycine est
un neuromédiateur identique au GABA. Ces récepteurs sont présents au niveau de
la moelle épinière.
-
Les récepteurs
au glutamate :
Le glutamate est
un neuromédiateur excitateur dont le canal pentamérique est un canal Na+ ou un canal
NMDA. Ces récepteurs sont situés dans le SNC.
Ø Récepteurs
couplés à des protéines G :
Ils lient le GTP
et sont présents chez tous les eucaryotes. Chez les mammifères, il y a 200
catégories de récepteurs couplés aux protéines G ainsi que les récepteurs
olfactifs : un génome de mammifères compte de 800 à 1000 protéines G
différentes.
§ Structure :
Ce
sont des heptamères, donc avec 7 domaines transmembranaires (= hélice a traversant la
membrane) La partie N–terminale est extracellulaire. L’extrémité C–terminale
est cytoplasmique.
Il y a 3 boucles
extracellulaires E1, E2 et E3, 3 boucles
intracellulaires I1, I2 et I3 et une
pseudoboucle possible.
Il y a la présence de site de
N–glycosylation (extracellulaire) et de ponts disulfures entre E1 et E2.
§ Nature des stimuli :
-
Le 1er
stimulus : les photons
Exemple : la rodopsine
est un récepteur particulier, associé de manière permanente à son propre
ligand : 11–6 rétinal (dérivé de la vitamine A)
L’activation se
fait par absorption des photons qui entraîne un changement de conformation du
11–6 rétinal (conformation Cis en Trans)
-
Le 2ème
stimulus : les catécholamines et les petits ligands
Exemple : les récepteurs
olfactifs, gustatifs, les phéromones aériennes.
Les
catécholamines (dont l’adrénaline) sont des neuromédiateurs chimiques abondants
dans le SNC. La liaison des ligands se fait au niveau des hélices.
Cela concerne
les récepteurs muscariniques, les récepteurs GABA, aux amines biogènes
(dopamine, adrénaline, acétylcholine), aux nucléosides, aux nucléotides (ATP),
acides aminés, aux lipides, à la progestérone, etc.
-
Le 3ème
stimulus : les peptides
Exemple : neuropeptides,
peptides hormonaux (sang), neuromédiateurs (sécrétés dans les sinapses),
peptides exogènes.
Il s’agit des
molécules à une liaison peptidique au moins. Ce sont des neuromédiateurs. Ils
se fixent en se liant en surface des boucles E1 et E2.
-
Le 4ème
stimulus : les hormones glycoprotéiques
Exemple : LH, FSH, TSH
Elles sont
synthétisées dans l’hypophyse antérieure. Ce sont de grosses molécules qui se
lient à la partie extracellulaire en N–terminal.
-
Le 5ème
stimulus : le glutamate
Il ne se lie pas
comme les autres acides aminés. Il se lie en N–terminal.
-
Le 6ème
stimulus : la thrombine
Elle clive le
fibrinogène. En se liant à ses récepteurs, elle clive le récepteur entraînant
un changement de conformation du récepteur. La fixation du ligand provoque un
changement de conformation du récepteur entraînant des protéines couplées à ce
récepteur (protéines G)
§ Activation des protéines
G :
Les protéines G
sont des protéines G hétérotrimériques associées à la membrane via des lipides
(pour les sous–unités a et g) La sous–unité b est juste
associée à a
et g
par des liaisons de faible énergie.
La
sous–unité a
peut lier le GDP ou le GTP. Elle n’a pas la même conformation si elle se lie au
GTP ou au GDP.
Þ Ce qui active
la protéine G est la réaction d’échange entre le GTP et le GDP. Cette
activation provoque du complexe : b et g peuvent
interagir avec un effecteur (qui peut être une enzyme, un canal ionique, un
transporteur)
Cela peut conduire à la synthèse de
messager secondaire.
L’agoniste est le ligand propre du récepteur ou un
analogue.
-
La
fixation de l’entreprise entraîne un changement de conformation, provoquant une
interaction avec la sous–unité a qui change de conformation.
-
L’échange
du GDP en GTP entraîne la dissociation en sous–unités b–g et a–GTP : l’un
et l’autre peut agir avec un effecteur.
-
Le
retour aux conditions initiales est dû à une activité GTPasique de la
sous–unité a.
§ Les différentes classes de
protéines G :
§ Variétés des effecteurs
cibles de protéines G : transduction du signal :
·
Les
adénylates cyclases :
L’inhibition se
fait sur des adénylates cyclases activées qui produisent de l’AMPC à partir d’ATP.
Une adénylate cyclase synthétise plusieurs molécules d’AMPC permettant
une amplification du signal.
L’ AMPC exerce son
activité via des enzymes qui sont des protéines kinases. La protéine kinase A
(PKA) possède des sites de liaison pour l’ AMPC, ce qui active
Sous sa forme
inactive, l’augmentation d’ AMPC lui permet de
se fixer sur les sous–unités rédulatrices. Le changement de conformation causé
consiste en la dissociation du complexe en sous–unités catalytique et en
sous–unités régulatrices. La sous–unité catalytique activée phosphoryle ses
substrats grâce à l’ATP.
Il existe des sérines–thréonines
kinases.
Les protéines
cibles de
Cas de l’adrénaline :
L’adrénaline est
un acide modifié de la tyrosine. Elle est sécrétée en cas de stress par les
surrénales. C’est une hormone qui active l’organisme qui va dépenser plus
d’énergie. Elle agit au niveau du foie.
Elle
a une action via des récepteurs membranaires des cellules hépatiques et des
cellules musculaires squelettiques (récepteurs couplés à des protéines GS) qui active
l’adénylate cyclase membranaire. Cela entraîne une synthèse d’AMPC activant
L’action de l’
AMPC peut s’exercer sur des enzymes
ou des facteurs de transcription. Une protéine permet la mise en place de
l’initiation de la transcription via la formation d’un complexe (avec l’ AMPC) qui permet la
transcription.
·
La
phospholipase C :
C’est une enzyme
membranaire qui hydrolyse les phospholipides, plus particulièrement les
phospho–inositols biphosphate (PIP2)
L’IP3 a des
récepteurs membranaires au niveau intracytoplasmique (RE) La fixation de l’IP3 à son récepteur
entraîne l’ouverture du canal (des récepteurs canaux) et la sortie de Ca2+ du RE vers le
cytoplasme (augmentation transitoire de la concentration intracellulaire en Ca2+)
L’IP3 est un 2nd
messager, le Ca2+ est un 3ème
messager. Ce dernier va activer un certain nombre d’enzyme :
-
-
La
protéine kinase C qui acquiert une affinité et est recrutée par la membrane.
·
Dans
les cellules de la rétine, la transduction se fait par des protéines GaT (transducine)
Elle se couple à la rhodopsine.
Liée au GTP,
Þ La membrane
devient transitoirement hyperpolarisée.
·
Les
canaux ioniques :
Dans
les cellules à bâtonnet, la concentration en GMPC est importante.
Le GMPC se lie à des canaux Ca2+ membranaires.
Certains canaux ioniques à K+ ou Ca2+ sont modulés
par des protéines GaI ou encore Ggb.

Ø Récepteurs
à activité enzymatique intrinsèque ou associée :
§ Récepteurs à activité
tyrosine–kinase (= TKR) :
Les TKR
phosphorylent des protéines sur des résidus tyrosines. Les ligands sont des
protéines à activité facteur de croissance.
D Les facteurs de croissance ont une
activité autocrine ou paracrine.
A ne pas confondre avec les hormones de
croissance qui ont une activité endocrine.
Exemples :
-
EGF
(epidermal growth factor),
-
FGF
(fibroblast growth factor) : actif
sur la différenciation des fibroblastes en culture,
-
Neurotrophines :
elles agissent sur les neurones et les cellules gliales. Elles assurent la
plasticité des neurones (nombre de connexions)
-
Insuline :
elle agit en tant que TKR.
-
IGF
(insulin growth factor) : il
présente un domaine transmembranaire unique (hélice a de 21 acides
aminés), un domaine intracellulaire unique enzymatique (catalytique) et un
domaine NH2 extracellulaire.
Le ligand
recrute généralement 2 récepteurs qui se phosphorylent mutuellement
(autophosphorylation des récepteurs, ou plutôt transphosphorylation), mais
phosphorylent aussi d’autres protéines signal (différents de celle de l’insuline)
Le domaine de liaison de protéines de
signalisation intracellulaire :
Ces
protéines sont souvent modulaires : elles possèdent plusieurs domaines
d’interaction avec d’autres protéines et peuvent former un réseau 3D.
On
distingue :
-
Les
domaines SH2 (Src homology domaine 2) et PTB (phosphotyrosine
binding) se lient aux protéines phosphorylées au niveau d’un tyrosine
localisée dans une séquence spécifique.
-
Le
domaine SH3 se lie à des séquences courtes,
riches en proline.
-
Le
domaine PH (Plekstrin homology) se
lie aux groupements chargés de phosphoinositol membranaires spécifiques.
·
Transduction
du signal : cas de la voie des MAP kinases :
-
Le
GRB2 peut se fixer sur le récepteur phosphorylé, entraînant un changement de
conformation. Il possède aussi un domaine SH3, activé par
phosphorylation, va pouvoir se fixer à une protéine SOS (= GEF = guanine nucleotid exchange factor)
-
La
protéine SOS devient active et va pouvoir recruter Ras (inactive) qui va
pouvoir échanger son GTP en GDP.
-
S’il
y a hydrolyse du GTP, Ras devient à sont tour active et il y a retour à la voie
de départ : SOS et GRB2 s’inactivent.
-
Ras
active est recrutée par Raf qui s’active. Raf est une protéine kinase (MAPKKK)
qui phosphoryle un substrat particulier : MEK.
-
MEK
phosphorylée devient à son tour active. C’est aussi une protéine kinase (MAPKK)
qui phosphoryle
-
-
La
phosphorylation de ces facteurs provoque la transcription de gènes cibles.
L’activation
d’une MAPK conduit à la division cellulaire et à l’activation d’autres
protéines. L’activation des gènes cibles entraîne aussi la mitose. Ces gènes
possèdent, au niveau de leur promoteur, un élément de réponse SRE (serum response element)
Les SRE sont des éléments de réponse aux
facteurs de croissance.
Comment
SRF et TCR se lient à SRE mais, quand
ils sont sous la forme non phosphorylée, ils ne peuvent pas induire la
transcription des gènes.
Le
complexe phosphorylé fait que le complexe d’initiation de la transcription
provoque la transcription des gènes.
Si
Parmi
les ligands qui agissent sur les RTK, on trouve le FGF, l’insuline et l’IGF
(sécrétés par le foie) :
-
L’insuline
est hypoglycémiante. Elle n’active pas uniquement la voie des MAP kinases mais
aussi la voie du PIP3.
-
Les
IGF n’ont pas de rôle dans la glycémie mais ils ont un rôle de facteur de
croissance sur les chondrocytes (cartilage)
·
Voie de
Une
fois le récepteur phosphorylé, les protéines recrutées par le récepteur seront,
par exemple,
Le recrutement
fait que la kinase se retrouve au niveau de la membrane plasmique. Ses
substrats sont les phospho–inositols dont le PI4P et le PI4–5 diP.
Il existe des
protéines de type PH, capables de se lier aux phospho–inositols 3–4 diè et phospho–inositols 3–4–5 triè.
En
phosphorylant les inositols, il leur est possible de se fixer à des protéines
du type PH, dont
L’insuline fait
décroître la concentration du glucose sanguin en augmentant le nombre de
transporteurs membranaires sur les cellules hépatiques.
Parmi les
protéines phosphorylées par PKB, il y a des protéines du cytosquelette et des
protéines impliquées dans l’exocytose, favorisant la fusion de vésicules sous
membranaires avec la membrane plasmique (stockage des transporteurs de glucose)
§ Récepteurs à activité
sérine/thréonine kinase :
Cas
des récepteurs de la superfamille du TGF–b
(transducing
growth factors)
Ils
agissent dans la mise en place des axes embryonnaires, sur la répartition
des os, dans la reproduction et dans l’immunité.
Les ligands de
ces récepteurs appartiennent à une superfamille. Ce sont des dimères (homo ou
hétéro) Les récepteurs sont classés en récepteurs de type I et récepteurs de
type II.
Les récepteurs
de type II présentent une partie extracellulaire spécifique au ligand et
un domaine sérine/thréonine kinase qui est actif de manière constitutive. Cette
kinase entraîne l’autophosphorylation du récepteur au niveau des résidus
sérine/théonine.
-
Le
ligand se lie à 2 récepteurs de type II.
Cette liaison fait qu’il y a une très
haute affinité des récepteurs de type II pour les récepteurs de type I.
-
On
a l’obtention d’un tétracomplexe.
-
Les
récepteurs de type II phosphorylent ceux de type I au niveau d’une région
spécifique.
-
Les
récepteurs de type I deviennent actifs et phosphorylent des protéines
substrat (SMAD)
-
-
Les
SMAD sont des facteurs de transcription : elles peuvent se lier dans les
régions promotrices des gènes (élément de réponse) et provoquent une régulation
de la transcription des gènes (augmentation ou diminution)
§ Récepteurs à activité
guanylate cyclase :
Cas
des ANP (Atrial Na+–triurétic
peptide)
On
ne retrouve l’ANP que chez les vertébrés. Il augmente la sécrétion de Na+ et diminue le
volume et la pression sanguine. L’ANP agit via un récepteur : la guanylyl
cyclase.
Elle hydrolyse le GTP en GMPC, entraînant la
phosphorylation de protéines cibles et une augmentation du transport d’eau et
de sels.
§ Récepteurs à activité
phosphatase :
Ce
sont des récepteurs possédant une capacité de lier des ligands solubles ou des
ligands d’adhésion.
L’interaction récepteur–ligand provoque
une dimérisation, une polymérisation et une inhibition mutuelle des
phosphatases.
§ Récepteurs à activité
enzymatique associée :
L’enzyme
est recrutée par le récepteur. Il existe plusieurs catégories de
récepteurs :
-
Les
récepteurs de cytokines immunitaires qui régulent l’activation des
cellules immunitaires,
-
Les
récepteurs de l’hormone de croissance des vertébrés,
-
L’érythropoéitine
(EPO) qui agit via des récepteurs proches de ceux de l’hormone de
croissance.
Tous
ces récepteurs sont associés aux JAK. Ceux–ci sont proches des récepteurs à
activité tyrosine kinase.
-
La
liaison du ligand se fait sur 2 récepteurs et provoque un changement de
conformation. Les récepteurs vont recruter des JAK (= janus kinase)
Les
JAK phosphorylent des protéines au niveau des résidus tyrosine. Il existe
plusieurs JAK.
-
-
Les
récepteurs peuvent alors recruter des protéines ayant des domaines SH2 ou PTK :
les STAT (Signal Transducor Activator of Transcritption)
Les STAT possèdent des domaines SH2 et sont donc
capables d’être recrutées par des protéines phosphorylées au niveau des résidus
tyrosine.
-
Les
STAT à proximité de
-
Les
STAT phosphorylées se détachent et vont se dimériser. Ces dimères peuvent être
transportés dans le noyau.
-
Les
STAT se fixent au niveau d’éléments de réponse spécifiques sur des régions
spécifiques, entraînant une augmentation de la probabilité de transcription.
§ Récepteurs sans domaine
intracellulaire :
Le
GDNF se lie à des récepteurs spécifiques, sans domaine intracellulaire (=
protéine périphérique ancrée à la membrane via des résidus glycosyl d’un
glycolipide)
La liaison du GDNF permet le recrutement
d’une protéine transmembranaire : activation d’une tyrosine kinase
(réponse spécifique)
Ø Récepteurs
intracellulaires (nucléaires) à activité « facteur de transcription » :
Ils
régulent la transcription des gènes cibles.
L’effet immédiat
de l’hormone est la transcription des gènes.
Ces
récepteurs sont des récepteurs de molécules signalisatrices de petite taille,
hydrophobe (c’est–à–dire pouvant traverser la bicouche lipidique)
On distingue 2
catégories de ligands : les hormones stéroïdes (hormones sexuelles) et les
hormones synthétisées par les surrénales (médiateurs de stress,
glucocorticoïdes)
Les récepteurs de ces hormones sont
cytosoliques.
Il
existe des médiateurs dans les récepteurs qui sont nucléaires comme les
hormones thyroïdiennes,
Il existe aussi des médiateurs
lipidiques comme l’acide rétinoïque.
§ Récepteurs cytosoliques
d’hormones stéroïdes :
Il
y a :
-
Un
domaine N–terminal variable en fonction du type de récepteur,
-
Un
domaine de liaison à l’ADN,
-
Un
domaine de liaison au ligand.
Ce récepteur
présente une structure en doigt à zinc.
Il
existe des éléments de réponse avec au moins une partie qui est commune :
-
ERE :
élément de réponse aux oestrogènes = Palindrome,
-
TRE :
élément de réponse aux thyroïdes = Séquence répétée.
Les récepteurs
aux glucocorticoïdes sont cytosoliques. Ils sont transférés dans le noyau,
suite à la fixation du ligand.
Expérience : Mise en culture de
cellules (exposées à plusieurs milieux de culture)
Le
dex (= dexaméthazone) est un analogue de glucocorticoïde. Les cellules sont
transfectées avec des plasmides renfermant des constructions particulières.
-
En
A : on met l’ADNC de la b–galactosidase,
-
En
B : on met l’ADNC du récepteur
couplé à l’ADNC de la b–galactosidase
(protéine
de fusion)
-
En
C : on met l’ADNC de la b–galactosidase
couplé au domaine de liaison de récepteur.
On essaie de
détecter la b–galactosidase
avec des anticorps :
|
|
– dexaméthazone |
+ dexaméthazone |
|
|
A |
Localisation
cytosolique |
|
|
|
B |
Localisation
cytosolique |
Localisation
nucléaire |
Þ Le récepteur est cytosolique
et la fixation du ligand induit sa translocation nucléaire |
|
C |
Localisation
cytosolique |
Localisation
nucléaire |
Þ La région impliquée dans la
transcription est bien celle qui lie le ligand. Þ la fixation du ligand entraîne
un changement de conformation qui entraîne démasquage du site nucléaire. |
La liaison du
ligand modifie la conformation du récepteur. Les récepteurs s’associent à des
éléments de réponse spécifiques (comme SRE) Ils se fixent sous forme de
dimères. Puis, il y a interaction avec d’autres protéines du complexe
d’initiation de la transcription.
§ Récepteurs nucléaires
d’hormones (TR) ou d’acide rétinoïque (RAR) :
Les
récepteurs sont nucléaires et se fixent sous forme d’hétérodimère au niveau des
éléments de réponse.
Le récepteur de l’acide 9–Cis–rétinoïque
est un hétérodimère (RXR)
Il
existe un complexe protéique pour empêcher l’activation de la
transcription : corépresseur.
Le recrutement
d’un coactivateur favorise l’activation du complexe d’initiation de la
transcription.
Pour
l’acide rétinoïque, le récepteur RAR présente la même technique :
-
Le
complexe corépresseur possède une activité histone désacétylase.
-
Le
complexe coactivation possède une activité acétyltransférase.
La
désacétylation permet l’accès des polymérases à l’ADN et entraîne la formation
du complexe de transcription.
v Désensibilisation des
récepteurs :
L’exposition des
récepteurs à des concentrations trop longues ou trop forte en ligand entraîne
une désensibilisation.
Cas des récepteurs couplés aux protéines
G :
La
fixation du ligand au récepteur entraîne un changement de conformation
permettant des interactions entre les protéines G et le complexe
hétérodimérique mais exposant les protéines G à des kinases GRK (G protein receptor kinase)
Les régions phosphorylées bloquent le
couplage avec les protéines G et permet le recrutement d’une protéine b–arestine sur
les régions phosphorylées du récepteur.
La
b–arestine
a 2 effets :
-
Elle
prévient l’interaction entre les protéines G et les protéines G hétéromériques.
-
La
réponse spécifique au ligand va décroître.
L’arestine
sert d’adaptateur pour la polymérisation de clathrines, permettant l’endocytose
des récepteurs (internalisation) et donc fait diminuer la réponse. Ces
récepteurs internalisés peuvent être recyclés ou dégradés.
Þ Ce phénomène
s’appelle la désensibilisation homologue : un ligand donné va induire une
désensibilisation des récepteurs de ce ligand particulier.
Il existe une
désensibilisation hétérologue :
Il
s’agit d’une désensibilisation globale avec une réponse moindre de la cellule
pour l’ensemble des ligands.
Elle est due à la phosphorylation des
récepteurs.
Ce phénomène régule
plus ou moins la transcription du gène codant pour les récepteurs. Or, ces
gènes sont souvent régulés par des facteurs de transcription dont l’activité
est liée à l’activité kinase.
v Introduction :
Ø 4
phases :
Et
intégration des signaux mitogènes Et
duplication du centrosome

La
mitose :
-
Disparition
de l’enveloppe nucléaire (phosphorylation des lamines),
-
Compaction
des chromosomes (phosphorylation des histones),
-
Alignement
des chromosomes dupliqués (métaphase),
-
Séparation
des chromatides sœurs (phosphorylation des cohésines),
-
Cytodiérèse.
Ø Régulation
du cycle :
-
Point de
restriction (transition G1"S) :
C’est le point de départ qui engage
irréversiblement la cellule dans le cycle.
-
Succession
immuable des 4 phases :
Elle engage les cyclines et les kinases
cycline–dépendantes (cdk)
-
Surveillance du
cycle :
-
Point
de contrôle de dommage de l’ADN (DDCP),
-
Point
de contrôle de la réplication (RCP),
-
Point
de contrôle de positionnement des chromosomes en métaphase (MCP)
v Cyclines et CDK :
Ø Mise
en évidence :
Elles
ont été mises en évidence par la convergence de 3 thèmes de recherche :
-
La
maturation de 3 œufs d’amphibiens : « maturation promoting factor » (MFP),
-
Les
protéines enbryonnaires d’étoile de mer : cyclines,
-
La
régulation mitotique : mutation « cell
division cycle » (cdc)
§
Ovogenèse et blocage de la méiose :
![]()
![]() Phase S
Phase S
 Croissance
Croissance
Ovulation
9 Division I de Méiose = Maturation
Division I de Méiose = Maturation
"
Émission du 1er globule polaire
Fécondation
 9 Division II de Méiose = Activation
9 Division II de Méiose = Activation
"
Émission du 2ème globule polaire
Ovogonie Ovocyte
![]() en vitellogenèse
en vitellogenèse



![]()
![]()
![]()
![]()
Vitellogenèse GVBD 1er globule
polaire
![]()
![]()
![]()
![]()
![]()
S Prophase Métaphase Anaphase Métaphase
(M I) Télophase (M II)
GVBD :
Rupture de la vésicule germinative.
Maturation :
-
Rupture
des jonctions ouvertes entre les cellules folliculaires et l’ovocyte,
-
Migration
de la vésicule germinative (futur pôle animal),
-
Remaniement
cytoplasmique (clarification du vitellus),
-
GVBD :
-
Disparition
de l’enveloppe de l’enveloppe nucléaire,
-
Condensation
des chromosomes,
-
Formation
du fuseau mitotique et de la plaque métaphasique.
Contrôle endocrine de cette
maturation :

MIH : Hormones d’inductions de la maturation :
-
Progestérone
(stéroïde) chez le xénope,
-
17_a_20_b_Di_Hydroxy_progestérone
chez les amphibiens et les poissons,
-
1_méthyl_adénine
chez l’étoile de mer,
-
Sérotonine
chez les mollusques,
-
Progestérone
chez les mammifères.
§ Expérience de micro–injection
:
L'injection
du cytoplasme prélevé dans un ovocyte II maturé (bloqué en métaphase II) dans
un ovocyte I induit l'entrée en méiose de ce dernier. Cette expérience montre
que le cytoplasme de l'ovocyte A contient un composé (MFP), présent en méiose,
et suffisant pour induire le passage en méiose (= maturation = GVD et 1ère
division méiotique)

§ Expérience de fusion de
cellules :
Il
est possible de réaliser la fusion de deux cellules qui sont à des stades
différents du cycle cellulaire : on obtient alors un hétérocaryon (cellule
contenant deux noyaux différents) avec mise en commun des cytoplasmes.
Ce modèle expérimental permet de
savoir si une cellule donnée contient un facteur de stimulation d'une étape du
cycle.
La
fusion d’une cellule en mitose et d’une cellule en interphase (G1, G2 ou S)
permet d'observer une condensation des chromosomes issus de la cellule en
interphase.
Un facteur présent dans la
cellule en mitose induit donc visiblement une "entrée en mitose"
précoce du noyau de la cellule en interphase. Ce facteur est le MPF.

Fusion d'une cellule en interphase (ici phase G2)
et d'une cellule en métaphase (phase M) :
Un facteur diffusible présent dans la cellule en phase M induit
l'entrée en mitose (condensation des chromosomes et disparition de l'enveloppe
nucléaire) de la cellule en phase G2.
Ce facteur est le MPF.
La fusion de toute cellule en interphase
(même en phase G1 ou S) et d'une cellule en phase M induit la condensation des
chromosomes et la disparition de l'enveloppe nucléaire.
Fusion d'une cellule en phase G1 (avant
réplication) et d'une cellule en phase S (en réplication) :
Un facteur contenu dans le cytoplasme de la cellule
en phase S agit sur les fibres chromatiniennes de la cellule en G1 pour induire
la synthèse d'ADN. Il existe donc, dans le cytoplasme des cellules en phase S,
un facteur de stimulation d'entrée en phase S.
Ce facteur correspond en fait à un
complexe protéique, qui est de même nature que le MPF.

Ces expériences permettent donc
de mettre en évidence que deux transitions importantes dans le cycle
cellulaire, l'entrée en mitose et l'entrée en phase S, sont sous la dépendance
de facteurs de régulation.
Facteur
diffusible de même nature que le MPF

§ Cyclines :
Chez
les embryons d’étoiles de mer ou d’oursin, les mitoses se font de manière
synchrone. Il existe donc des protéines dont les concentrations oscillent en
corrélation avec le cycle.
" Ce sont les
cyclines.

Caractérisation des cyclines A (en phase
S) et des cyclines B (en phase M) :

L’activité du
MPF est partiellement corrélée à la cycline B.
La
caractérisation de l’ADNc de la cycline B d’oursin permet l’élaboration de
sondes moléculaires pour cribler des banques géniques et en extraire l’ADNc de
la cycline B de xénope (analogie de structure)
Après en avoir élaborer la protéine
recombinante, on fabrique des anticorps anti–cycline B. Ces anticorps
reconnaissent d’une des sous–unités des MPF.
Etude
du cycle embryonnaire précoce chez la palourde :
On
analyse des œufs après fécondation. Après leur avoir injecté de la 35S–Methionine, on
effectue une extraction des protéines avec une analyse par SDS–PAGE et une
révélation par autoradiographie.
Cela montre
qu’il y a de la cycline A et de la cycline B qui agissent, puis qui diminuent
lors de la mitose (anaphase)
§ Régulation de la mitose chez
la levure :
Exemple : Saccharomyces cerevisiae et S. pombe :
Il
y a la recherche de mutations dans les gènes codant pour des molécules du cycle
cellulaire. On a mis en évidence de 2 types de mutants :
-
Mutants
cdc (cell divisions cycle) = arrêt du cycle,
-
Mutant
wee (petit) = mitoses prématurées (= proliférations actives)
Saccharomyces cerevisiae :
S. pombe :


Utilisation des souches (n) :
-
Saccharomyces
cerevisiae (bourgeonnante) :
 Absence de G2
(donc pas de GVBD)
Absence de G2
(donc pas de GVBD)
-
 Saccharomyces pombe (fissipare) :
Saccharomyces pombe (fissipare) :
Recherche
systématique de gènes du cycle des levures :
Mutants
thermosensibles :
-
Basse
température : protéine mutée non fonctionnelle Þ
Prolifération
-
Haute
température : protéine mutée fonctionnelle Þ Arrêt du cycle
de toutes les levures d’une même souche mutante à un stade donné du cycle.
Pour S.
pombe :

|
Saccharomyces cerevisiae |
Saccharomyces pombe |
Si mutation : |
|
CDC28 |
cdc2 |
Arrêt au point
de départ |
|
SWI6 |
cdc10 |
Arrêt de la
réplication |
|
– |
cdc25 |
Arrêt au
niveau du point de contrôle d’entrée en mitose |
|
WEE1 |
wee1 |
Entrée
prématurée en mitose (levures de
petite taille) |
Le
gène cdc2 a un rôle pivot :
-
Sa
mutation inactivatrice (cdc2–) entraîne
l’absence de mitose
" Cellules de
grande taille
-
S’il
n’est pas régulé (cdc2D hyperactif)
entraîne une mitose prématurée
" Cellules de
petite taille
Identification
de 3 gènes dont les produits régulent cdc2 :
-
wee1 : son
mutant wee1– engendre un
phénotype correspondant à cdc2D.
-
cdc25: son mutant cdc25– engendre un
phénotype correspondant à cdc2–.
-
cdc13 : son
mutant cdc13– engendre un
phénotype correspondant à cdc2–.
Mise
en évidence de la relation entre cdc2 et MPF :
Stratégie
de clonage :
Cellule mutante
(absence de division à température élevée)
$
Transfections :
plasmide + ADN aléatoire de cellule normale
$
S’il y a une
division de la cellule, alors il y a une copie du gène cdc normal
$
Récupération du
plasmide
$
Séquençage

-
cdc2 code pour une
protéine kinase.
-
Les
anticorps anti–cdc2 reconnaissent la sous–unité kinase du MPF.
-
Le
séquençage de cdc13 (= protéine
arrêtant le cycle) montre une homologie avec le gène de la cycline B.
-
La
levure cdc2– transfectée par
des plasmides ou des fragments ADN humains présente des divisions mitotiques.
Le gène humain est homologue à celui de cdc2.
Conclusion :
-
L’entrée
en mitose des levures et des vertébrés se fait par la même kinase.
-
La
kinase doit être complexée avec une cycline pour être active.
Ø Les
complexes cycline–cdk et les 4 phases du cycle :
§ Mode d’action :

Cdk
= sérine–thréonine kinase.
Cycline
= sous–unité (activatrice) des cdks.
Cycline
+ cdk = complexe actif
Þ
Phosphorylation de protéines cibles (Ser/Thr – Pro – X – Arg/Lys)
Þ Modification
des propriétés de la protéine cible
§ Structure des cdks :
-
Site
de fixation de protéines cibles,
-
Domaine
N–terminal (feuillets b) présentant des sites de liaison
à l’ATP,
-
Une
hélice a
= signature des cdks = PSTAIRE (Pro – Ser – Thr – Ala – Ileu – Arg – Glu)
-
Acides aminés cibles de phosphatases ou de kinases (cdk1 :
Thr14, Tyr15, Thr161) = boucle T
-
Domaine
C–terminal riche en hélices a
La
liaison à la cycline entraîne un changement de conformation de la cdk. Le site
catalytique devient accessible, ce qui permet le positionnement d’une molécule
d’ATP.
L’hélice PSTAIRE change de conformation
en fonction de la présence ou on de Cys–A. la phosphorylation inhibitrice
(cdk2 : Thr14, Tyr15) rend le site
catalytique inaccessible.
§ Structure des cyclines :
Elles ont un
poids moléculaire de 60 à 63kDa et sont constituées d’environ acides aminés.
Elles ont une structure en hélice et présentent 2 domaines.

Il
y a une séquence consensus : « destruction box » :
|
Cycline
A : |
Arg |
Thr |
Val |
Leu |
Gly |
Val |
Ile |
Gly |
Asp |
|
Cycline B1 : |
Arg |
Thr |
Ala |
Leu |
Gly |
Asp |
Ile |
Gly |
Asn |
|
Cycline B2 : |
Arg |
Ala |
Ala |
Leu |
Gly |
Glu |
Ile |
Gly |
Asn |
Cette séquence
est reconnue par le complexe APC (= Anaphase
Promoting Complex) qui est une ubiquitine ligase.
§ Cycline–cdk et phases du
cycle :
Les cyclines
sont présentes à des moments précis du cycle. Une même cycline peut activer des
cdk différentes. Une même cdk peut s’associer à des cyclines différentes.
Complexe cycline–cdk :
-
Bon
déroulement du cycle,
-
Passage
d’une phase à l’autre,
-
Réalisation
des évènements du cycle.
Abondance des complexes cycline–cdk au
cours du cycle :
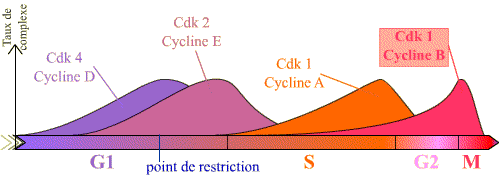
Il y a une
accumulation progressive (stock de complexe inactifs) puis une activation
brutale.

|
Moment du
cycle |
Complexe
Cycline / Cdk |
Effets du complexe |
|
G1 |
Cycline D /
Cdk4 et Cycline D /
Cdk 6 |
|
|
G1/S |
Cycline E /
Cdk 2 |
|
|
S |
Cycline A /
Cdk 2 |
|
|
G2/M |
Cycline B /
Cdk 1 |
|
§ Régulation de l’activité des
cdk :
(1) Synthèse –
dégradation des cyclines associées,
(2)
Kinases :
-
CAK
(Cdk Activating Kinase) = cycline H /
cdk7 ou autophosphorylation de cdc2,
-
Polo
K,
-
Wee
1.
ou Phosphatases :
-
Cdc25
(activatrices ou inhibitrices)
(3)
Inhibiteurs
CKI (cdk inhibitor) 3 familles :
-
Inks
(Inhibitors of kinases),
= p15INK
4,
p16INK 4, p18INK
4,
p19INK 4.
" Liaison
spécifique de cdk4 et cdk6.
-
Cips
(Cdk inhibitory proteins),
-
Kips
(Kinase inhibitory proteins)
= p21CIP
1,
p27KIP 4, p54KIP
2.
" Liaison
spécifique du complexe cdk2/cycline
" Masquage du
site ATP
Changements de conform ation :
-
Liaison
de la cycline :
" Accessibilité
Thr14, Tyr15, Thr161 (cdk1) aux
protéines régulatrices (kinases ou phosphatases)
"
Modification
du site ATP.
-
CAK
(cdk1, cdk4) :
" Phosphorylation
de Thr161,
"
Accès
aux sites de protéines cibles.
-
Wee1
et cdc25 :
" Phosphorylation
de Thr14 et Tyr15,
"
Inhibition
de l’accès de l’ATP.
-
CDI :
" p21 bloque le
site ATP,
" p16 bloque la
liaison de la cycline.

p53 est un
facteur de transcription synthétisé lors d’une agression (apoxie, température,
rayonnement) qui induit l’arrêt de la croissance et l’apoptose.
v Régulation de la succession
des 4 phases :
Ø Passage
G0–G1 :
La cellule fille
en sortie de mitose entre soit en prolifération (G1), soit en quiescence (G0)
En G0, il n’y a pas de cyclines et E2F est inactif par la liaison pRb. Les
facteurs de croissance ou mitogènes entraînent l’entrée de la cellule dans le
cycle.

Exemple d’étude : Influence du
facteur de croissance CTGF (Connective
Tissue Growth Factor) dans le cas de
néphropathies (utilisation d’une lignée cellulaire) :
-
Cytométrie
en flux :
|
|
G0/G1 |
S |
G2/M |
|
|
Témoin |
91% |
2% |
7% |
Absence de
progression G1"S |
|
+ CTGF |
91% |
3% |
6% |
|
|
+ TGF |
91% |
3% |
6% |
|
|
+ FCS (sérum
de veau fœtal) |
58% |
12% |
30% |
Progression G1"S |
-
Il
y a l’activation de la voie ERK par le facteur de croissance.
-
L’induction
des inhibiteurs des cdk (western blotting) permet le maintien de pRb sous
une forme non phosphorylée.
Ø Passage
G1–S :
§  Voie Ras :
Voie Ras :
§ G1 précoce :
Le
complexe cycline D / cdk4 agit sur pRb en libérant le facteur de transcription
E2F, ce qui permet la transcription de la cycline E.
Il y a une boucle d’amplification :


Le point de
restriction est la limite de G1 précoce / G1 tardif.
§ Passage du point de
restriction :
Il
correspond à l’activation des complexes :
-
Cycline
D / cdk4,
-
Cycline
A / cdk2,
-
Cycline
E / cdk2.
Þ
Cela permet l’induction de la réplication des chromosomes :
-
ADN
polymérase, ligases, topoisomérases,
-
Enzymes
synthétisant les nucléotides,
-
Protéines
structurales (histones),
-
Facteurs
d’initiation de la réplication, etc.
Þ Cela entraîne
la duplication du centrosome.
La
nucléophosmine se lie au centrosome à la fin de la mitose, bloquant ainsi sa
duplication. Le complexe cycline E / cdk2 phosphoryle la nucléophosmine qui se
détache du centrosome.
Il y a une augmentation de l’activité de
la kinase calmoduline Ca2+ dépendante (CAM
KII) qui permet la duplication du centrosome.
Ø Passage
G2–M = entrée
en mitose :
Il y a la
dégradation de la cycline A, accompagnée par l’accumulation progressive du
complexe cycline B / cdk1. Cdk1 est phosphorylé sur le Thr161 par
= Pré–MPF cytoplasmique

L’activation
du complexe cycline B / cdk1 est brutale :
-
Passage
nucléaire de cdc25 en fin de G2,
-
Activation
de cdc25 par la polokinase 1 (= Plk1)
-
Elimination
des 2 phosphores du site ATP.
Il y a aussi une
auto–activation de cdc25 par le complexe cycline B / cdk1 et l’inactivation de
Wee1 phosphorylé par ce même complexe.

Cdc25 présente
des séquences de localisation cytoplasmique (Cy), nucléaires (NLS) et
d’exportation (NES)
Le
complexe cycline B / cdk1 phosphoryle plusieurs protéines cibles :
|
-
La condensine et l’histone H1 |
Þ Condensation des chromosomes |
|
-
Les lamines |
Þ Désorganisation de l’enveloppe nucléaire |
|
-
Les MAPs |
Þ Assemblage du fuseau mitotique |
|
-
L’APC (Anaphase Promoting Complex =
cyclosome) |
Þ Assemblage du fuseau mitotique |
|
-
Cdc20 (=
adaptateur) |
|
Il reconnaît
aussi les protéines avec un signal de destruction de nucléotides comme la
cycline A et la sécurine.
La
cohésion et la séparation des chromosomes se fait par la cohésinr. Il s’agit du
complexe protéique responsable de l’association des chromatides sœurs. Il est
composé de plusieurs sous–unités :
-
Smc1 +
Smc3 (Structural Maintenance of
Chromosomes)
-
Scc1 +
Scc3 (Sister Chromatid Cohesion)

Lors de la
métaphase, il y a la phosphorylation de la cohésine (au niveau de Scc1) par
Au début de
l’anaphase, il y a la dégradation de la cohésine par la séparase (=
endopeptidase de type carpase) La séparase est sous sa forme inactive lorsque
elle est associée à la sécurine. L’ubiquitinisation de la sécurine (APC /
cdc20) et sa dégradation entraîne la libération de la séparase. Elle va alors
être phosphorylée par le complexe cycline B / cdk1, ce qui la rend active.
Ø Sortie
de mitose :
§ Inactivation du complexe
cycline B / cdk1 :
Il se fait par
la protéolyse ubiquitine dépendante de la cycline B.

Cdh1 est
un adaptateur (cycline B, cdc20, etc.)
v Les points de contrôle du
cycle :
Arrêt du cycle si :
-
Lésions
de l’ADN : DDCP (DNA Damage
CheckPoint)
Þ
Arrêt en G1, S ou G2
Þ
Absence de transition G1–S.
-
Anomalie
de la réplication : RCP (Replication
CheckPoint)
Þ
Absence de transition G1–S.
-
Anomalie
de la répartition équitable des chromatides sœurs (liaison des fibres
kinétochoriennes : MCP (Mitotic
CheckPoint)
Þ
Absence de transition métaphase anaphase.
Molécules mises en jeu :
-
Kinases de
liaison à l’ADN :
-
Kinase
ATM (Ataxia–télangiectasia mutée)
Elle est activée
par les radiations ionisantes et les coupures doubles brins.
-
Kinase
ATR (Ataxia–télangiectasia related)
Elle est activée
par les UV et les erreurs de réplication.
-
Kinase
ATM (Ataxia–télangiectasia mutée)
Elle
est activée par les radiations ionisantes et les coupures doubles brins.
-
Sérine–thréonine
kinases :
-
Chk1
(ChckPoint protein kinase 1)
-
Chk2
(ChckPoint protein kinase 2)
-
Protéine MAD2 (Mitotic Arrest Deficient 2)

Ø ![]() Blocage
G1–S :
Blocage
G1–S :

Ø Blocage
G2–M :
![]()

Ø ![]() Blocage
métaphase–anaphase :
Blocage
métaphase–anaphase :

APC = Anaphase Promoting Complex
v Cycle et apoptose :
Ø p53 :
rôle pivot :
50%
des tumeurs humaines sont dues à la mutation de p53. Les cellules normales
présentent un niveau faible de p53. Des dommages de l’ADN entraînent une
augmentation de p53.
p53 est un
activateur transcriptionnel. Il a 3 fonctions :
-
L’arrêt
de la croissance avec l’activation de p21,
-
La
réparation de l’ADN,
-
L’apoptose.
§ Régulation de p53 par Mdm2 (Mouse
double minute 2) :
L’expression de Mdm2 est activée par p53.

Liaison de p53 non phosphorylé par Mdm2
Þ
ubiquitination Þ dégradation via le protéasone.

Mdm2 est une
ubiquitine ligase.
§ Dommage de l’ADN :
Il y a
l’activation des protéines kinases ATM + chk2 entraîne la phosphorylation de
p53 (en position Ser15, Thr18 et Ser20) Il y a alors
absence de complexe p53–Mdm2, ce qui provoque l’accumulation de p53.
§ Arrêt de la croissance
cellulaire :

§ Apoptose :

Ø Apoptose :
|
Nécrose |
Apoptose |
|
-
Dommages mitochondriaux, -
Chromatine intacte, -
Lyse cellulaire (éclatement cellulaire) |
-
Structure mitochondriale conservée, -
Chromatine fragmentée et condensée, -
Fragmentation cellulaire (membrane intacte) -
Formation de corps apoptotiques. |
|
Þ Mécanisme non
régulé |
Þ Mécanisme
régulé (mort programmé) |
Observation de l’apoptose :
-
Cytofluorescence : marquage de
l’ADN avec un intercalant fluorescent (DAPI :
4’_6’_diamidine_2’_phénylindole dihydrochloride)
-
Fragmentation de
l’ADN :
migration sur gel d’agarose, marquage par le BrDu et observation de trainées blanches.
 3 phases de l’apoptose :
3 phases de l’apoptose :
Récepteur de mort (voie extrinsèque) :
 Þ Activation des caspases 8 et 10
Þ Activation des caspases 8 et 10
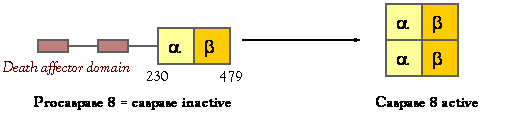 Activation :
Activation :
Voie intrinsèque :

Organismes pluricellulaires :
-
Cellules
spécialisées organisées en tissus (organes)
-
Les
vertébrés présentent plus de 100 types cellulaires spécialisées.
La cohésion,
l’architecture et la coordination fonctionnelle des tissus (et des organes)
nécessitent :
-
-
Les
jonctions cellulaires :
-
Jonctions
étanches (= serrées),
-
Jonctions
adhésives (= d’ancrage) : adhérens, hémidesmosome et desmosome,
-
Jonctions
gap (= communicantes)
Les relations
cellule–cellule (de types égaux ou non) et cellule–MEC sont indispensables au
maintien de l’identité cellulaire et au renouvellement des tissus.
Principaux tissus :
-
Nerfs,
-
Muscles,
-
Sang,
-
Lymphoïdes,
-
Epithéliums
(MEC peu abondante " lame basale),
-
Conjonctifs
(MEC abondante)
Jonctions cellulaires spécialisées :
Composition
de base d’une jonction :
-
Ligand
externe,
-
Protéine
transmembranaire (intégrée),
-
Molécule
de liaison (adaptateur, plaque),
-
Composant
du cytosquelette (filaments intermédiaires ou filaments d’actine)
Mise en place des jonctions :
-
Migration
ou non des cellules,
-
Adhérence
des cellules (cellule–cellule ou cellule–MEC) et organisation en tissus,
-
Réarrangement
du cytosquelette autour des molécules d’adhérence.
" Jonctions
spécialisées
Absence
de migration :
Exemple de
l’épithélium (lame basale)
Migration :
Exemple des
neuroblastes. Ils vont former des crêtes neuronales qui vont migrer, s’agréger et
se différencier en cellules nerveuses, cellules satellites et ganglions
périphériques.
Approches expérimentales différentes :
-
Microscopie
électronique Þ Jonctions
spécialisées
-
Tests
fonctionnels (analyses biochimiques) Þ molécules
d’adhésion
La convergence
de ces 2 approches a permis la découverte d’une molécule : CAM (Cell Adherens Molecule)
Liaison
cellule–cellule :
-
Cadhérines,
-
Sélectines,
-
Intégrines,
-
Connexines,
-
Occludines
et claudines,
-
Superfamille
des immunoglogulines.
3 modes de liaison cellule–cellule par
les molécules de surface :
-
Adhérence
homophile (même cellule),
-
Adhérence
hétérophile (cellules différentes),
-
Adhérence
via une molécule de liaison (MEC)
v Jonctions étanches (= tigh junctions = zonula occludens) :
Elles
sont retrouvées entre les cellules épithéliales (intestinales, glandulaires,
sertoli) et endothéliales (vaisseaux) Elles ne laissent aucun espace entre les
2 membranes plasmiques.
Þ
Barrière de perméabilité sélective :
-
Transport
transcellulaire des macromolécules (exemple du glucose)
= Transport via les cellules.
-
Transport
paracellulaire possible d’ions inorganiques (Na+) et d’eau
(variable selon les épithéliums)
= Transport
entre les cellules.
Exemple
du transport du glucose :
Le transport du
glucose se fait par diffusion facilitée dans le compartiment basolatéral et par
un symport avec le Na+ dans le
compartiment apical.
Exemple
d’un traceur (lanthanum) :
Il est stoppé
par les jonctions serrées de la barrière hématocéphalique et de la barrière
hématotesticulaire.
Des chaînes
protéiques forment la jonction étanche. Les protéines fibrillaires forment une
couronne continue.
Ø 4
types de protéines intégrées (tranmembranaires) identifiées :
-
Occludines,
-
Claudines,
-
Molécules
d’adhésion fonctionnelles (JAM),
-
Récepteur
de cooxackie et du stérotype 2/5 d’adénovirus (CAR)
JAM et CAR :
Elles font
partie de la superfamille des immunoglobulines. Elles présentent un domaine
transmembranaire et sont des récepteurs aux réovirus et adénovirus.
Occludines et claudines :
Elles présentent
4 domaines tranmembranaires et sont liées à des protéines cytoplasmiques
(protéines de la plaque ou adaptateurs)
Adaptateurs :
-
Protéines
des zonula occludens (Zo–1, Zo–2, Zo–3),
-
Cinguline,
-
PAR
3/6, etc.
Ils
permettent :
-
L’ancrage
des protéines intégrées aux éléments du cytosquelette,
-
Le
recrutement de molécules régulatrices et de signalisation (PKA, PKC, GTPases,
etc.),
-
L’assemblage
et désassemblage des jonctions,
-
La
régulation de la perméabilité paracellulaire.
Occludines et claudines = constituants
majeurs des jonctions serrées :
Les
claudines forment une famille de 24 membres.
L’absence
d’expression de la claudine 6, chez la souris, occasionne la mort précoce (2
jours post–natal) due à une déshydratation liée à l’absence de jonctions
serrées entres les cellules épithéliales épidermiques.
Les claudines sont associées aux
changements de sélectivité des solutés
Chez l’homme, la
mutation de la claudine 1 au niveau de l’anse de Henlé entraîne une déficience
en magnésium.
Ø Autres
fonctions des jonctions serrées :
-
Elles
interviennent dans la prolifération et la différenciation cellulaire.
Exemples : Zo–1 mutée (non fonctionnelle) entraîne la
croissance anarchique des disques imaginaux de drosophiles et la transformation
de cellules épithéliales de cornée en système circulatoire mésenchymateuses.
-
Elles
établissent et maintiennent la polarité cellulaire.
Exemples : Dans certains cancers, la perte de polarité
et des jonctions serrées sont liées ? le cancer de l’ovaire est dû à une
surexpression de la claudine 4.
v Jonctions d’ancrage :
Elles permettent
l’association d’éléments du cytosquelette entre les cellules voisines ou entre
une cellule et la matrice.
On
retrouve :
-
Þ
Relation avec les filaments intermédiaires
![]() Des jonctions
adhérentes Þ Relation avec
les filaments d’actine
Des jonctions
adhérentes Þ Relation avec
les filaments d’actine
-
Des
desmosomes
-
Des
hémi–desmosomes
 Structure de base de ces jonctions :
Structure de base de ces jonctions :
Ø Ceintures
d’adhérence et cadhérines :
Elles sont
impliquées dans l’ancrage intercellulaire (actine de 2 cellules différentes)
Les protéines impliquées dans la ceinture d’adhérence sont les cadhérines. Ce
sont des molécules d’adhérence intercellulaire dépendant du Ca2+.
§ Cadhérines de type
« classique » :
Elles
sont nommées en fonction des tissus où elles se trouvent en proportion plus
importante. Exemples :
-
Cadhérines
E " dans les
cellules épithéliales et embryonnaires.
Elles sont impliquées dans les jonctions
adhérentes.
-
Cadhérines
N " dans les
neurones, les muscles, le cœur et les fibroblastes.
Elles sont impliquées dans les jonctions
adhérentes et les synapses.
-
Cadhérines
P " dans le
placenta, l’épiderme et l’épithélium mammaire.
Elles sont impliquées dans les jonctions
adhérentes.
-
Cadhérines
VE " dans les
cellules endothéliales vasculaires.
Elles sont
impliquées dans les jonctions adhérentes.
Structure des cadhérines :
Ce
sont des glycoprotéines de 700 à 750 acides aminés formant des homodimères.
Elles présentent :
-
Un
domaine extracellulaire composé de 5 à 6 répétitions de structure. Ces domaines
sont importants pour les interactions protéine–protéine homophiles.
-
Un
domaine transmembranaire.
-
Un
domaine cytoplasmique établissant des liaisons avec les protéines de type
caténines (a,
b,
p120)
Les
caténines font la jonction avec l’actine, jonction dépendante du Ca2+ (5 sites de
liaison au Ca2+ au niveau du domaine
extracellulaire)
Si [Ca2+] < 0,05mM Þ Dissociation du dimère de cadhérine
Si [Ca2+] > 1mM Þ Homodimérisation des cadhérines et liaisons
cellule–cellule homophile.
Expérience :
-
On
isole des cellules « ¢F » issues
d’une lignée de fibroblastes mais qui n’expriment pas les cadhérines.
-
On
utilise une partie de ces cellules que l’on va transfecter avec l’ADNc dans un
vecteur exprimant la cadhérineE avec un fluorochrome.
-
On
utilise l’autre partie de ces cellules que l’on va transfecter avec l’ADNc dans
un vecteur exprimant la cadhérineL avec un autre fluorochrome.
-
On
mélange ces 2 nouveaux types de cellules en présence ou non de Ca2+.
Þ Il y a
formation de liaison homophile entre les cellules exprimant le même type de
cadhérine mais il y a absence d’interaction hétérophile.
Liaisons intracellulaires :
Les caténines
sont les adaptateurs entre la cadhérine et l’actine F (fibrillaire) Il existe 3
types de caténines : a, b et p120. Ces 3
caténines forment un complexe d’adhésion cellulaire cytoplasmique.
Les
cadhérines ont une importance dans l’adhérence entre les cellules, mais aussi
dans la prolifération cellulaire.
Certaines
tumeurs sont dues à la perte d’expression de certaines cadhérines ou dues à une
mutation de la caténine b.
La cadhérine N et la caténine b jouent un rôle
important dans la prolifération cellulaire des muscles lisses en réponse à un
facteur de croissance.
Homodimère de cadhérine N :
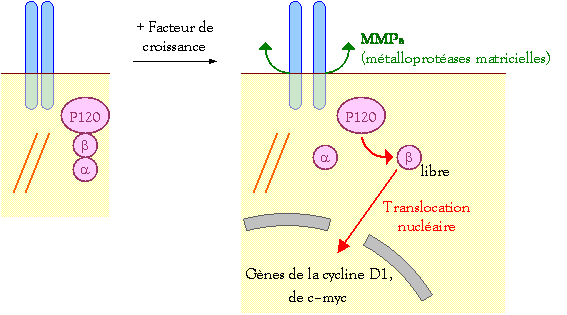
§ Cadhérines de type « non
classique » :
-
Desmocolline " au niveau de la
peau. Elle est impliquée dans les desmosomes.
-
Desmogléine " au niveau de la
peau. Elle est impliquée dans les desmosomes.
-
Cadhérine
T " au niveau des
muscles et des neurones. Elle ne forme pas de jonctions.
-
Protocadhérines " au niveau des
neurones. Elle est impliquée dans la formation des synapses chimiques.
Ø Desmosomes :
Þ Ancrage
cellule–cellule
Constitution :
-
Le
ligand externe et les protéines transmembranaires sont constitués de desmoléine
et de desmocholine.
-
La
plaque de liaison est formée de plakoglobine, plakophiline et de desmoplakine.
-
Des
filaments intermédiaires sont attachés à cette plaque.

Ø Hémi–desmosomes :
Þ Ancrage cellule–MEC
Cet
ancrage met en jeu des intégrines. Il s’agit de glycoprotéines membranaires
servant de récepteurs de surface pour les constituants de
Il y a une
grande diversité des sous–unités a (au nombre de
18) et b
(au nombre de 8)
Exemples :
|
Intégrine : |
Ligand (MEC) : |
Distribution : |
|
a5–b1 |
Fibronectine |
Ubiquiste |
|
a6–b1 |
Laminine |
Ubiquiste |
|
a7–b7 |
Laminine |
Muscles |
|
a2–b3 |
Fibrinogène |
Plaquettes |
Constitution :
-
Un
domaine de liaison à la matrice qui lie des cations divalents,
-
Un
domaine transmembranaire,
-
Un
domaine cytoplasmique de liaison aux protéines associées aux filaments
intermédiaire.
La spécificité
de liaison du ligand matriciel dépend de la nature du cation divalent, du
domaine extracellulaire de la sous–unité a et d’un motif
de reconnaissance au niveau du ligand (MEC) de type GRD (Arg–Gly–Asp)
Les cellules
peuvent réguler l’activité de leurs intégrines. L’activation des voies de
signalisation va activer les intégrines, entraînant la liaison de l’élément
matriciel en présence de Ca2+ ou Mg2+ et la liaison
des intégrines aux filaments intermédiaires.

Exemple : Agrégation plaquettaire = liaison du
fibrinogène des hématies.
Il existe aussi
des désintégrines (venin de serpents) qui présentent des séquences GRD
compétitives qui empêchent l’agrégation.
![]() L’activation de la voie de signalisation
intracellulaire par les intégrines est la voie FAK (Focal Adhesion Kinase) :
L’activation de la voie de signalisation
intracellulaire par les intégrines est la voie FAK (Focal Adhesion Kinase) :
Contact
cellule–cellule ou cellule–MEC,
ß
Agrégation
localisée des intégrines,
ß
Activation de la
voie de signalisation (tyrosine kinase),
ß
Modifications
locales du cytoplasme au point de contact.
Interaction MEC–intégrine
ß
Autophosphorylation
de
ß
Liaison de
ß
Phosphorylation
de
ß
Recrutement du
complexe Grb2–Sos
ß
Activation de la
voie des MAP Kinases

Dans
le cas de cellules en culture, on étudie leur croissance (prolifération) en
réponse à des facteurs de croissance s’attachant à
Si les cellules épithéliales,
endothéliales et musculaires se détachent de
Les
hémi–desmosomes ont une ressemblance ultrastructurale avec les desmosomes, mais
ils ont une nature chimique différente.
|
|
Protéines transmembranaires |
Ligand extracellulaire |
Cytosquelette |
Protéine de liaison au cytosquelette (plakine) |
|
Desmosome |
Cadhérines |
Cadhérines Cellule
voisine |
Filaments
intermédiaires |
Plakoglobine, Plakophiline, Desmoplakine. |
|
Hémi–desmosome |
Intégrines |
|
Filaments
intermédiaires |
Plectine, BPAG–1 |
v Jonctions communicantes (GAP) :
La
communication cellulaire consiste en le passage d’ions inorganiques et de
petites molécules hydrosolubles.
On a étudié la limite d’exclusion de ces
jonctions avec des injections intracellulaires de molécules fluorescentes. La
limite d’exclusion a été estimée à un peu plus de 1000kDa.
Ø Fonctions :
Communication électrique entre cellules
d’un tissu excitable :
Elle permet le
couplage électrique de part la rapidité de propagation du potentiel d’action.
Elle entraîne donc des contractions synchronisées des cellules musculaires
cardiaques ou des cellules musculaires lisses de l’intestin.
Communication biochimique :
Cela concerne
l’ATP, l’AMPc, le Ca2+, etc.
Ø Structure :
Elles sont
composées de connexines. Il s’agit d’une protéine à 4 hélices a. Il en existe
plus de 20 formes chez l’homme, classées en 3 classes principales (a, b, g)
Maladies génétiques associées à des
mutations des connexines :
-
hCx
32 b Chromosome X Þ
Neuropathie de Charcot Marie–Tooth–X
-
hCx
46 a Chromosome 14 Þ
Cataracte congénitale
Structure dynamique : contrôle de
l’ouverture des GAPs :
Fermé
![]()
![]() Ca2+ élevé
Ca2+ élevé
pH acide
Ouvert
Ca2+ faible
pH basique
La régulation du
couplage des jonctions GAP se fait par un neurotransmetteur (par exemple, la
dopamine dans les neurones de la rétine)
v Autres molécules d’adhésion :
Il
s’agit de la superfamille des immunoglobulines. Elle permet une adhésion
cellule–cellule indépendante du Ca2+.
-
N–CAMs
(Neuronal Cell Adhesion Molecules) " Liaison homophile.
-
I–CAMs
(InterCellular Adhesion Molecules) " Liaison hétérophile.
N–CAMs :
Il
existe 20 formes issues d’un même ARNm (épissage alternatif)
-
Le
domaine extracellulaire présente 5 domaines de structure Ig (présence de ponts
disulfure) et 2 domaines de structure type fibronectine.
-
Il
y a la présence d’une molécule d’ancrage (= glycosyl_phosphatidyl_inositol) qui
forme l’hélice transmembranaire avec un domaine cytoplasmique plus ou moins
important.
Nectines :
Elles
sont constituées de 3 boucles Ig et de Nectin_like (Necls)
Elles
s’associent aux cadhérines, comme dans le cas des contacts synaptiques.