
Retour au sommaire des cours |

Une version pdf est à votre disposition ici. |
Embryologie : étude
du développement dun organisme depuis luf fécondé (= cellule uf) jusquà
létat adulte, sans oublier le processus de vieillissement.
La fonction de reproduction :
caractère qui définit le vivant ®
pérennité des espèces
Sexuée ou asexuée.
Reproduction asexuée :
les individus sont génétiquement semblables aux parents sous réserve de
lincidence des mutations.
Elle est observée chez les
eucaryotes simples (algues unicellulaires et Protozoaires)
= reproduction par mitose.
Elles est plus
généralement répandue chez les animaux ayant une organisation fonctionnelle
simple comme les Métazoaires Diploblastiques (Éponges)
et certains Triploblastiques
(Échinodermes, Annélides)
Certaines
espèces présentent une reproduction alternant phase sexuée et asexuée.
v Reproduction
sexuée :
Phase de fécondation :
phénomène de fusion de 2 gamètes haploïdes de même espèce.
®
formation dune cellule uf = zygote (diploïde)
Formation de luf :
=
aboutissement des gamétogenèses ♂ et ♀
=
début de construction dun nouvel organisme
®
maintien de lespèce (ce nest pas une fonction vitale pour lindividu)
Elle est
observée chez presque tous les Métazoaires.
Lindividu
fils reçoit un génome nouveau (la moitié de chacun de ses parents)
® recombinaison génétique.
La
reproduction de lindividu est exclusivement dévolue aux gamètes (= cellules
spécialisées uniquement dans cette fonction)
En général,
les gamètes ♂
et ♀
sont produits par des individus distincts : espèce gonochorique.
♂ :
testicule ®
spermatozoïdes
♀ :
ovaire ®
ovule
¹ espèce hermaphrodite (Mollusque,
Vers) :
♂♀
: ovotestis ®
spermatozoïdes et ovules
En général, la
fécondation est croisée (¹ autofécondation)
Les 2 sexes
produisent des cellules germinales primordiales (C.G.P) = précurseurs des
gamètes.
![]()

![]() Individu
mature ® C.G.P Spermatogenèse
Individu
mature ® C.G.P Spermatogenèse
Sexuellement Méiose = réduction
chromatique (R.C) Ovogenèse


Cycle haplo-diplobiontique
Gamètes
Croissance
Conséquences : Modification des combinaisons
génétiques,
Zygote
= assortiment génique unique sur des milliards dautres.
Le patrimoine
héréditaire est reproduit par la cellule uf. Si une mutation se présente, elle
se perpétuera de génération en génération.
Cela
entraîne la variabilité et ladaptation des espèces.
Conditions environnementales (=
épigénétiques) : se surajoutent au patrimoine
héréditaire et se rendent également source de variabilité.
®
Évolution
Lembryologie est-elle réellement
indispensable ?
On la retrouve
dans des applications biologiques diverses :
-
Létude des mécanismes
moléculaires et cellulaires lors du passage dun être unicellulaire (cellule
uf) à un être pluricellulaire organisé (= embryon puis adulte)
-
Létude de lexpression des gènes
du développement embryonnaire, gènes intervenant précocement dans le
développement embryonnaire :
-
Etablissement de la polarité
embryonnaire antéro-postérieure (A/P) et dorso-ventrale (D/V),
-
Edification des lignages, voies
de différenciation ou modes de formation dun tissu, dun organe.
Existence de 4 étapes pour que luf
devienne embryon
v La
fécondation :
= union dun spermatozoïde et dun ovule
La cellule uf est hétérogène :
Présence
de régions ± granuleuses, ± colorées, ± lourdes, etc.
Elle contient toutes les potentialités
du futur individu :
=
cellules mésenchymateuses indifférenciées :
-
Adipocytes,
-
Fibroblastes,
-
Ostéoblastes,
-
Chondrocytes,
-
Myocytes.
Anisotropie =
tous les axes de luf pas identiques.
Chez
certaines espèces : dès le stade celluleuf, le plan de symétrie
bilatéral est déjà établi (exemple : Amphibien)
v Phase
de segmentation :
= division (ou multiplication)
cellulaire.
®
passage de létat unicellulaire à létat pluricellulaire.
Ø Caractéristiques :
Pas daugmentation de la masse par
rapport à la masse initiale de la celluleuf, ni mouvement des parties les
unes par rapport aux autres (= phase non
dynamique)
® diminution de la taille des cellules.
v Gastrulation :
Ø Caractéristiques :
-
animaux
triploblastiques (= tridermiques) : mise en place
de 3 feuillets embryonnaires :
-
ectoderme, superficiel (peau),
-
mésoderme, intermédiaire
(muscles),
-
endoderme, interne (tube
digestif)
-
animaux
diploblastiques (= didermiques) :
-
ectoderme,
-
endoderme.
-
Mis en place du tube digestif et
de larchitecture de lorganisme (migration cellulaire)
® phase dynamique
A la fin de la gastrulation :
mise en place du système nerveux central
= Neurulation
v Organogenèse,
histogenèse et morphogenèse :
= Mise en place des tissus et organes.
®
processus de différenciation cellulaire avec lexpression sélective des gènes.
=
une cellule nexprime que les gènes nécessaires à sa fonction biologique.
A la suite de lembryogenèse :
Une période
fonctionnelle permet lédification de lorganisme adulte.
Il y a une interaction entre les 3
dernières phases.
v Caractéristiques
générales des ufs :
Selon animaux :
Oviparité
absolue : développement en dehors de lorganisme
matériel (P.A.R.O), sans établissement de liens histologique.
Viviparité :
développement à lintérieur de lorganisme maternelle et mise en place de
relation histologiques (placenta)
Divers
degrés intermédiaires :
-
Ovoviparité : incubation puis éclosion (= ponte)
-
Paraviviparité : éclosion (= ponte) puis incubation.
-
Formes
structurale et dimensionnelle des ufs :
Elles sont variables dans le monde
animal.
La grosseur de luf détermine
directement les dimensions de lorganisme qui va se développer.
v Plan
moléculaire :
uf = protéines, lipides, acides
nucléiques, glucides.
Ø Les
protéines :
-
de réserve (pour nutrition de
lembryon),
®
synthèse par lovocyte (origine endogène) + origine exogène.
-
dusage (pour le développement),
-
de structure (enzymes,
précurseurs)
Ø Acides
nucléiques :
ADN, ARNTOTAUX.
§ ARN :
·
ARNR (ribosomaux) :
= 95 % des ARN totaux (les plus
abondants)
La quantité dARNR
est proportionnelle au nombre de ribosomes.
Cellule
normale : 106
ribosomes,
Cellule
uf : 107
ribosomes.
·
ARNT (de transfert) :
= 3 % des ARN totaux.
·
ARNNH (nucléaire
hétérogène) = ARNM (messager) :
= 2 % des ARN totaux.
et pourtant
ces ARN ont une très importante variation qualitative
® codage dune dizaine milliers de protéines.
= Complexité de linformation de
luf (3,7.107
nucléotides)
puis
cette complexité de linformation diminue quand lindividu sorganise.
Les ARNM
codent pour des protéines nécessaires lors de la segmentation :
-
Protéines membranaires,
-
Composants du cytosquelette,
+ dautres ARNM
qui codent des protéines impliquées dans le métabolisme de la réplication de
lADN (= machinerie de traduction)
ADN = ADNNUCLEAIRE
+ ADNCYTOPLASMIQUE
=
ADN mitochondriaque (80%)
+
ADN baignant dans le cytoplasme (20%)
·
SN ARN :
®
Implication dans les particules dépissage.
·
ARNINTERFERANT (découverte
récente) :
= ARNANTISENS
®
empêche un gène de sexprimer : blocage et dégradation de lARNM
ou de la protéine.
A U G
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ARNM
ARNM
ARNANTISENS ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
U A C
v Vitellogenèse :
Le vitellus se
situe dans le cytoplasme de luf, il sert de réserve nutritive à lembryon
durant le début du développement.
Le siège de la
vitellogenèse est au niveau de lovocyte IAIRE bloqué au stade
Diplotène de la 1ère division méiotique. On y observe 2
phases :
-
La phase de pré-vitellogenèse (ou phase de petit accroissement),
(2
3 ans)
-
La phase de croissance (ou phase de grand accroissement)
(3
mois)
-
Quand lovocyte IAIRE
nest pas entouré de cellules folliculaires (= nourricières) :
Pénétration de
monomères (oses, acides aminés) pour effectuer la synthèse des macromolécules.
-
Quand lovocyte IAIRE
est entouré de cellules folliculaires (= nourricières) :
Pénétration de
substance semi-développée (polyoses, polypeptides) dont la synthèse finale
seffectue dans luf.
La composition
chimique du vitellus est variable selon les organismes. On trouve 3
types :
-
le vitellus glucidique,
-
le vitellus lipidique (chez les Poissons),
-
le vitellus protéique (la plus
part des uf)
v Classification
des ufs :
Quil soit
vierge ou fécondé, la cellule uf est une grosse cellule sphérique, dépourvue
de flagelle. De plus, les réserves cytoplasmiques sont variables :
-
Le cytoplasme nutritif (réserves
vitellines),
-
Le cytoplasme formatif (pas de
réserve nutritive)
Labondance et
la répartition du vitellus sont très variables en fonction des espèces, ce qui
permet la classification des ufs.
Ces critères
sont très importants pour la détermination du type de développement.
-
Vitellus peu abondant, voire
absent :
 Il y a un mélange des 2
types cytoplasmes.
Il y a un mélange des 2
types cytoplasmes.
La
phase de segmentation implique luf dans son entièreté, qui va se
compartimenter en cellules de plus en plus petite.
On parle de segmentation
totale et duf holoblastique.
-
Vitellus abondant :
Il
a une localisation distincte par rapport au cytoplasme formatif.
![]()
 Le vitellus inhibe les
mitose, la segmentation au niveau du cytoplasme formatif.
Le vitellus inhibe les
mitose, la segmentation au niveau du cytoplasme formatif.
On parle de segmentation partielle ou méroblastique et
duf méroblastique.
Ø Les
ufs holoblastiques :
§ Les ufs alécithiques (ou alécithes) :
Chez les Mammifères
placentaires, la perte du vitellus a été secondaire lors de lévolution.
Ancêtre des Mammifères :
ufs télolécithes (très riches en vitellus)
§ Les ufs oligolécithes :
Un peu plus de
vitellus.
Le vitellus
est sous forme de petites granulations qui se répartissent dans tout le
cytoplasme
®
Chez les Échinodermes (Étoile de mer, Oursin)
-
Luf est polarisé :
-
Le pôle supérieur (ou pôle
animal)
=
point démission des globules polaires lors de lovogenèse.
Pour les ufs
alécithes : le point démission des globules polaires mobiles.
-
Le pôle inférieur (ou pôle
végétatif)
Le noyau est
toujours excentré vers le pôle animal.
§ Les ufs hétérolécithes :
Vitellus
beaucoup plus abondant.
Le vitellus
est sous forme de plaquettes vitellines qui se répartissent de manière
hétérogène, mais surtout dans lhémisphère végétatif (exemple des Amphibiens)
Ø Les
ufs méroblastiques :
§  Les ufs télolécithes :
Les ufs télolécithes :

Le cytoplasme nutritif est distinct du cytoplasme formatif.
= pôle végétatif = pôle animal (+ noyau)
Exemple :
Poissons et sauropsidés (= Reptiles et Oiseaux)
§ Les ufs centrolécithes :
Le vitellus
est centré et entouré par le cytoplasme formatif.
®
Chez les Arthropodes (Crustacés, Insectes)
v Les ufs oligolécithes : luf dOursin :
On les observe
chez les Échinodermes des fonds marins (espèces gonochoriques)
Ce sont des
ufs libres en eau de mer, sphérique, avec un cytoplasme légèrement coloré.
Luf est
entouré dune membrane vitelline mince, transparente, doublée extérieurement
par une gangue gélatineuse (®
peu de vitellus)
Il présente
une répartition presque uniforme, légèrement orientée dans lhémisphère
végétal.
![]()
![]()
![]()
 Globules
polaires : ils sont émis dans lovaire avant la
ponte.
Globules
polaires : ils sont émis dans lovaire avant la
ponte.
H.A La
fécondation est immédiate après la ponte.
Dès
la fécondation, le pigment jaune orangé de luf vierge se concentre et
H.V forme
lanneau sous équatorial.
Il y a un antagoniste entre
2 gradients :
-
Gradient des
propriétés métaboliques et des organites
(mitochondries et ribonucléoprotéines pour les ribosomes),
-
Gradient vitellin.
v Les
ufs hétérolécithes :
Ø Luf de Grenouille (Amphibiens) :
-
La femelle pond des ufs vierges
dans leau sous la forme de paquet et le mâle émet du sperme ®
fécondation
-
Luf est riche en
vitellus : membrane vitelline entourée dune gangue gélatineuse externe.
-
Un pigment noirâtre est présent
au niveau du cytoplasme superficiel qui recouvre les ⅔
de luf, et est absent dans le dernier ⅓.
=
calotte blanchâtre dont le centre est le pôle végétatif. Elle correspond
à la région la plus dense.
Le centre de
lhémisphère pigmenté est le pôle animal (reconnaissable par la position des
globules polaires)
-
En position subéquatoriale (juste
dessus de la calotte blanchâtre), on trouve le croissant gris (ou
dépigmenté) Il permet de reconnaître la symétrie latérale de luf.

![]()
![]()
![]() 30°
30°
-
La fécondation se fait dans le
pôle animal.
-
Les plaquettes vitellines sont
plus concentrées et plus grandes dans le pôle végétal ; alors quelles
sont de plus en plus disparates et de petite taille en se dirigeant vers le
pôle animal.
-
Le gradient de
ribonucléoprotéines (R.N.P) est mis en place lors de lovogenèse :
®
les ARNT
et les sous unités ribosomiques sont très concentrés autours du noyau de
lovocyte.
-
La présence de gradients vitellin
et R.N.P détermine une anisotropie de luf, qui est dit hétérogène.
-
Avant la fécondation, le noyau de
lovocyte est bloqué en Métaphase II.
-
La fécondation provoque des
modifications avant la segmentation et luf acquiert une symétrie bilatérale.
-
La pénétration du spermatozoïde
déclenche lémission du 2ème globule polaire et la fin de la méiose.
®
Lovocyte II devient un ovotide, et le noyau de lovotide devient le pronucléus
femelle (ADN décondensé et nouvelle enveloppe nucléaire)
-
Le spermatozoïde entre en contact
avec lovocyte II au niveau de lhémisphère animal :
-
Fusion des membranes plasmiques,
-
Incorporation du noyau
spermatique dans la cytoplasme de lovocyte II,
-
Décondensation de la chromatide du
noyau du spermatozoïde,
-
Nouvelle enveloppe.
®
Le spermatozoïde devient le pronucléus mâle.
-
Le pronucléus mâle se dirige vers
le pronucléus femelle (dans lhémisphère femelle) grâce au système
microtubulaire du spermaster (= centriole proximal), en entraînant derrière lui
une traînée spermatique (pigmentée)
-
Fusion des pronucléi dans
lhémisphère animal,
-
Formation dune membrane de
fécondation (= enveloppe nucléaire),
-
Rotation déquilibration (ou
dorientation) :
®
le pôle animal est orienté vers haut et le pôle végétal vers le bas.
-
Rotation de symétrisation :
®
apparition du croissant gris sur la surface dorsale du future embryon.
Luf vierge
présente une symétrie axiale (axe P.A / P.V) mais pas de symétrie bilatérale.
-
Lexpérience dune fécondation
artificielle (à laide dune micropipette) montre que, quel que soit lendroit
du dépôt du spermatozoïde, le croissant dépigmenté glissera à lopposé de la traînée
spermatique.
Ø Luf de Dentale (Mollusque) :
La plupart des
Mollusques et des Annélides présente une segmentation spirale. Lensemble des
invertébrés présentant cette segmentation est appelé Spiralia.
Luf est
sphérique et pondu dans le milieu marin. Il possède une large ceinture de
granulation rouge brique au niveau de léquateur (entre lhémisphère végétal et
lhémisphère animal)
Lors de la
ponte, lovocyte est bloqué en Prophase I (stade diplotène), la pénétration du
spermatozoïde entraîne la poursuite de la méiose.

![]()
![]() Calotte
de cytoplasme
Calotte
de cytoplasme
![]() hyalin
hyalin
v Les
ufs télolécithes :
Ø Luf de Poisson (
Luf pondu
est un ovocyte II bloqué en Métaphase II. Cest une sphère jaunâtre, résistante
(protection dans leau) et riche en vitellus, sous forme de gouttelettes
lipidiques.
®
hypertrophie au niveau de lhémisphère végétal.
Le cytoplasme
formatif, où se situe le noyau, se présente en forme de disque au niveau du
pôle animal et est appelé disque germinatif
ou blastodisque.

Vitellus lipidique
Ø Luf doiseau (
-
Il est riche en vitellus et isolé
du milieu extérieur.
Lors de la
ponte, le germe (ou embryon) se développe.
-
Dans la partie haute de
loviducte, luf est fécondé (= jaune) Le vitellus est synthétisé par le foie
maternelle et est déposé en couches concentriques, alternativement jaunâtre
(synthèse diurne ®
riche en lipide et en caroténoïdes) et blanchâtre (synthèse nocturne)
Chez
-
Le noyau et le cytoplasme
formatif sont en périphérie, vers le pôle animal (= disque germinatif,
blastodisque ou éventuellement encore appelé cicatricule)
-
Lors du cheminement dans
loviducte, luf tourne (en général) dans le sens des aiguilles dune montre
et est entouré par plusieurs couches dalbumen (= blanc) Le jaune sera maintenu
dans le blanc par des structures appelées chalazes.
-
Chalaze située à droite de
lembryon est dite senestre (enroulement dans le sens inverse des
aiguille)
-
Chalaze située à gauche de
lembryon est dite dextre (enroulement dans le sens des aiguille)
-
Une partie de lalbumine va être
entortillée en présence dune condensation mucilagineuse.
-
Au final, on observe 3 membranes
kératinisées :
-
La membrane coquillière interne,
-
La membrane coquillière externe,
-
La coquille calcaire poreuse
déposée quand luf est pondu.
-
La latébra :
elle correspond à la masse centrale de vitellus fermée initialement.
-
Le noyau de Pander + le
col : chemin de migration de la cicatricule vers la surface du cytoplasme
pendant la croissance de luf.
-
Une chambre à air est présente au
niveau du gros bout de luf. Elle correspond à un dédoublement des membranes
coquillières interne et externe.
-
Luf est un ensemble clos, mais
les échanges avec lextérieur gazeux et thermiques sont possible.
-
Lembryon a une disposition
perpendiculaire par rapport au grand axe de luf avec la tête orientée. Le
sens de rotation de luf suit le plan dorso-ventral (symétrie bilatéral)
-
Région ventrale : région au
contact du vitellus.
-
Région dorsale : région le
plus à lextérieur (surface du blastodisque)
v Les
ufs alécithes de Mammifères :
-
Lors de la ponte (=ovulation),
lovule est libéré par rupture du follicule de De Graaf. Il est entouré dune
membrane pellucide, doublée extérieurement de
-
Lors de la fécondation, au niveau
de lamPoule (⅓
externe de loviducte), il y a émission du 2nd globule polaire.
Tous deux sont
émis dans le pôle animal ; ils sont aussi très volumineux et mobiles sous
la membrane pellucide.
-
Luf fécondé migre vers lutérus
par contraction péristaltique de loviducte et par les mouvements ciliaires de
lépithélium tubaire.
v Les ufs centrolécithes dInsectes (
-
Lovogenèse est réalisée, en 8
jours, en collaboration avec des cellules nourricières.
-
Lovaire est constitué
dovarioles mérioïstiques qui collaborent avec des cellules nourricières (en
opposition aux ovarioles panoïstiques qui ne nécessitent pas de collaboration) Cest
là que se situent les cellules germinales primordiales.
-
Une cellule germinale primordiale
subit une mitose et donne 2 cellules :
-
Une cellule souche (cellule
germinale primordiale),
-
Une cellule à lorigine de la
chambre ovarienne (ou ovovarique)
-
Après 4 mitoses de la cellule
initiale, on obtient une grappe de 16 cellules à cytodiérèse (=plasmodiérèse)
incomplète. Il y a un contact cytoplasmique entre les 16 cellules, on parle de
ponts cytoplasmiques.
-
La cellule 1, dite sexuelle,
devient le gamète ♀ qui
grossit et subit la méiose.
-
Les 15 autres deviennent les
cellules nourricières.
-
Les cellules nourricières
subissent 8 cycles de réplication de lADN sans mitose. Au départ, chacune
possède 4 lots de n chromosomes (= 2 lots de 2n) À la fin de ces réplications,
elles possèdent 1.024 lots de n chromosomes.
On
a donc obtenu 1.024*14 »
15.000 génomes identiques qui fonctionnent pour 1 seule cellule et dont le
volume cellulaire est multiplié par 90.000 en 3 jours.
-
Les cellules nourricières sont
appelées cellules polyténiques (= qui nont pas le même nombre de chromosomes
que les autres cellules)
-
Elles synthétiques des ARN et des
protéines.
-
Les cellules folliculaires
entourent les cellules nourricières et lovocyte.
-
Lors de la maturation de
lovocyte, il y a une résorption des 15 cellules nourricières au dépend de la
cellule sexuelle qui grossit.
-
La chambre ovarienne
= uf allongé, ellipsoïde, riche en vitellus. Elle est recouverte par le
chorion.
-
Le chorion = coque
épaisse et rigide. Il présente un micropyle qui permet le passage du
spermatozoïde contenu dans la spermathèque. Lors de la ponte, il est fixé sur
un support.
v Introduction :
Ø Caractéristiques :
-
Il sagit de la phase qui suit la
fécondation et consiste en une succession de mitoses avec cloisonnement
cytoplasmique. Le germe se compartimente donc en cellules de plus en plus
petites. Ces divisions mitotiques sont appelées divisions de segmentation ou
clivages.
-
Lors de cette phase, la masse
totale de lembryon = la masse totale de la cellule uf.
Lors
de chaque division, la masse dune cellule fille = ½ de la masse de la cellule
mère.
®
augmentation du rapport nucléocytoplasmique : VNucléaire / VCytoplasme
-
1er clivage :
2 cellules filles (= blastomères) à
partir de la cellule uf.
-
Le germe passe par le stade
morula (aspect dune mûre), puis par le stade blastula (apparition dune cavité
de segmentation, le blastocle)
-
Le type de la segmentation dépend
de la quantité de vitellus et donc de la classification des ufs.
-
uf télolécithe (vitellus très
important) : pôle inférieur de luf non segmenté.
-
uf alécithe, oligolécithe ou
hétérolécithe : segmentation totale (= holoblastique)
-
uf télolécithe, ou
centrolécithe : segmentation partielle (= méroblastique)
Ø Segmentation holoblastique :
-
Totale et égale :
le blastocle est entouré par une assise régulière de blastomères de même
taille ®
Cloblastule régulière (exemple de lOursin)
-
Totale et inégale :
le blastocle est entouré par 1 ou plusieurs assises de blastomères de tailles
irrégulières. ®
Cloblastule irrégulière
(exemple des Amphibiens)
-
Blastocle virtuel :
il est comblé par des blastomères végétatifs volumineux
®
Sterroblastule (exemple des Annélides)
-
Blastomères de tailles différentes :
-
![]()
![]() Petites :
micromères sil y a 2 tailles différentes.
Petites :
micromères sil y a 2 tailles différentes.
-
Grandes : macromères
-
Moyennes : mésomères sil y
a 3 tailles différentes.
Dans le cas
dune segmentation totale, selon la disposition des blastomères, on observe une
segmentation soit radiaire, soit spirale.
-
Segmentation totale
radiaire : alternance de clivages méridiens
(quartiers de blastomères verticaux) et latitudinaux (quartiers de blastomères
horizontaux)
®
symétrie radiaire = parfaite superposition des
blastomères les uns par rapport aux autres (exemple de lOursin et du début de
luf dAmphibien)
-
Segmentation totale
spirale : clivages obliques (chez Spiralia, les Annélides
et quelques Mollusques)
Ø Segmentation méroblastique :
= segmentation
partielle, soit discoïdale, soit superficielle.
-
Segmentation partielle discoïdale : chez
les ufs télolécithes (Poissons, sauropsidés)
Le pôle
inférieur nest pas segmenté ; seul le pôle supérieur (= disque germinatif
ou embryon) subit des clivages. Les blastomères sont regroupés sous forme de
disque appelé blastoderme ou blastodisque.
®
Discoblastule
= observation dune calotte de
blastomères qui repose sur le vitellus.
-
Segmentation partielle
superficielle : chez les ufs centrolécithes (Insectes)
Il y a
multiplication du noyau dans le vitellus sans structure (= syncytium), puis les
noyaux migrent dans le cytoplasme périphérique pour former lassise syncytiale.
Le blastoderme périphérique entoure le vitellus central qui ne subit pas de
segmentation.
®
Périblastule avec un blastocle virtuel
v Segmentation holoblastique des ufs
oligolécithes : luf dOursin :
= Segmentation
totale, égale et radiaire pour les 3 premiers clivages, puis segmentation
inégale.
-
1er clivage :
méridien (= dans laxe PA PV)
® 2
cellules semblables (= blastomères)
-
2ème clivage :
méridien et perpendiculaire au 1er
® 4
blastomères semblables.
-
3ème clivage :
équatorial
® 8
blastomères semblables
(4 dans lhémisphère animal, 4 dans lhémisphère
végétatif)
-
4ème clivage :
16 blastomères
-
Pour lhémisphère animal : 8
mésomères disposés sur une seule couche.
-
Pour lhémisphère végétal :
4 macromères (sous léquateur)
+ 4 micromères (près du pôle végétatif)
-
6ème clivage :
64 blastomères
-
Pour lhémisphère animal :
16 mésomères animaux 1 (près du pôle animal)
+
16 mésomères animaux 2.
-
Pour lhémisphère végétal :
8 macromères végétatif 1
+ 8 macromères végétatif 2
+ 16 micromères.
®
Cloblastule
(les
blastomères entourent le blastocle qui est mis en place depuis le stade 8
cellules)
La blastula
présente une touffe ciliée apicale (pôle animal) ; le reste du germe est
entouré de cils vibratiles.
v Segmentation
holoblastique des ufs hétérolécithes :
Ø Segmentation de luf dAmphibiens :
= Segmentation
totale, égale et radiaire pour les 2 premiers clivages, puis segmentation
inégale.
-
1er clivage :
méridien (= dans laxe PA PV)
® 2
cellules semblables (= blastomères)
Dans 50% des cas, le clivage passe
par le croissant dépigmenté.
Les
blastomères sont de taille identique mais différents sur le plan moléculaire et
développemental (à cause de la présence ou non dune partie du croissant
dépigmenté)
-
2ème clivage :
méridien et perpendiculaire au 1er
® 4
blastomères.
Si le 1er
clivage passe dans le croissant, le 2ème ny passe pas et
inversement.
-
3ème clivage :
latitudinal sus équatorial
(dû à la forte concentration en
vitellus dans lhémisphère végétatif)
® 4 micromères
dans la partie supérieure de lhémisphère animal,
® 4
macromères dans lhémisphère végétatif et une partie de lhémisphère animal.
-
4ème clivage :
16 blastomères = stade morula
-
Clivages suivants :
il y a un fort asynchronisme des clivages.
La
segmentation est plus rapide dans lhémisphère animal que dans lhémisphère
végétatif : les divisions méridiennes commencent dans le pôle animal et se
terminent dans le pôle végétatif. Les divisions suivantes recommencent dans le
pôle animal avant que les précédentes ne soient finies dans le pôle végétatif.
Le vitellus
des macromères inhibe les divisions mitotiques.
®
La blastula = plusieurs couches de cellules
(les plus
grosses au niveau du pôle végétatif et les plus petites au niveau du pôle
animal)
De plus, les
macromères possèdent une paroi plus épaisse que celle des micromères.
-
Au début de la segmentation, les
divisions sont extrêmement rapides car il y a absence des phases G1 et G2 dans
le cycle cellulaire. Ce nest quà partir du 10ème au 12ème
clivage quil y a réintroduction progressive de ces phases.
-
Le passage « clivages
synchrones » à « clivages asynchrones » est caractéristique de
la transition blastuléenne (TB ou Mid Blastula Transition) qui
correspond aux 1ères expressions du génome de lembryon.
Lors
de cette transition, les 1ères transcriptions zygotiques coexistent
avec lARNM
maternel.
Ø Segmentation de luf de Dentale (Mollusque) :
= Segmentation
totale, inégale et spirale (plans de clivage obliques, ce qui donne un
arrangement spiralé des blastomères fils)
-
1er clivage :
presque méridien (légèrement en biais au niveau du pôle animal)
® 2
blastomères appelés respectivement AB et
CD
(CD est plus gros parce quil inclut le lobe
polaire)
-
2ème clivage :
presque méridien
AB ®
2 blastomères A et B
CD ®
2 blastomères C et D
(D est plus gros parce quil inclut le lobe polaire)
-
3ème clivage :
oblique (45° par rapport à laxe PA PV)
® 4
micromères animaux : 1a, 1b, 1c, 1d.
® 4
macromères végétatifs : 1A, 1B,
A ®
1a et 1A
B ®
1b et 1B Faisceau
mitotique oblique
C ®
1c et
D ®
1d et 1D les
cloisons des macromères.
Quand on
observe par le pôle animal, les micromères sont décalés par rapport aux
macromères
-
soit dans le sens des aiguilles
dune montre : spirale dextre,
-
soit dans le sens inverse des
aiguilles dune montre : spirale sénestre.
-
4ème clivage :
inversion des faisceaux mitotiques du 3ème clivage ®
changement du sens de la spirale.
-
Clivages suivants :
disposition alternée des blastomères se maintient : lobliquité des
faisceaux est alternativement à droite et à gauche.
®
Cloblastule
-
Lors des 3ème, 4ème,
5ème et 6ème clivages :
4 quartettes de micromères (et 4 quartettes de macromères) sont produites par
les macromères.
La division et
la distribution des blastomères permettent de définir une nomenclature
conventionnelle des blastomères.
Dans la
segmentation spirale, les blastomères sont disposés de façon à établir une plus
grande surface de contacts par rapport à ce que lon observe dans la
segmentation radiaire.
En général,
les embryons sujets à la segmentation spirale subissent moins de clivages avant
la gastrulation par rapport aux autres modes de segmentation.
v Segmentation
méroblastique des ufs télolécithes : luf de Poule :
= Segmentation
discoïdale qui débute dans la partie haute de loviducte.
Les 3 premiers
clivages sont perpendiculaires à la
surface du cicatricule (= blastodisque) et font une découpe en tranches plus ou
moins régulières.
-
1er clivage :
méridien qui part du centre du cicatricule vers les extrémités.
-
2ème clivage :
méridien, perpendiculaire au 1er plan de clivage
(et perpendiculaire à la surface de lembryon)
-
3ème clivage :
méridien (apparition de 2 sillons latéraux parallèles au 1er plan de
clivage.
-
Clivages suivants :
latitudinaux, très irréguliers, et asynchrones.
On obtient des
blastomères superficiels, individualisés et séparés par une couche (ou assise)
syncytiale. Il y a un contact cytoplasmique entre les blastomères.
-
Jusquau stade 64 cellules,
on se trouve dans le stade morula.
Après, on
arrive dans le stade blastula, caractérisé par lapparition dune cavité entre
les blastomères et le vitellus, remplie dun liquide sécrété par les
blastomères.
Elle est
appelée cavité sous germinale, cavité de segmentation ou blastocle primaire.
-
À la ponte,
on observe une aire pellucide au centre du blastodisque qui correspond aux
blastomères situés au dessus du blastocle I AIRE
ainsi quune aire opaque qui correspond aux blastomères disposés au dessus, et
au contact, du vitellus.
v Segmentation
méroblastique des ufs centrolécithes dInsectes : luf de
Drosophile :
Dans
looplasme (cytoplasme + vitellus), le noyau de la cellule uf subit 8
divisions synchrones rapides. Ces divisions ne sont pas accompagnées dun
partage du cytoplasme par des membranes =
processus dendomitose
®
formation dun syncytium
-
Après 8 divisions,
les noyaux commencent à migrer vers la périphérie de lembryon, le périplasme, et les divisions continuent. Les
noyaux sont alors appelés énergides.
Lorsque le
début de migration seffectue, on atteint le stade blastoderme syncytien.
-
Après environ 6 divisions
supplémentaires, des membranes plasmiques
sinstallent et on arrive au stade blastoderme cellularisé. À ce stade, il
y a la 1ère expression des gènes.
Malgré tout,
une centaine de noyaux restent localisés dans le vitellus (central) Ces noyaux
sont à lorigine des vitellophages.
-
Vers le 9ème
clivage : les noyaux sont arrivés dans la région
postérieure de lembryon. Ils sont à lorigine des cellules polaires qui
représentent les précurseurs des cellules germinales primordiales. Leur
localisation par rapport à lembryon est externe. Lembryon est appelé
périblastule.
v Segmentation
holoblastique de luf alécithes de Mammifères :
Lembryon se
développe lors du trajet dans loviducte et aussi lors de limplantation dans
la muqueuse utérine (= nidation)
2
phases : 1 libre et 1 fixée
La
segmentation intervient lors de la phase libre.
-
1er clivage :
peut être méridien. Les globules polaires sont mobiles sous la membrane pellucide ;
or, le pôle animal est défini par la position de ces globules polaires.
® 2
blastomères de tailles différentes : 1 macromère et 1 micromère.
-
2ème clivage et
après : divisions asynchrones. Le macromère
fait ça division en 1er.
® 3
blastomères. Puis le micromère fait
sa division.
® 4
blastomères : 2 macromères et 2 micromères.
La
segmentation se poursuit lors du trajet de loviducte. Les cellules de
-
Stade 8 16 cellules :
La morula arrive dans la cavité utérine et elle commence à subir les phénomènes
de cavitation (= formation du blastocle) et de compaction (= mise en place de
jonction étanche) qui permet une perméabilité sélective. ®
rôle protecteur
-
Les cellules apolaires occupent
le centre de lembryon et dérivent des macromères.
Les
cellules polaires sont dans la périphérie de lembryon et dérivent des
micromères.
-
Dès la cavitation, lembryon est au
stade 32 64 cellules et devient la blastula (appelé aussi blastocyste)
-
Les blastomères au centre du
blastocyste sont à lorigine du bouton embryonnaire.
Les
blastomères périphériques forment le trophoblaste, la paroi embryonnaire qui
est à lorigine du placenta.
Lembryon est
encore libre dans la cavité utérine.
-
Entre le 6ème et le 13ème
jours de nidation : le blastocyste est face à la
muqueuse utérine. Le trophoblaste se différencie en syncytiotrophoblaste qui
est en contact avec la muqueuse et en cytotrophoblaste qui est en contact avec
le bouton embryonnaire.
-
Le contact avec la muqueuse est
de plus en plus importante pour que lembryon étende ses liens histologiques
avec la circulation sanguine de la mère (liens directs)
Fécondation Segmentation Gastrulation
Organogenèse
![]()
![]()
![]() uf Blastula Gastrula Neurula puis Juvénile
uf Blastula Gastrula Neurula puis Juvénile
Segmentation :
multiplication cellulaire active importante.
Gastrulation :
mouvements morphogènes pour la mise en place des feuillets embryonnaires
(ectoderme, endoderme et mésoderme pour les triploblastiques)
Organogenèse :
différenciation des tissus en des tissus fonctionnels.
v Modalité de la gastrulation :
Ø Invagination ou en embolie :
Exemple :
chez les Échinodermes.
= mouvement
dune partie du blastoderme dans le blastocle.
«
blaste » : tissu qui est à lorigine de
Ø Recouvrement ou épibolie :
Exemple :
chez les Amphibiens.
=
prolifération cellulaire des micromères du pôle animal = recouvrement des
macromères du pôle végétal qui deviennent internes.
Ø Délamination :
Exemple :
chez les Clentérés.
=
prolifération cellulaire avec un plan de clivage parallèle à la surface de
luf.
Cellules
filles Archentéron
(ouverture ultérieure
sur lextérieur)
Ø Immigration :
Exemple :
chez les Vertébrés supérieurs.
Les cellules
du blastoderme migrent et se rejoignent dans le blastocle.


Archentéron
(ouverture ultérieure sur lextérieur)
Ø Prolifération polaire :
Pour les ufs
télolécithes.
=
prolifération cellulaire à lun des pôles de la blastula.
![]() Blastoderme Ectoblaste
Blastoderme Ectoblaste
![]() (= disque germinatif)
(= disque germinatif)
Endoblaste
Pas darchentéron
v Luf
dOursin (Échinoderme) :
Ø Gastrulation :
À la fin de la
segmentation, luf est devenu une blastula.
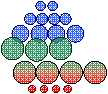

![]()
![]()
![]()
![]()
![]() Mésomères Cellules
animales 1
Mésomères Cellules
animales 1
![]()
![]() Cellules
animales 2
Cellules
animales 2
![]()
![]()
![]()
![]() Macromères Cellules végétatives 1
Macromères Cellules végétatives 1
![]()
![]()
![]()
![]()
![]()
![]() Cellules
végétatives 2
Cellules
végétatives 2
![]() Micromères
Micromères
![]() Cellules végétatives 2
Cellules végétatives 2
La
gastrulation se déroule en 3 étapes :
Il y a :
-
Une diminution des divisions
cellulaires,
-
Lapparition dune touffe
ciliaire apicale au niveau du pôle animal,
-
Un aplatissement et un
épaississement du pôle végétatif formant la plaque végétative,
-
Limmigration des micromères dans
le blastocle formant du mésoblaste (ou mésenchyme primaire)
‚
Il y a :
-
Une embolie des macromères
végétatifs 2
® invagination en doigt de gants formant
larchentéron.
-
Un détachement des cellules à
lextrémité apicale de larchentéron,
®
formation du mésenchyme secondaire qui correspond aux éléments sanguins.
ƒ
Il y a :
-
Formation des vésicules
clomiques = entéroclie à partir de vésicules.
®
mise en place des 3 feuillets = fin de la gastrulation.
Ø Organogenèse :
= formation de
la larve Plutéus.
-
Le germe (= gastrula) saplatit
sur sa face ventrale,
-
La formation de lanus ventral =
blastopore,
-
Il y a une dépression stomodéale
formant le stomodeum (= bouche) par mouvement interne de lectoderme.
-
Les bords latéraux de la bouche
sallongent en formant 4 bras (2 oraux et 2 anaux)
v Luf
de Grenouille (les Anoures) :
Ø Gastrulation :
Rappel :
Luf subit :
-
Une rotation déquilibration qui
détermine le pôle animal (et le pôle végétal)
-
Une rotation de symétrisation par
rapport au croissant qui détermine laxe dorso-ventral.
Après la
segmentation, on obtient :
-
Des micromères au niveau du pôle
animal,
-
Des macromères au niveau du pôle
végétal (riche en vitellus),
-
Et le blastocle est déporté dans
le pôle animal.
§ Aspect morphologique in vivo :
-
Au début de la gastrulation, il y
a une encoche entre le croissant dépigmenté et le pôle végétatif : la
fente blastoporale (ou blastopore) qui est bordée dans sa partie supérieure par
un bourrelet cellulaire (= lèvre dorsale)
-
La fente blastoporale est due par
une embolie (= mouvement vers lintérieur) de quelques blastomères végétatifs,
suivie par une épibolie (mouvement de surface vers le blastopore) des cellules
du croissant puis des micromères de lhémisphère animal.
-
Ensuite, la lèvre blastoporale
effectue un mouvement vers le pôle végétatif et va avoir des formes
successives :
-
Anse de panier,
-
Fer à cheval,
-
Circulaire.
-
Lembolie entraîne la
redistribution des masses cellulaires créant un mouvement de bascule.
-
La fente blastoporale est à
lorigine du future anus.
-
Le croissant dépigmenté et
lhémisphère végétatif disparaissent.
-
Il y a la fermeture du
blastopore.
§ Mise en place des feuillets et étude des mouvements morphogènes :
-
Mouvements internes ?
-
Quelle est la destinée des
régions cellulaires ?
·
Mise en évidence des
territoires présomptifs :
Vogt,
1925 : techniques des marqueurs colorées avec
lutilisation de différents colorants biologiques (rouge neutre, sulfate de bleu du Nil)
=
suivi du déplacement des cellules.
-
Actuellement, on utilise un
marquage dune cellule donnée (micro-injection) par un colorant
fluorescent (fluorochrome =
fluorescéine) Ensuite, on effectue des coupes histologiques pour connaître le
devenir des cellules colorées au cours de la gastrulation.
On
définit la carte des territoires présomptifs : « tel groupe de
cellules de la blastula donne tel feuillet de la gastrula.
-
Il y a une invagination (=
embolie) de la région inférieure : formation du mésoderme et de
lendoderme par recouvrement total de la gastrula par lectoderme.
·
Mouvement de la
gastrulation :
-
À la fin de la
gastrulation : lectoderme est superficiel ; le mésoderme et
lendoderme délimitent larchentéron ; le blastocle est entièrement
envahi par le mésoderme.
-
Ensuite, lorganogenèse débute avec
la neurulation (= réarrangements internes des feuillets mésodermiques et
endodermiques.
Ø La neurulation :
= formation de
laxe nerveux.
§ Observations in vivo (= externes) :
(en surface)
En face
dorsale, il y a :
-
un aplatissement de la gastrula,
formant la plaque neurale délimitée par des replis (=bourrelets neuraux),
-
un rapprochement de ces
bourrelets latéraux,
-
une dépression de la plaque neurale ®
stade gouttière neurale,
-
une soudure des bourrelets (=
internalisation de la gouttière) ®
stade tube neural,
+
un renflement antérieur à lorigine de lencéphale,
-
une absence de soudure aux
extrémités formant :
-
un neuropore antérieur (fermeture
plus tardive)
-
et un neuropore postérieur (=
orifice caudal)
§ Coupes histologiques :
= observation
des arrangements internes des feuillets.
·
Stade gouttière
neurale :
·
Stade tube
neural :
Mésoderme :
-
Ségrégation (subdivision) en
:
-
Mésoderme para axial,
-
Mésoderme intermédiaire,
-
Et lames latérales.
-
Cavitation (= formation de
cavités) :
-
Épiclome (dans le mésoderme para
axial),
-
Mésoclome (dans le mésoderme
intermédiaire),
®
origine du néphrotome.
-
Hypoclome (dans les lames
latérales)
Les lames latérales se rapprochent sans fusionner et
forment le mésentère.
On obtient alors 2 feuillets :
-
Le Splanchnopleure (proche de
lendoderme)
-
Et le Somatopleure (proche de
lectoderme)
-
Métamérisation (succession
de structures) : formation de somites à partir du
mésoderme para axial.
·
Stade bourgeon caudal :
= formation du
Rhombencéphale
-
Fermeture postérieure du tube
neural (il ny a plus de neuropores),
-
Ouverture de lanus.
·
Organisation
métamérique après la neurulation :
-
Métamérisation des crêtes
neurales (à lorigine des ganglions nerveux),
-
Métamérisation du mésoderme para
axial (à lorigine des somites),
-
Métamérisation du mésoderme
latéral (à lorigine du néphrotome)
+
fusion des cavités du mésoderme latéral pour former une seule cavité : le
clome.
Morphogenèse
des Amphibiens ressemble à la morphogenèse des reptiles, des oiseaux et des
mammifères.
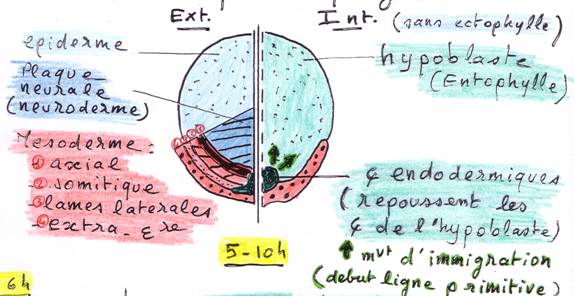
v Luf
de poule (Gallus domesticus) :
Ø Prégastrulation :
À la fin de la
segmentation, on obtient une blastula primaire.
À la fin de la
prégastrulation, on obtient un germe diblastique. Pour cela, il faut 2
migrations :
-
La 1ère migration
forme lentophylle (ou hypoblaste) primaire,
-
La 2ème migration
forme lentophylle (ou hypoblaste) secondaire qui correspond au rempart
germinatif supérieur.
Cette
prégastrulation permet la détermination des parties antérieure (à gauche) et
postérieure (à droite)
Ø Gastrulation :
§ Observations in vivo (= externes) :
-
5
10 H (B) :
Formation dun sillon (= région
épaissie) par des mouvements dépibolie convergeant vers le sillon et
mouvements dembolie.
-
16
H (C) :
Allongement du
blastoderme dans laxe céphalo caudal.
Allongement
du sillon formant la ligne primitive et une région plus compacte, le nud de
Hensen.
-
18
H (D) :
Formation du
prolongement céphalique sous lectophyle
(observable par transparence) à lorigine du
mésoderme cordal.
Allongement maximum de la ligne primitive.
-
20
H (C) :
Apparition dun replis
(ou bourrelet) céphalique extérieur,
Formation
complète dune corde dorsale
(allongement du prolongement céphalique),
Régression de
la ligne primitive
®
positionnement postérieur du nud de Hensen.
La
gastrulation est terminée. En surface, on trouve le matériel ectodermique.
Ø Mouvements morphogènes des territoires présomptifs :
![]()
![]()
![]()


Ø Coupes histologiques :
v Luf
de Drosophile (Insectes) :
Ø Rappel :
Chez lez ufs
centrolécithes, on a :
-
un périblaste (= embryon),
-
un ooblaste
-
et un chorion protecteur.
Ils présentent
une segmentation superficielle pour former une périblastula.
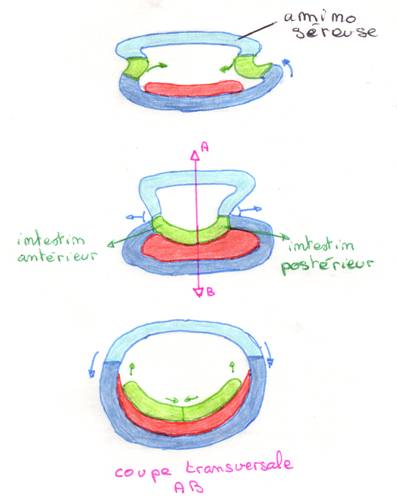
Ø Gastrulation :
§ Les territoires présomptifs :
(vue latérale
superficielle)
§ Début de la gastrulation :
Invagination de lendoblaste postérieure.
‚
Invagination du mésoblaste :
®
Formation du sillon ventral médian + début du recouvrement par
lectoblaste.
ƒ
Mise en place du mésoderme et de lectoderme embryonnaire :
-
Internalisation du mésoblaste par
le recouvrement de lectoblaste.
-
Bourgeonnement et migration des
cellules du mésoblaste
(le recouvrement par lectoderme se poursuit)
ƒ
Mise en place de lendoderme :
-
Invaginations endodermiques
postérieure et antérieure.
v Les
ufs de Primates (Mammifères) :
Ø Prégastrulation :
(lors de
limplantation)
8ème
jour :
-
Apparition de la cavité
amniotique (formation de lépithélium amniotique).
-
Le disque embryonnaire (=
embryon) est didermique :
-
Épiblaste = ectophylle
(contact
avec la cavité amniotique)
-
Hypoblaste = entophylle
(contact
avec le lécithocle primaire)
Du 8ème
au 12ème jour :
-
Apparition de la membrane de
Heuser dont lorigine est le cytotrophoblaste et lentophylle.
-
Prolifération de lentophylle, le
lécithocle primaire devient alors secondaire et sera à lorigine de la
vésicule vitelline.
Ø Gastrulation :
Du 16ème
au 20ème jour (similaire
aux oiseaux)
§ Observations externes :
-
La ligne primitive et le nud de
Hensen sont à la surface de lectophylle.
-
Les cellules de lectophylle
sinvaginent puis sétalent latéralement entre lectophylle et
endophylle ; elles forment ainsi le mésoderme.
Du 18ème
au 19ème jour : Formation de
la plaque cordale :
-
En région antérieure :
fusion du canal cordal avec le toit du lécithocle
(= lentophylle et fissuration longitudinal de
lentophylle)
+
étalement du mésoderme pour former la plaque cordale.
Du 19ème
au 20ème jour : Recul du nud
de Hensen et régression de la ligne primitive :
®
Allongement antéro postérieure de la corde (détachement des cellules du
mésoblaste de la plaque cordale pour former la corde définitive = un tube plein)
Ø Neurulation :
Du 19ème
au 21ème jour : différenciation du mésoderme et formation de la
gouttière neurale.