
Retour au sommaire des cours |

Une version pdf est à votre disposition ici. |
v Méthodes
de détermination :
Ø Méthodes
analytiques :
§ Principe :
-
Si un élément est présent dans un
tissu, cest que la plante en a besoin. (quelques
exceptions)
-
Si un élément est présent en plus
grande quantité quun autre, cest que la plante en plus besoin quun autre.
§ Résultat :
|
9 macro
éléments =
éléments plastiques ou
constitutifs |
CO H N K, P, Ca, Mg, S |
(% de la matière sèche) 40
45 % 40
45 % 6
7 % 1
3 % 0.5
% chacun |
4
éléments ≈
90 95 % 5
éléments inf. à 5 % |
|||
|
≈
60 micro
éléments =
traces ou oligo-éléments ou
éléments dynamiques |
Fe,
Mn, Cu,
Zn, Mo,
Bo, Al,
I, etc. |
|
Inf.
à 0.5 % |
·
Variabilité selon
lespèce :
Na, Cl, Si :
difficiles à placer :
-
Ils ne sont pas constitutifs,
même en grande quantité.
-
Ignorance dun quelconque rôle
dans le dynamisme du végétal.
-
Taux très variable :
Exemple des graminées :
présence importante de Si dans les feuilles
(1% de la masse foliaire)
·
Variabilité
environnementale :
Exemple
du littoral : les plantes se sont habituées à
une salicité importante en séquestrant le sel (NaCl) de manière à ce quil ne
soit pas toxique.
·
Problèmes de cette
méthode :
-
Chacun des éléments listés est-il
réellement indispensable ?
-
Si oui, sous quelle forme alimentaire
doit-il être administré ?
Les plantes peuvent être hyper
accumulatrices de traces (métalliques) ; celles-ci sont donc utilisées
pour dépolluer des sols saturés (exemple du fer)
 Matière fraîche
Matière fraîcheDessiccation
à
Matière sèche Incinération +
10 20 %
Matière minérale
≈ 5 %
Ø Méthodes
synthétiques :
§ Principe :
Réponse à la question :
sous quelle forme alimentaire ?
Cest méthode empirique : on recherche la croissance optimale en changeant la composition du milieu. Elle impose un très grand nombre dessais, avec quelques contraintes :
® lobligation de conditions stériles, pour éviter les interactions néfastes de microorganismes se nourrissant du milieu et excrètent des toxines.
® le contrôle des éléments utilisés : différents niveaux de pureté du milieu et apports de traces avec les flacons et la verrerie.
§ Méthode :
·
Pour les
champignons :
On
effectue des cultures de conidies (spores asexuées) en boîtes de pétri (Pasteur et Raulin)
·
Pour les végétaux
chlorophylliens :
On effectue des cultures de plantes
entières sur milieu solide (Liebig
et Boussingault)
Problème de la composition initiale de
la terre.
®
obligation de calciner la terre pour détruire la matière organique (MO) et
laver la matière minérale (MM)
Apparition de la culture hydroponique (=
aquiculture)
avec Javillier (précurseur de la culture « hors sol »)
= milieu
exclusivement liquide :
-
obligation dasepsie (® graine
légèrement nettoyée à la javel),
-
aération (® éviter
lasphyxie),
-
renouvellement le plus
fréquemment possible.
Contrainte majeure :
composition de la graine ®
présence déléments dans sa réserve
Cette
réserve ne pose pas un gros problème pour les macro éléments mais est très
importante quant à la précision des traces.
Exemple de lIode :
on effectue une étude sur plusieurs générations où lon appauvrie de plus en
plus le milieu ce qui permet de réduire au fur et à mesure la quantité de
liode dans les graines produites.
§ Résultats :
·
Cas des
champignons :
On a défini un milieu de Raulin (= le
plus favorable à la croissance)
Exemple de Aspergillus niger :
|
Aliment |
Quantité |
Elément |
8
macro éléments chez
le champignon : le Mg compense labsence du Ca. |
Eau |
1500 mL |
O,
H |
|
|
Saccharose |
|
C |
|
|
Acide
tartrique Pas très utile en soi : effet bactéricide |
|
/ |
|
|
NH4NO3 |
|
N |
|
|
NH4PO4H2 |
|
P |
|
K2C03Carbonate de potassium |
|
K |
|
|
MgCO3 Carbonate de magnésium |
|
Mg |
|
|
(NH4)2SO4 sulfate dammonium |
|
S |
|
|
|
|
Zn,
Fe et Si |
Principaux
micro éléments |
·
Cas des végétaux
chlorophylliens :
Aliment
|
Quantité |
Eléments |
8
macro éléments + Carbone
produit lors de la photosynthèse |
|
Eau |
1000
mL |
O,
H |
|
|
NH4NO3 |
|
N |
|
|
KPO4H2 |
|
P,
K |
|
|
Ca(NO3)2 |
|
Ca |
|
|
MgSO4 Sulfate de magnésium |
|
Mg,
S |
§ Action dun élément sur la croissance et interaction entre
élément :
Courbe daction de E :
 Croissance
Croissance
E est déficient E
est excès
= carence
Doses
=
toxicité
en E optimales de E
(+ quelques traces) e1 e2 [ E ]
 Carence Sub-carence e1 (agriculture Luxe alimentaire e2 Excès
Carence Sub-carence e1 (agriculture Luxe alimentaire e2 Excès
raisonnée)
Micro-éléments : 108 g.L1 106
g.L1
Macro-éléments : 104 g.L1 102 g.L1
Constatation vis-à-vis
de la situation dexcès : la plante ne
« trie » pas les éléments en fonction de ses besoins mais absorbe
tout ce qui se présente à elle.
·
Symptômes
diagnostics :
= observation de la plante pour constater une situation alimentaire.
-
Carence :
®
Chloroses (= zone défraîchie)
®
Sensibilité aux pathogènes
Exemple
de la betterave sucrière : la carence en
Bohr (Bo) entraîne une fragilisation de la plante qui favorise lenvahissement
du Phoma (champignon)
®
Mise en place de méthodes alternatives de lutte qui permettent déviter les
fongicides.
-
Excès (en particulier
lazote) :
®
Verse
Exemple du blé :
excès de NH4+
(ion ammonium) La plante emploie des mécanismes de désintoxication utilisant du
Carbone pour fabriquer les acides aminés. Celui-ci nest donc plus disponible
pour la solidification en cellulose des parois. De plus, lammoniaque entraîne
une montée rapide en longueur.
·
Interactions :
¨ Facteur
limitant :
=
Elément dont la concentration pénalise le rendement alors que les
concentrations des autres éléments sont optimales.
 Croissance
Croissance
C.max Courbe
daction de référence de A
d C.max (= avec [ B ] non limitant)
C.max
Courbe
daction de A
avec [ B ] limitant (= B déficient)
[ A ]
¨ Interaction
antagoniste :
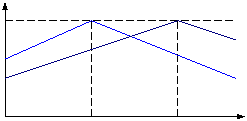
1
Courbe daction du Ca2+
0,6 avec
[ Mg2+ ] =
0,4 Courbe daction du Ca2+
avec
[ Mg2+ ] =
1 2 [
Ca2+ ] en
mM
C.max pour : Ca2+/
Mg2+ =
1/1,5 = 2/3 = constante
Ca2+ et Mg2+ = ions bivalents (= leur sites
dabsorption racinaires identiques)
Si, dans le sol, [ Ca2+
] augmente sans que [ Mg2+
] augmente, on observe une déficience par saturation vis-à-vis du ratio Ca2+/
Mg2+.
On utilise ce genre dinteraction pour
dépolluer une terre saturée en effectuant plusieurs niveaux de culture. Il
suffit de traiter la plante en fin de dépollution pour quelle retrouve un
ratio équilibré.
|
Polluant |
Antagoniste |
||
|
Rubidium |
Rb+ |
Potassium |
K+ |
|
Séléniate |
SeO42 |
Sulfate |
SO42 |
|
Arséniate |
H2As04 |
Phosphorate |
H2PO4 |
|
Chlore |
Cl |
Iode |
I |
¨ Interaction
antagoniste inverse (= synergie) :
Exemple :
|
Fertilisation phosphorée
(2 niveaux) Fertilisation azotée (2
niveaux) |
P 1 (inf.) |
P2 (sup.) |
|
N1 (inf.) |
x |
+ 150 quintaux/ha |
|
N2 (sup.) |
+ 150 quintaux/ha |
+
60 quintaux/ha |
§ Difficulté : établissement dun critère de rendement :
Exemple :
la betterave sucrière :

MF (tonnes. ha1) Sucre (tonnes.
ha1)
10
![]() 100 Racine
100 Racine
5
200 250 300 Azote (kg. ha1)
-
-
Les 50 derniers kg. ha1
sont en surplus, la plante fabrique des feuilles pour piéger lazote dans des
squelettes carbonés (acides aminés) ® Détoxication
Les
cultivateurs sont payés en fonction de la concentration en sucre dans la
betterave :
-
-
Le réservoir est plein à
® La concentration diminue et la récolte devient
moins rentable.
§ Correction avec des engrais :
Souvent
les éléments : Azote, Phosphore, Potassium.
Pour
les autres éléments, on ne se pose des questions quaprès avoir surexploité le
terrain.
 a + b + c = constante
a + b + c = constante
A a2
B
a1
b1
b2
c1 c2
C
N P
|
N
P K |
|
8 8
8 |
|
12 4
8 |
K
N P
6, 9, 9 : dosage optimal
K
Seul
problème : on ne possède aucune explication
avec résultats.
Ø Méthodes
physiologiques :
§ Analyse chimique :
Exemple :
la ferrodoxine :
 e ˉ
e ˉ
(donneur)
Fe2+ Fe3+
(accepteur)
(Red.) (Ox.)
e ˉ
§ Emploi de radioéléments :
=
marquage déléments.
§  Symptôme diagnostic :
Symptôme diagnostic :
N
® « verse » des céréales
N Ca
® Chlorose ® chlorose calcique
Bo
® Phoma
(pour la betterave)
Mg =
métalochlorophyllie (= métal présent au corps de la chlorophylle)
Ca2+ = divalent. Si [Ca2+
] augmente,
[ i 2+
] diminuent ® carence en ces autres divalents.
Ca2+
sert dans le revêtement ionique (rigidité de la membrane)
Un excès de Ca2+entraîne
un déficit de fluidité des membranes.
Ca2+

v Alimentation carbonée
:
Ø Autotrophie
pour le Carbone :
§ Les plantes lithotrophes :
Energie
lumineuse ou chimique
CO2 + H2O + AH2 ®
HCHO +
Oxydant (produit réduit) forme oxydée
 = CMinéral
= pouvoir = COrganique
= CMinéral
= pouvoir = COrganique
-
gazeux, réducteur =
maillon dhydroxyde carbonique
-
dissous
(H2O ou minéraux) (exemple : chaîne de sucre)
(ou recombiné dans leau
comme le carbonate)
Que
des substances minérales
·
Les plantes photo
lithotrophes :
¨
Les végétaux chlorophylliens :
=
algues, bryophytes et plantes vasculaires.
Aérobiose
![]() CO2 + H2O + 2 H2O
® HCHO
+ 2 O2 = + H2O
CO2 + H2O + 2 H2O
® HCHO
+ 2 O2 = + H2O
¨
Les bactéries primitives :
=
Chlorobactériales (bactéries vertes) et Thiobactériales (bactéries pourpres)
Anaérobiose
![]() CO2 + H2O + 2 SH2 ® HCHO
+ 2 S + H2O
CO2 + H2O + 2 SH2 ® HCHO
+ 2 S + H2O
·
Les plantes chimio
lithotrophes :
Pouvoir réducteur quelconque
![]()
![]() CO2
+ H2O
+ (4 H+) ® HCHO +
H2O
CO2
+ H2O
+ (4 H+) ® HCHO +
H2O
Substances
minérales
[ Réd. ] [ Ox. ]
Ressources
énergétiques ( ¹
pouvoir réducteur) :
-
NH4+ : Nitrobactériales,
-
SH2 : Thioleucobactériales
(« leuco » = blanc ®
pas besoin de pigments),
-
FeCO3 : Ferrobactériales,
-
H2 : Hydrogénobactériales.
Ø Hétérotrophie
pour le Carbone :
=
le Carbone est déjà sous forme organique.
® Plante chimio organotrophes.
3
types de comportements alimentaires :
§ Les parasites :
·
Les végétaux
supérieurs :
Exemple
du Gui (Viscum album) :
Il
nest pas hétérotrophe obligatoire (présence dun feuillage vert et persistant)
Printemps
été (pommier en feuille) ®
pompage.
Hivers
®
autotrophie.
·
Les Champignons :
Exemple
dAuricularia judae.
§ Les saprophytes :
=
nutrition de corps morts avec laide de micro-organismes qui soccupent de la
décomposition.
·
Les végétaux
supérieurs :
Exemple
de Limodorum arbortivum (orchidée)
·
Les Champignons :
Exemple
de Pleurotus eryndii.
§ Les symbiotes :
= les Lichens (associations
champignon algue)
Lalgue
fixe et distribue le Carbone.
v Alimentation
Azotée :
Ø Autotrophie
pour lAzote :
Nitrate Ammonium
N2
/ NO3ˉ
/ NH4+
Atm. / en solution
forme réduite
Ø Hétérotrophie
pour lAzote :
On
retrouve les 3 mêmes types de comportement alimentaire que pour le Carbone.
|
AZOTE |
|
CARBONE |
|
Autotrophie |
Pas de corrélation avec |
Hétérotrophie |
|
Hétérotrophie |
Donc forcément : |
Hétérotrophie |
v Principe :
Ø Généralités
et rappels :
150
milliards de tonnes de Carbone fixées par an :
-
135 milliards de tonnes par le
plancton,
-
15 milliards de tonnes par les
végétaux terrestres :
-
11 par les forêts,
-
4 par les prairies.
La
fixation se fait par des pigments assimilateurs.
Ø Les
pigments assimilateurs :
§ Les pigments actifs :
® acte photochimique : Energie
photonique ®
Energie chimique
X l l
= longueur donde du pic dabsorption
·
Chez les végétaux
supérieurs et les algues :
® La chlorophylle a (sur les
chloroplastes)
2
types dont la composition moléculaire est identique : on parle de polymères de la chlorophylle a
ou dholochromes (quand il y a
association avec des protéines) :
P 700
et P 680
·
Chez les
bactéries :
® La chlorophylle a (sur les
chromoplastes, corps un peu granuleux adhérant la membrane)
B860
(bactériochlorophylle pour bactéries pourpres)
et B890
(bactérioviridine pour bactéries vertes)
·
La chlorophylle :

Chlorophylle
a : R
= CH3
4 noyaux pyrroles reliés par des ponts carbonés
= Hème
= Tétrapyrrole fermé
Partie
non protéique
La
molécule schématisée sappelle le Chromophore
et fait partie de
§ Les pigments accessoires :
Energie
photonique ® ® (Pigments
actifs) ® Energie chimique
Rôle de transmetteur
·
Les végétaux
supérieurs :
-
Ca
670,
-
Ca
690,
-
Chlorophylle
b,
-
Caroténoïdes.
·
Les algues :
-
Chlorophylle
b : chlorophycées (= algues vertes),
-
Chlorophylle
c : phéophycées (= algues brunes),
-
Chlorophylle
d : rhodophycées (= algues rouges),
-
Caroténoïde
(
-
Biliprotéines :
-
-
et
·
Les bactéries
pourpres :
-
Caroténoïdes.
·
Les
Caroténoïdes :
Xanthophylle,
b
carotène, etc.
Ils
font partie de la famille des lipides et présente une structure terpénique (= isoprène) :

b
carotène : C40H62
1 vitamine A 1
vitamine A
Provitamine
A
§ 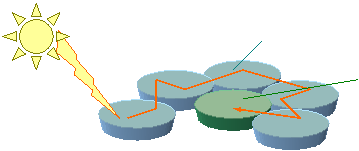 Rôle des pigments accessoires :
Rôle des pigments accessoires :
Pigment accessoire (= antenne
collectrice)
hl
Pigment
actif (= centre réactionnel)
Excitation par vibration
®
transmission de lénergie par vibration
=
résonance de lénergie photonique (hl)
par vibration
Puis
le pigment actif convertit cette énergie en énergie chimique en libérant des
électrons.
§ Spectre dabsorption des pigments :
e = f( l )
 e 410 430 660
e 410 430 660
inf. 560
Longueurs donde éteintes (= absorbées)
(bleu et rouge)
Longueur
donde réfléchie
(vert
jaune)
400 600 l (nm)
Spectre dabsorption de la feuille dépinard
Spectre dabsorption de
Spectre dabsorption de la b Carotène
 650
650
560 Spectre dabsorption de
400 Spectre dabsorption de
Spectre dabsorption de
un pic dans les
UV (400) et un autre dans les IF
La
vie en eaux profondes entraîne le besoin
dune
longueur donde qui parvienne jusque dans
les
fonds marins.
§ Spectre daction de la photosynthèse :
·
Techniques
détablissement des spectres :
Expérience
de T. W. Engelman (1843 1909) sur Bacterium
thermo (algues vertes)
(chimiotactisme positif à lO2)
On
effectue un suivi dune algue verte avec une culture de bactéries. Sil y a une
activité photosynthétique, il y a un dégagement dO2
et donc une prolifération bactérienne.
Lalgue
est éclairée à plusieurs longueurs donde.
® la
photosynthèse est plus importante dans une lumière rouge que dans une lumière
bleue.
Lumière
= énergie photonique (contient des photons)
1 photon ® 1
quantum (énergie électrique, en Joules)
Max
Planck (1858 1947) : établissement de la constante de Planck, h = 6,626 . 1031
Quantum
= q = h.n n (en Hertz) = c / l = 3.1010 / l
q = 6,626 . 1031. 3.1010 / l
= 19,878 . 1021 / l
1
mole de photons « bleus » : Nq470 = 255 kJ
1
mole de photons « rouges » : Nq670 = 179 kJ
Alors que lon sattend à : Nq670
> Nq470
Photosynthèse : 1 photon expulse 1 électron.
Si
on se met à énergie (ou intensité) électrique constante : q670
= q470
,
il
faut plus dénergie
« rouge » que dénergie
« bleue »
Û
plus de photons
« rouges » que de photons
« bleus »
Û
il y aura plus délectrons
expulsés avec la lumière rouge quavec la lumière bleue (à même intensité)
Û
la photosynthèse est plus
importante avec la lumière rouge quavec la lumière bleue.
·
Résultats :
Exemple
dune algue rouge : Delesseria sanguinea.
Présence
de 3 pigments : 1 pigment actif (la chlorophylle a) et 2 pigments
accessoires (la chlorophylle b et la phycoérythrine)

Il
faut travailler à intensité constante.
Spectre
dabsorption des pigments
Spectre
daction de la photosynthèse
400 500 600 700 800 l (en nm)
Ø Le devenir de lénergie absorbée :
Soit
PE0 : un pigment à létat
fondamental, stable, avec une énergie potentielle E0.
Et PE1 : le même pigment à létat excité,
instable, avec une énergie potentielle E1
 hn (E1
supérieure à E0,
soit par surplus dénergie,
hn (E1
supérieure à E0,
soit par surplus dénergie,
PE0 10
-15 sec. soit par une
structure électronique modifiée)
P*E1
PE0 +
hn Þ P*E1
Énergie de restitution
(sous différentes natures)
§ Restitution par fluorescence :
 10
-8 à 10 -12
sec.
10
-8 à 10 -12
sec.
Effet Joules (perte de chaleur w0) P*E1 Þ PE0 + w0
+ hn
+ émission dun photon hn
= hn
Donc : hn
<
hn
Donc : q < q
Donc : l
>
l
Exemple
de la chlorophylle a :
-
Éclairage à 460 nm
-
Fluorescence à 560 nm.
Cette
expérience nest possible in vivo, mais impossible à reproduire in
situ.
§ Restitution par résonnance :

P*E1 Þ PE0 + w0 .
hn PE0 P*E1
PE0
P*E1
P*E1
Chaleur w0
PE0
Et
ainsi de suite
§ Restitution par conversion de lénergie :
= émission dun proton
(caractéristique des végétaux supérieurs)

P*E1 Þ PE0 + w0
+ eˉ
hn
PE0
P*E1
PE0 pigment
métastable
eˉ![]() Pigment =
stable en énergie
Pigment =
stable en énergie
![]() Molécule
métastable Chaleur w0 et
instable en électron.
Molécule
métastable Chaleur w0 et
instable en électron.
réductrice +
(pouvoir réducteur) eˉ
® chaîne de transporteurs délectrons
![]() Synthèse
de glucides :
Synthèse
de glucides :
Test
de Dugol :
Exemple
de Pelargonium sp. (géranium ornemental)

® Récolte le matin ®
(pas de lumière)
® Récolte le midi ®
éthanol,
(12H déclairement)
® Récolte le midi ®
(12H déclairement avec
un cache)
v Mécanisme
de la photosynthèse :
Ø Existence de 2 grands types de réaction :
§ Effet de la température sur la photosynthèse :
Exemple de
Chlorella pyrenoidosa :
Intensité Courbe daction de la température :
 de
la photosynthèse :
de
la photosynthèse :
Lumière forte (température limitante)
® réaction photochimique, dite « claire »
Lumière
faible (hn limitant)
® réaction thermochimique,
12 16 20 24 dite « obscure » ou « sombre »
Température (en °C) (seffectue aussi en phase lumineuse)
À
température constante, cest la lumière qui détermine lintensité de la
photosynthèse.
§ Effet de la lumière intermittente sur la photosynthèse :
Expérience
de la lumière R. Emerson (1932) :
®
éclairage par flash est meilleur que continu.

On conserve les mêmes durée et
intensité des flashs.
VO2 (en mL)
|
Phase
obscure (en sec.) |
Nombre
déclair |
Rendement
par éclair |
|
1/1000 |
5 |
VO2
/5 |
|
1/500 |
3 |
VO2
/3 |
|
1/100 |
2 |
VO2
/2 |
|
1/50 |
1 |
VO2
/1 |
|
1/10 |
1 |
VO2
/1 |
Plus
les éclairs sont espacés, plus le rendement est bon.
Courbe
daction de la phase obscure :
Rendement
de
la photosynthèse
 Durées
optimales
Durées
optimales
100% 25° C
1° C
0 0,1 0,2 0,3 0,4 0,5 Phase obscure (en sec.)
Jusquà
0,2 seconde, la phase obscure est limitant. À 1° C, le métabolisme est au
ralenti et il faut une phase obscure plus longue pour que les réactions
thermochimiques aient le temps de se faire (assimilation du Carbone minéral en
Carbone organique) La lumière ne sert quà exciter les pigments et apporter le
pouvoir réducteur (réactions photochimiques)
Ø Scission de la molécule H2O :
§ Mise en évidence du rôle de H2O :
Rappel sur
les végétaux chlorophylliens (algues, bryophytes, plantes vasculaires) :

CO2 + 2 H2O Þ HCHO +
O2= + H2O
Aérobiose
À
priori : Photo
oxydoréduction.
CO2 HCHO
H2O + + H2O
H2O O2 H2O :
pouvoir réducteur originel.
Expérience
de R. Hill (1937) :
Suspension
de chloroplastes fonctionnels + milieu isotonique.
®
Incubation sous vide (pas de CO2
ni de O2)
![]() + ajout
dhémoglobine oxyhémoglobine (avec un spectre
dabsorption
+ ajout
dhémoglobine oxyhémoglobine (avec un spectre
dabsorption
Fixation dO2 différent
de lhémoglobine)
Observation :
Dégagement
dO2 que
sil y a un broyat cellulaire, en fait quen présence dun oxydant puissant.
Exemple : 2 Fe3+ +
H2O Þ 2 Fe2+ +
½ O2 +
2 H+
« Mais
Si ça marche avec Fe3+,
alors leau rentre dans loxydoréduction pour la formation de lO2 »
« Donc, il y a scission de la molécule de leau ! »
![]()
![]() 2 H2O Þ 2 H+
+ 2 OHˉ Þ H2O +
2 eˉ + ½ O2.
2 H2O Þ 2 H+
+ 2 OHˉ Þ H2O +
2 eˉ + ½ O2.
H2O Þ 2 H+ +
2 eˉ
+ ½ O2
Pouvoir réducteur
= photolyse
(scission dans la photosynthèse)
§ Lémission dO2 provient de la
scission de H2O
Expérience
de Rubens (1941)
®
Utilisation disotopes (= marqueur radioactif)
 H218O et C18O2
H218O et C18O2
Chlorelles.
18O2 16O2
CO2 +
2 H2O Þ HCHO
+ O2
+ H2O
Analogies
avec la photosynthèse bactérienne :
CO2 +
2 SH2 Þ HCHO
+ 2S + H2O
-
Chlorobactériales (=
bactéries vertes)
® B890
= Bactérioviridine.
-
Thiobactériales
(= bactéries pourpres)
® B860 =
Bactériochlorophylle ; Bactériopupurine.
-
Thiorhodobactériales :
exemple de Chromatium warmingii qui garde le souffre, ce qui leur donne leur
coloration rouge.
-
Athiorhodobactériales :
exemple de Rhodopseudomonas sp. qui, en aérobiose, est hétérotrophe et, en
anaérobiose, est photo-organotrophe.
CO2 + 2 CH3CHOHCH3 Þ HCHO +
2 CH3COCH + H2O
Pouvoir
réducteur
§ Scission de H2O et transfert de
pouvoir réducteur :
Le
photosystème II (P680) :

Antenne
collectrice
=
pigments accessoires (Ca670,
Chlorophylle b, Caroténoïdes)
2 photons
Centre réactionnel
E0 = 0,82 V = pigment actif.
H2O Þ ½ O2 P680 E0 = 0,90 V
+ 2 H+
+ 2
eˉ
Pouvoir réducteur
P+680 P*680 E1
E0
Donneur deˉ = réducteur
Accepteur deˉ = oxydant
E0 Red < E0
Ox 2 eˉ
® Chaîne
de transporteurs
|
|
PS
II |
Centre
réactionnel P680 |
E0
= + 0,90 V |
par apport dénergie Transfe Spontané
|
|
Transport de H+ et eˉ |
Plastoquinone
PQ |
|
E0
= 0 V |
|
|
Transport que deˉ |
Cytochrome
F |
|
E0
= + 0,34 V |
|
|
Plastocyanine Pc |
|
E0
= + 0,37 V |
||
|
PS
I |
Centre
réactionnel P700 Ratio Chl. b/Chl a > Ratio du PS II |
E0
= + 0,43 V |
||
|
Ferredoxine Fd |
|
E0
= 0,43 V |
||
|
Transport de H+ et eˉ |
FAD
/ FADH
2 |
|
E0
= 0,38 V |
|
|
NADP
+ / NADPH, H
+ |
Nicotinamide |
E0
= + 0,38 V |
·
Structure du chloroplaste :
Diamètre :
3 à 10 µm Thylakoïde
= membrane

Lumen du thylakoïde thylakoïde
intergranaire
(pH acide) stroma
= compartiment thylakoïde
granaire
intrathylakoïdal granum
enveloppe
ADN circulaire
Chloroplastique accumulation transitoire damidon
Globule lipidique plastidiaux
(10
à 15 nm) ® caroténoïdes dissous
·
Schéma général de la
chaîne des transporteurs :

Stroma intra chloroplasmique NADPH +
H+
2 photons 2
photons
( l = 680 nm) ( l = 700 nm)
Fd NADP+
PQ PQH2
2 e ˉ
P680 P700
FAD
2
e ˉ Cyt f
FADH2
Pc
PS II PS I
Stroma intra vésiculaire
(protons
prélevés à lextérieur et libérés à lintérieur) ® gradient de
protons
Ø Fixation et devenir du carbone minéral (cycle de Calvin) :
§ Méthode détude :
Melvin
Calvin (1911 1997) : montage « Lollipop »
Carbone
radioactif : 14CO2 ®
Radio chromatographie.
 CO2 Agitateur
CO2 Agitateur
O2 Pompe Capillaire en
serpentin
où
lon peut injecter du
CO2
radioactif à des moments
précis
découlement.
Extraction et radiographie des sucres
solubles dans de léthanol à 100° C
§ Résultats :
=
radio chromatogrammes des produits formés (rayonnement b du
-
Nature des molécules ?
-
Ordre de parution ?
-
Quantité de marquage ?
5 sec. 10 sec. 30 sec.
![]()


 malate
malate
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() alanine glutamate
alanine glutamate
![]()
![]() 80% glycine
sérine aspartate
80% glycine
sérine aspartate
![]()
![]()
![]() saccharose APG
saccharose APG
![]()
![]()
![]()
![]()
![]()
![]() trioseP oseP
trioseP oseP
![]() ose
diP
ose
diP
UDPG
Acide
3_phosphoglycérique Sucre
(APG) Acides aminés
CH2OPCHOHCOOH
Acides organiques
§ Fixation du CO2 :
Calvin
et Benson (1944 1959) :
Rubisco
(= ribulose 1,5 biphosphate carboxylase oxygénase)
RUBP +
CO2 +
H2O Þ
2 APG (acide_3_phosphoglycérique)
C5 C1 2
C3 On
parle de photosynthèse « C3 »
CH2OP CH2OP + CH2OP
| | |
C=O CHOH CHOH
| | |
CHOH COOH COOH
|
CHOH
|
CH2OP
La rudisco : rôle de carboxylase (lors de la
photosynthèse)
et rôle doxygénase (lors de la
photo-respiration)
-
Elle est activée par le Magnésium
Mg2+,
-
Et est constituée de 16
sous-unités (masse totale : 550 kDa)
-
Elle constitue 50 % des protéines
foliaires et 70% des protéines du chloroplaste.
Arguments
expérimentaux :
![]()
![]()
![]() Lumière
Obscurité
Lumière
Obscurité

![]() C.P.M Glucides
C.P.M Glucides
 (coups par
minute) APG
(coups par
minute) APG
![]()
RUBP
![]()
+ 14CO2
(1%) = 30
40 Temps (en minutes)
![]()
![]()
![]() Lumière Obscurité
Lumière Obscurité
![]() C.P.M + CO2 (1%) CO2 (sous
vide)
C.P.M + CO2 (1%) CO2 (sous
vide)
![]() (coups par
minute)
(coups par
minute)
![]()
![]()
![]() R.U.B.P
R.U.B.P
![]()
![]() A.P.G
A.P.G
![]()
200 100 0
10O Tps (en sec.)
-
Labsence de CO2
entraîne une incapacité à réduire le R.U.B.P qui va donc saccumuler.
Ce
qui veut dire quil continue à être synthétisé. Doù vient-il ?
-
La lumière, lAPG et toutes ses
transformations permettent de régénérer le RUBP. La photosynthèse commence avec
la synthèse du glucide RUBP (=précurseur) et cherche à le régénérer.
-
La photosynthèse
« C4 » :
Chez
les graminées tropicales (maïs, canne à sucre, etc.)
PEP Case (= phospho-énol pyruvate carboxylase)
PEP +
CO2 + H2O Þ OAA +
2 H+ + 2 eˉ
Phospho-énol pyruvate Acide oxaloacétique
-
La photosynthèse
« CAM » (= Crassuleam Acid Metabolism) :
Chez
les plantes dites grasses ou succulentes (agave, etc.)
§ Réduction et devenir de lAPG :
·
Étape 1 :
Triose_P
déshydrogénase
![]() 2 APG + 2 (NADPH + H+) Þ 2 Ald PG + 2 H2O + 2 NADP+
2 APG + 2 (NADPH + H+) Þ 2 Ald PG + 2 H2O + 2 NADP+
ATP ADP + Pi (réaction non spontanée)
CH2OP CH2OP
| 2 H+ | glycéraldéhyde_3_P
CHOH + + CHOH = aldéhyde
phosphoglycérique
| 2 eˉ |
COOH CHO
Tout
sera multiplié par 2 pour une mole de CO2
fixé.
Il faut donc 4 eˉ
pour réduire une molécule de CO2
fixé.
·
Étape 1 :
Ald PG Þ DHAP (déshydroxyacétone_P)
CH2OP CH2OP
| |
![]() CHOH C=O
CHOH C=O
| |
CHO CH2OH
·
Étape 2 :
Aldolase
Ald PG + DHAP Þ Fructose 1,6 bi_P
C3 C3 C6
CH2OP CH2OP CH2OP
| | |
CHOH + C=O C=O
| | |
 CHO CH2OH CHOH
CHO CH2OH CHOH
|
CHOH
|
CHOH
|
CH2OP
·
Étape 3 :
Fructose biphosphatase
Fructose 1,6 bi_P + H2O Þ Fructose 6_P
+ Pi
§ Rôle central du Fructose 6_P :

![]() Fructose 6_P
Fructose 6_P
![]() Glucose 6_P
Glucose 6_P
![]()
![]() Condensation
Condensation
Régénération Saccharose bi_P
Isomérisation
![]() du
RUBP Glucose 1_P
du
RUBP Glucose 1_P
![]()
Saccharose + PPi Polymérisation
![]()
![]() n Glucose 1_P
n Glucose 1_P
Réserves
pour
les plantes saccharifères
Amidon + n Pi
(stockage temporaire durant
la phase photosynthétique, puis stockage dans les organes spécifiques durant la
nuit)
§ Régénération du RUBP :
·
Étape 1 :
Trans-cétolase
Fructose 6_P + Ald PG Þ Xylose 5_P + Érythrose 4_P
![]() C6 C3 C5 C4
C6 C3 C5 C4
CHO
Isomérisation |
Ribulose 5_P CHOH
|
CHOH
|
CH2OP
·
Étape 2 :
Aldolase
Érythrose
4_P + DHAP Þ Sedoheptulose
1,7 bi_P
C3 C3 C7
CH2OP CH2OP CH2OP
| | |
CHOH C=O C=O
| | |
CHOH CH2OH CHOH
 | |
| |
CHO CHO
|
CHOH
|
CHOH
|
CH2OP
·
Étape 3 :
Trans-cétolase
Sedoheptulose 1,7 bi_P
+ Ald PG Þ Xylose 5_P + Ribose 5_P
![]()
![]() C7 C3 C5
C5
C7 C3 C5
C5
Isomérisation 2 Ribulose
5_P
CH2OP CH2OP CH2OP CHO
| | | |
C=O CHOH CHOH CHOH
![]() | | | |
| | | |
CHOH CHO CHO CHOH
| | |
CHO C=O CHOH
| | |
CHOH CH2OH CH2OP
|
CHOH
|
CH2OP
·
Étape 4 :
![]() 2
Ribulose 5_P Þ RUBP
2
Ribulose 5_P Þ RUBP
ATP ADP + Pi (réaction non spontanée)
§ BILAN en Carbone du cycle de Calvin :
![]()
![]()
![]() H2O Ald PG
H2O Ald PG
![]() CO2 2 APG
CO2 2 APG
![]()
![]() RUBP Ald PG DHA_P Fructose 1,6 bi_P
RUBP Ald PG DHA_P Fructose 1,6 bi_P
![]()
![]()
![]()
![]()
![]()
![]() H2O Ald PG Érythrose
4_P + Xylose 5_P
H2O Ald PG Érythrose
4_P + Xylose 5_P
![]() CO2 2 APG RUBP
CO2 2 APG RUBP
![]()
![]() RUBP Ald PG Sedoheptulose
1,7 bi_P
RUBP Ald PG Sedoheptulose
1,7 bi_P
![]()
![]()
![]()
![]() H2O Ald PG DHA_P Ribose 5_P +
Xylose 5_P
H2O Ald PG DHA_P Ribose 5_P +
Xylose 5_P
![]() CO2 2 APG
CO2 2 APG
![]() RUBP Ald PG DHA_P
RUBP Ald PG DHA_P
D Tout est à multiplier par 2 pour une mole de CO2 fixé.
§ Influence de hn sur les réactions thermochimiques :
Expérience
de Calvin et Benson (1948) sur Scenedesmus sp. cultivée à
lobscurité sans CO2.
C.P.M C.P.M
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Sans CO2 + CO2
Sans CO2 + CO2 ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Sans CO2 Sans CO2 + CO2
Sans CO2 Sans CO2 + CO2
![]()
![]()
0 50 Min.
10 0 50 Min.
Conclusions :
La
fixation du CO2
est possible à lobscurité dès lors que les cellules chlorophylliennes
contiennent de lATP et du pouvoir réducteur produits dans les réactions
photochimiques.
Ø Réactions entre les réactions photo- et thermochimiques :
§ Exigence quantique :
®
combien dénergie q faut-il pour
fixer une mole de CO2 ?

 On
a vu quil fallait 4 eˉ
pour fixer 1 molécule de CO2.
La photosynthèse fonctionne sur le principe quun photon permet lexpulsion
dun électron :
On
a vu quil fallait 4 eˉ
pour fixer 1 molécule de CO2.
La photosynthèse fonctionne sur le principe quun photon permet lexpulsion
dun électron :
4 q 4
q
![]()
![]()
![]()

 4
eˉ 4 eˉ
4
eˉ 4 eˉ
![]()
![]()
PS
II PS I
Il
faut 8 q pour fixer une molécule de CO2
et donc 8 Nq pour fixer une mole de CO2.
Calcul théorique :
6 CO2 + 6 H2O Þ C6H12O6 + 6 O2
DG0 = + 680 kCal
680/6
= 113 kCal pour une mole de CO2
fixée.
Nq470 = 255 kJ = 61 kCal
113/61 » 2 Nq
Nq670 = 179 kJ = 43 kCal
113/43 = 2,65 » 3 Nq
Or,
on fonctionne sur lhypothèse de 8 Nq.
Il y a donc une perte énergétique de 5 à 6 Nq.
Mesure
expérimentale :
Énergie fixée sous forme chimique
![]() Ratio
=
Ratio
=
Énergie photonique absorbée
(rapporté
à une masse de végétal et pour une durée donnée)
-
Pour des algues vertes :
8 à 10 Nq par mole de CO2.
Rendement = 8 x 100 /10 = 80
%
® 80% de
lénergie fixée sert à la transformation du CO2
en sucre.
-
Pour les végétaux supérieurs :
12 à 20
Nq
par mole de CO2.
Rendement = 8 x 100 /20 = 40
%
® 40% de
lénergie fixée sert à la transformation du CO2
en sucre.
la perte par effet Joule
nexplique pas tout
Mais où va
la fuite ?
§ Les photo phosphorylations :
![]()
![]()
![]() EN Besoin dun apport
EN Besoin dun apport
![]()
![]() 0,43 Fd dénergie
0,43 Fd dénergie
![]() 0,07 Cyt b 6
0,07 Cyt b 6
![]() 0 PQ
0 PQ
![]() + 0,34 Cyt
f
+ 0,34 Cyt
f
![]() + 0,37 PC
+ 0,37 PC
![]() + 0,43 PS I
+ 0,43 PS I
(en Volt) Les eˉ vont des
réductions vers les oxydants.
En
présence de lumière, la concentration en ATP augmente et ce même en
anaérobiose.
Ces
réactions ce passent donc, non pas dans les mitochondries, mais dans les
chloroplastes.
Il
ny a pas de production dO2.
·
Phosphorylations
cycliques :
(1954)
![]()
![]() ADP + Pi ATP
ADP + Pi ATP
![]()
![]()
![]() 0,43 Fd
0,43 Fd
![]()
![]() 0,07 Cyt
b 6
0,07 Cyt
b 6
![]()
![]()
![]()
![]()
![]() 0 PQ
0 PQ
![]()
![]()
![]() + 0,34 Cyt
f ADP + Pi Grand
saut énergétique
+ 0,34 Cyt
f ADP + Pi Grand
saut énergétique
![]()
![]() + 0,37 PC ATP
+ 0,37 PC ATP
![]()
![]() + 0,43 PS I
+ 0,43 PS I
700 nm
(en
Volt)
Quand
le saut est grand, lénergie produite est récupérée.
Mais
quand saut est trop petit, lénergie est perdue.
·
Phosphorylations acycliques :
=
chaîne de transporteur de pouvoir réducteur
(parfois,
il y a production dO2)
![]()
![]()
![]()
![]() 0,43 Fd
0,43 Fd
![]()
![]() 0,38 FAD
0,38 FAD
![]() 0,3
0,3![]() 2 ADP + Pi NADP+
2 ADP + Pi NADP+

![]()
![]() 0 PQ ATP
0 PQ ATP
![]()
![]() + 0,34 Cyt
f
+ 0,34 Cyt
f
![]()
![]() + 0,37 PC
+ 0,37 PC
![]()
![]() + 0,43 PS I
+ 0,43 PS I
700 nm
![]()
![]() + 0,82 H2O
+ 0,82 H2O
![]()
![]() + 0,9 PS II
+ 0,9 PS II
(en
Volt) 680 nm
Dun
point de vue évolutif,
§ Théorie chimio osmotique de Michell :
Peter D. Michell (1920 1992)
![]()
![]() ATPase ADP + Pi ATP
ATPase ADP + Pi ATP
 ATP ADP + Pi
ATP ADP + Pi
ATPsynthétase
CF 1
Espace intra chloroplastique
Membrane
imperméable
aux protons Chaîne de transporteurs CF 0
« pompe à
protons »
Thylacoïde
Espace intra vésiculaire
![]() CF 1 : synthèse dATP
Nature protéique
CF 1 : synthèse dATP
Nature protéique
CF 0 : canal membranaire
Les
chloroplastes produisent de lATP surtout pour son usage personnel. LATP pour
lorganisme est produit par les mitochondries.
·
Arguments
expérimentaux :
-
Sur une suspension de
chloroplastes :
![]() [H+]
[H+]
![]()

![]()
![]()
Ionophore (découpe la membrane, la rendant perméable)
![]()
0 20 40
-
pH = 4 :
Thylakoïde
isolé et à lobscurité :
Simple
diffusion
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
 H+ PH = 7
H+ PH = 7
Quelques
heures après :
PH
= 4
Équilibre
de [H+]
-
![]() pH
= 8 :
pH
= 8 :
![]()
![]()
![]() Ajout dADP +
Pi ATP
Ajout dADP +
Pi ATP

![]()
PH = 4![]()
![]()
v BILAN :
-
Photo lithotrophes : ®
Photosynthèse
-
Présence de pigments actifs et
accessoires
Complémentarité
entre laspect structural et le spectre daction de la photosynthèse.
-
Énergie absorbée par les pigments
restituée :
-
Par résonnance,
-
Par fluorescence,
-
Par conversion de cette énergie
(émission dun électron)
-
Photosynthèse :
-
Réactions photo
chimiques :
-
Scission de lH2O,
-
Production et transfert du
pouvoir réducteur,
-
Production et transfert de lATP.
-
Réactions thermo
chimiques :
-
Fixation CO2
®
utilisation du RUBP (besoin de pouvoir
réducteur et dATP)
-
Régénération du RUBP
-
Bilan énergétique :
-
Perte (déperdition w0),
-
Formation dATP.
-
Équation générale de la
photosynthèse :
On
ne sintéresse quà la lumière comme énergie ®
phototrophes
![]()
H2O + CO2 + 2 AH2 Þ HCHO +
Photo lithotrophe : 2 H2O 2
O2
2 SH2 2
S
Photo organotrophe : Mat. Org. (Red) Mat.
Org. (Ox)
(Thiobactéries)
v Lazote
du sol :
Ø Lazote
organique :
Origine :
cadavres, déjections, débris végétations
Humifications
(= dégradations)
Humus = Oligosaccharides
(provenant de polysaccharides)
Oligopeptides
(provenant de protéines)
Acides
aminés (= monomères) et amides,
Urée
Complexe
lignine azote
(= composant pariétal des
végétaux dur à décomposer)
Ø Lazote minéral :
Origine :
cadavre et humus
![]()
 Putréfaction Ammonification
Putréfaction Ammonification
et décomposition
(bcp + rapide)
NH4+
(pas ce que
préfèrent les végétaux)
NH4+
: toxicité rapide au niveau des structures cellulaires (déplacement des
charges)
+ antagonisme de certains
cations (K, Ca, Mg) ®
carences apparentes.

Plante
![]() NH4+
NH4+
![]() H+ équilibre
H+ équilibre
Forte
acidification du sol (= de la rhizosphère = environnement direct des racines)
Avantages :
la charge + permet
la fixation sur des éléments du sol (surtout à des éléments de charges négatives :
les coloïdes) cest intéressant à petite dose.
![]() NH4+ NO3ˉ (ion
nitrite : le nitrate) = forme finale de la minéralisation.
NH4+ NO3ˉ (ion
nitrite : le nitrate) = forme finale de la minéralisation.
Nitrification possibilité de le stocker (surtout dans les vacuoles)
+
aucun antagonisme
(au contraire : absorption
conjointe avec dautres ions comme NO3ˉ;K+)

Plante
![]() NH4+
NH4+
![]() OHˉ équilibre
OHˉ équilibre
Alcalinisation
du sol
®
favorable pour la rhizosphère car le sol est toujours un peu acide
à cause du C2O
® H2CO
Défaut :
NO3ˉ ne
tient pas longtemps dans le sol : répulsion des charges négatives et donc
la fixation est peu possible. Le NO3ˉ est
lessivé et va dans les nappes phréatiques et les cours deau.
Chez
les cultivateurs : apport des 2 formes
dazote : nitrate dammonium
(= ammonitrate) NO3ˉ; NH4+
Nitrification :
-
Production dazote nitrique par
nitrobactériales
Exemple :
Nitrosomonas (bactéries nitreuses) ®
fixation du CO2
avec lénergie chimique par oxydation (étapes de nitrification)
-
Nitrosation : NH4+ + 3/2 O2 ® NO2ˉ + 2 H+ + H2O
∆G° = 84 Kcal Pouvoir
réducteur
Réaction exergonique pour
la photosynthèse
(libération dénergie)
-
Nitratation :
NO2ˉ + ½ O2 ® NO3ˉ
Ex : Nitrobacter
(bactéries nitriques) ∆G° = 19 Kcal
Ø Cas particulier des plantes carnivores :
Surtout
insectivores, sauf les plantes exotiques (des monstres) qui peuvent choper une
grenouille)
Exemple de
Drosera sp. :
Elle
possède des feuilles spéciales qui assimilent directement (= exodigestion)
fixation des mouches par des gouttelettes « papier tue mouches »
avec des enzymes hydrolytiques.
Exemple de
Dionaea sp. :
Elle
utilise un système de piège à loup.
Exemple de
Nepenthes sp. :
Elle
possède un système de piège en forme doutre
v Utilisation
de lazote atmosphérique :
Ø Organismes fixateurs de lazote :
Fixation
du N2 ®
organismes = diazotropes
2 types
dorganismes : libres ou en association symbiotique.
§ Les micro organismes libres du sol :
-
Bactéries hétérotrophes pour le
Carbone : Azotobacter
chrorococcum (en aérobiose)
Clostridium pasteuriamum (en
anaérobiose)
Elles
utilisent un système trop parfait qui fait donc quelles fixent plus de N2
quelles nen ont besoin. Elles transforment la quantité qui leur est
nécessaire et libèrent le surplus dans le sol.
®
Organismes fertiligènes.
-
Cyanobactéries autotrophes pour
le Carbone : Nostoc
punctiforme
Anaboena cylindrica
Elles
utilisent le même système que les bactéries hétérotrophes. ®
Organismes fertiligènes.
Ce
système offre la possibilité dune installation dans des zones
chaotiques : ce sont des organismes pionniers (ils préparent le terrain
pour dautres espèces)
§ Les symbioses :
-
Les lichens à cyanobactéries du type
Collema sp. :
Les
cyanobactéries sont des « esclaves » car cest elles font tout.
-
Une plante supérieure et des
bactéries :
Exemple
des légumineuses (pois, soja, trèfle, luzerne, etc.) :
Les
légumineuses sont incapables de fixer le N2.
Les
bactéries (Rhizobium ou Bradyrhizobium) ne fixent pas le N2
à létat libre, que quand elles sont en association symbiotique en formant
des nodosités (= petit groupement de bactéries) :
-
Rhizobium ®
sur la racine de la plante,
-
Bradyrhizobium ®
sur la tige de la plante.
Exemple
de laulne :
Il
sagit dune association non obligatoire, elle est surtout utile pour coloniser
un sol pauvre.
![]()

![]()
![]() Sénescence
Litière
Sénescence
Litière
N2
 Humification
Humification
 Ammonification
Ammonification
Nitrification
Assimilation
du NH4+
® protéines Enrichissement
progressif
du
sol en NO3ˉ.
Fixation
Ø Symbiose Rhizobium Légumineuse :
§ Découverte :
Expérience
de Hellriegel et Wilfarth (1886) avec Pisum sativum (petit
pois)
|
Culture sur sable |
Culture sur terre |
Résultat |
|
Calciné |
Normale |
Carence
en azote ®
jaunissement |
|
Calciné |
Brute |
Croissance
et formation
de nodosité |
|
Calciné |
Lessivée
(suppression de la matière minérale) |
Croissance
et formation
de nodosité |
|
Calciné |
Lessivée
et calcinée (=
stérilisation) |
Carence
en azote ®
jaunissement |
Appellation
Beijerinck (1888) : Rhizobium leguminosarum
Mais
toutes les bactéries ne forment pas des nodosités avec toutes les légumineuses.
®
recherche de la spécificité symbiotique.
![]() Rhizobium
leguminosarum ® fève, pois, etc Protéagineux
Rhizobium
leguminosarum ® fève, pois, etc Protéagineux
Rhizobium
japonicum ® soja
![]() Rhizobium
meliloti ® luzerne Fourrages
Rhizobium
meliloti ® luzerne Fourrages
Rhizobium
trifolii ® trèfle
§ Formation de nodosités :
·
![]() Modalité signalétique dinfection :
Modalité signalétique dinfection :
 Cellules de racine
Cellules de racine
Communication
 Rhizobium sensible chimique
Rhizobium sensible chimique
![]()
![]()
![]()
 aux flavonoïdes ƒ Activation des
aux flavonoïdes ƒ Activation des
de cette plante - Flavonoïdes gènes noduline
![]()
![]() - Biotine (facteur de ® Nodulation
- Biotine (facteur de ® Nodulation
 ‚ Activation développement bactérien) Récepteur spécifique
‚ Activation développement bactérien) Récepteur spécifique
des gènes Nod - Bétaïne
 ®
®![]() Production de lipo
oligosaccharides
Production de lipo
oligosaccharides
spécifiques du rhizobium = Facteur Nod
Les
flavonoïdes sont des métabolites accessoires qui existent sous beaucoup de
types différents. Chaque légumineuse envoie les siens : la bactérie va
donc voir si la plante lui correspond ou non ®
spectre symbiotique.
·
![]() Nodulation :
Nodulation :
Elle
se fait au niveau de la zone pilifère, avec les poils absorbants. Le rhizobium
y prolifère et la plante y répond par 2 modifications :
-
Enroulement du poil sur lui-même
(= poil en crosse)
-
Sécrétion dune enzyme
hydrolytique, la pectinohydrolyse, qui détruit partiellement les cellules du
poil permettant lentrée du rhizobium et la prolifération par un cordon
infectieux fermé par la membrane de séquestration.
Celle-ci
confère au rhizobium une chromoprotéine, la legHémoglobine. Cette protéine est
dite « mixte » parce que lhème est produit par la plante et la
bactérie apporte la partie protéique. La legHémoglobine est un piège à oxygène,
toxique pour la bactérie.
LegHémoglobine ® OxylegHémoglobine
Fixation
de lO2
La
legHémoglobine est une chromoprotéine : les nodosités efficientes,
fixatrices de N2,
ont une couleur rosée alors que les nodosités non efficientes, trop jeunes ou
trop vielles, ont une couleur blanche.
·
![]() Modalité de la fixation du N2 :
Modalité de la fixation du N2 :
∆G° = 84 Kcal (réaction endergonique)
N2 +
6 H+ + 6 eˉ ®
2NH3
ammonium
![]() Pouvoir réducteur azote minéral réduit NH3
+ H2O ® NH4+ +
HOˉ
Pouvoir réducteur azote minéral réduit NH3
+ H2O ® NH4+ +
HOˉ
Enzyme : Nitrogénase (NT)
ammoniac ammoniaque
¨ Lorigine
du pouvoir réducteur :
Expérience
sur Clostridium pasteuranium (fixateur de N2
à létat libre et en anaérobiose) :
Vitesse dincorporation du 15N2
(isotope stable)
![]() ( 106
atome.h1)
( 106
atome.h1)

![]()
![]() 20 60
min
20 60
min
+ Pi
35 min
25 min
15 min
10
min
2,5 5 min Pas de Pi (phosphate)
![]()
![]()
![]() 2
2
![]()
Pyruvate
500 1000 consommé
(µmol)
Interprétation :
3 (PO4H2ˉ, H+) +
3 (CH3COCOOˉ, H+) ® 3 CO2 + 6 H+
+ 6 eˉ + 3 (CH3CO~P)
Pyruvate acétyl_phosphate
Lorigine
du pyruvate (ou acide pyruvique) est la glycolyse à partir du glucose
synthétisé.
La
fixation du N2
est en fonction du métabolisme du carbone.
¨ Condition
de la fixation du N2 :
(en
anaérobiose)
Extrait de Clostridium pasteuranium
+ Fe, Mo, Mg
+ Protéine de 220 kDa (nitrogénase)
+ ATP (2 ATP par eˉ
transporté)
+ Ferrédoxine
![]()
 20 Avec ATP
20 Avec ATP
 Sans ATP
Sans ATP
Avec
Fd :
10
Sans
Fd :
![]()
![]() Avec ATP Sans ATP
Avec ATP Sans ATP
![]()
5 10 15 20 Temps (en minutes)
¨ La
nitrogénase :
= 2 sous unités métalloprotéiques
Protéine
II
![]()
![]() =
ferro protéine ATP Mg
=
ferro protéine ATP Mg
(= dimère 2x27 kDa)
54 kDa


![]()
![]()
![]()
![]()
![]()
![]()
![]() S S
Mo
S S
Mo
S S
(Fe4
S4)
(Fe4 S4)
![]() S S
S S
![]() S S
Mo
S S
Mo
![]()
Protéine I = ferro molybdo - protéine
220 kDa
(=
tétramère 4x55 kDa)
¨ Schéma
général de la fixation par réduction du N2 :

![]()
![]()
![]()
![]()

![]()


N N H
||| +
2 H+ + 2 eˉ || +
2 H+ + 2 eˉ
![]()
![]()
![]()
![]()
![]()
![]() N
N
H
N
N
H
Métal
de transition Di imine

![]()

 H H H
H H H
![]() | |
| |
N
H N
H
+ 2 H+ + 2 eˉ |
![]()

![]() N
H N
H
N
H N
H
![]() | |
| |
H H ![]() H
H
Ammoniac Hydrazyne

![]()
![]()
![]()
![]()

¨ Bilan :
-
La ferrédoxine cède 6 électrons
en 3 étapes (3 x 2 eˉ)
-
Il faut 2 ATP pour le transfert
des électrons de la protéine I à la protéine II.
-
Donc le coût énergétique pour une
molécule de N2 fixée
est de 12 ATP.
Équation
théorique : N2 +
6 H+ + 6 eˉ + 12 ATP ® 2NH3
+ 12 (ADP + Pi)
6 x 2 (ATP Mg)
![]() 12 ATP (pour assembler les 2 sous
unités)
12 ATP (pour assembler les 2 sous
unités)
![]()
![]()
![]()
![]()
![]()
![]() Pyruvate FdOx Fe2+ Mo6+
Pyruvate FdOx Fe2+ Mo6+
![]()
![]() + Pi
2 NH
+ Pi
2 NH
![]()
![]()
![]() 6 eˉ
NT
6 eˉ
6 eˉ
NT
6 eˉ
Acétyl~P + 6 H+ N2
 + 3 CO2 FdRed Fe3+ Mo5+
+ 3 CO2 FdRed Fe3+ Mo5+
+ 6 H+ 12 (ADP + Pi)
On
peut trouver dautres éléments à la place du pyruvate et des éléments dans la
chaîne de transporteurs.
-
Il y a production de H2
par les nodosités et par la même protéine,
Équation
secondaire : 2 H+ + 2 eˉ + 4 ATP ®
H2 + 4 (ADP + Pi)
Doù
une équation globale :
N2 + 8 H+
+ 8 eˉ + 16
ATP ® 2NH3 + H2 + 16 (ADP + Pi)
®
Gaspillage ? NON,
Recyclage !
§ Gestion de lO2 par organismes fixateurs :
-
Stratégie de lévitement pour les
organismes anaérobies.
-
Adaptation physiologie pour les
organismes aérobies :
-
Hydrogénase (cycle dit futile),
-
Augmentation de lactivité
respiratoire (Azotobacter)
O2
dissous (µmol)

Sans
Pi
![]()
![]()
= 10 20 30 40 50
Choc O2 40%
-
Adaptation cytologique :
-
Par spécialisation cellulaire :
Exemple :
Anabaena cylindrica (algues filamenteuse)
![]()
Hétérocystes Cellules chlorophylliennes
(fixation du N2) (photosynthèse)
-
Par compartimentation intra
cellulaire :
LegHb
+ O2 ® OxylegHb (= filtre à O2)
§ Application de la fixation N2 :
-
Fertilisation biologique des
sols :
-
Bactéries libres : 5 à 40
kgN2.ha1.an1
Turned
over (= mort de lorganisme sinon fixation pour son usage personnel)
-
Symbioses : 10 à 20% dazote
fixé qui est restitué.
![]() En
pratique : Soit une
association : Ray Grass / Trèfle 60 à
150 kgN2.ha1.an1
En
pratique : Soit une
association : Ray Grass / Trèfle 60 à
150 kgN2.ha1.an1
Fétuque
/ Trèfle
Soit une rotation : Céréales
Févéroles
Betteraves Luzerne
-
Enrobage (semences
techniques) :
(Hollande) Inoculum = culture
« dense » de Rhizobium
Objectif : 2L pour
-
Génétique de la fixation de
lazote :
(sciences
fiction) Enzyme NT ® gènes
NIF (découvert par Dixonet Postgate en 1974)
Hydrogénase ® gènes
HUP
Possibilité
dintégrer ces gènes dans E. coli. Maintenant, il faut intégrer ces gènes
procaryotiques dans un génome eucaryotique en faisant en sorte que ces gènes
soient constitutifs.
§ Effet de lazote du sol sur la fixation du N2 :
Quand
il y a une symbiose, il y a une régulation de la fixation en fonction de la
présence dans le sol.
![]() Activité de
Activité de


 2 (µmol.gMF1.h
1)
2 (µmol.gMF1.h
1)
2 jours
1
4 jours
7 jours
![]()
0 2 4 6 NH4
/ NO3 (en
mM) dans le sol

![]()
![]() Développement des nodosités (chez
le pois)
Développement des nodosités (chez
le pois)
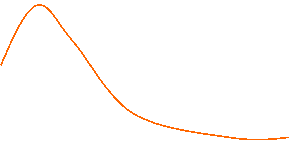 Masse dun
Masse dun
nodosité Nombre de nodules
par
plante
![]()
0,3 3 30 NO3
(en mM) dans le sol
§ Conclusion :
 Cellule
hôte
Cellule
hôte
 Photosynthèse Symbiosome
Photosynthèse Symbiosome
Squelettes LegHbO2
![]()
![]()
 carbonés
carbonés
Glycolyse LegHb
+
![]() Krebs
Krebs
ATP
H+ ; eˉ

![]() NH4
NH4
Acides aminés NT
![]()
![]()
![]() N2 N2
N2 N2
Protéosynthèse
Protéosynthèse
v Utilisation
de lazote nitrique :
Ø Mise en évidence de la réduction du NO3ˉ :
![]() Ion nitrique
(NO3ˉ)
Ion nitrique
(NO3ˉ)

![]() NO3ˉ Minéral
NO3ˉ Minéral
![]() 15NO3ˉ NH4
15NO3ˉ NH4
RNHR amines
I
RCONH amides Organique
Nprotéines
Nbases azotées
Temps
Expérience
dEckers en 1924 :
? ? ?
![]()
![]()
![]()
![]() eˉ eˉ eˉ eˉ
eˉ eˉ eˉ eˉ
![]()
![]()
![]()
![]() NO3ˉ NO2ˉ N2O2 NH2OH NH4OH
NO3ˉ NO2ˉ N2O2 NH2OH NH4OH
![]()
![]()
Nitrate réductase Nitrite
réductase
Ø Mécanisme de la réduction du nitrate :
§ 1ère étape avec
1953 :
Evans et Nason sur le soja,
1985 : enzyme cytotonique.
NO3ˉ + 2H + 2 eˉ ® NO2ˉ + H2O
Origine
du pouvoir réducteur est en fonction de la localisation de la nitrate
réductase :
-
Dans les cellules non
chlorophylliennes : NADH + H+
(respiration)
-
Dans les cellules
chlorophylliennes : NADPH + H+
(photosynthèse)
® le
métabolisme de lazote est lié au métabolisme du carbone.
Nitrate
réductase : (double
chaîne polypeptidique)



![]()
![]() FAD b 557 Co Mo NO3ˉ
FAD b 557 Co Mo NO3ˉ
NADPH, H+



![]()
FAD b 557 Co Mo NO2ˉ
![]()
![]()
![]()
![]()
![]()
![]()
![]() NADPH, H+ FAD 2 Fe2+ Mo5+
NADPH, H+ FAD 2 Fe2+ Mo5+
![]()

![]()
![]() 2 eˉ 2 eˉ
2 eˉ 2 eˉ
![]() NADPH, H+ FADH2 2 Fe3+ Mo3+
NADPH, H+ FADH2 2 Fe3+ Mo3+
0,32 V 0,06V
NO3ˉ ®
NO2ˉ +
H2O
+
0,42V
® Réaction spontanée (= réaction exergonique)
∆G° = 34,5 Kcal

Paradoxe :
Réaction exergonique
![]()
![]() A B
A B
Réaction exergonique
§ 2ème étape : Réduction de lazote
nitrique avec
Expérience
de Hageman (1962) sur les chloroplastes
6 FdOx
![]()
![]()
![]()
![]()
![]() PS
I Fe 4S 4 2
eˉ
PS
I Fe 4S 4 2
eˉ

6
FdRed
0,43 V Encore une relation entre
![]() Photosynthèse : SH+ les métabolismes de lazote
Photosynthèse : SH+ les métabolismes de lazote
et du carbone.
NO 2ˉ ®
NH 4+
+ 2 H2O
+ 1,14 V
® transfert spontané (∆G° = 95 Kcal)
Expérience
de Hageman (1962) sur les proplastes de
champignons et de racines.
3 NAD(P)H + H+ 3 FlaP
![]()
![]()
![]()
![]()
![]() Fe 4S 4 6
eˉ
Fe 4S 4 6
eˉ

3 NAD(P)+ 3 FlaPH2
Flavoprotéine
![]() 6 H+
6 H+
![]() Respiration : 2 H+
Respiration : 2 H+
NO
2ˉ ®
NH 4+
+ 2 H2O
Ø Origine du pouvoir réducteur :
§ Relation avec la respiration :
Chlorella
sp. Volume de dégagement de
CO2
![]() Quotient respiratoire : QR =
Quotient respiratoire : QR =
Volume
de dégagement de O2
dissous
-
Obscurité et absence de NO3ˉ : QR » 1 (constant)
-
Obscurité et apport de NO3ˉ : QR > 1
Interprétation :
![]()
![]()
![]() NADH + H+
+ O2 NADH + H+ +
O2
NADH + H+
+ O2 NADH + H+ +
O2
![]()
![]() Sans NO3ˉ Avec NO3ˉ
Sans NO3ˉ Avec NO3ˉ
NAD+ + H2O NH 4+ + NAD+
Lors
de la respiration (obscurité), il y a compétition du NO3ˉ et de
lO2 pour
le pouvoir réducteur.
§ Relation avec la photosynthèse :
Chlorella
sp. Volume
de dégagement de O2
![]() Quotient photosynthétique : QR
=
Quotient photosynthétique : QR
=
Volume
de dégagement de CO2
dissous
-
Lumière et absence dazote : QR » 1 (constant)
-
Lumière et apport de NH4+ : QR » 1
-
Lumière et apport de NH4+ : QR > 1
Interprétation :
![]()
![]()
![]() NADH
+ H+ + CO2 NADH + H+ + CO2
NADH
+ H+ + CO2 NADH + H+ + CO2
![]()
![]() Sans NO3ˉ Avec NO3ˉ
Sans NO3ˉ Avec NO3ˉ
NAD+ + sucres NH 4+ + NAD+
Lors
de la photosynthèse (lumière), il y a compétition du NO3ˉ et de
le CO2 pour
le pouvoir réducteur.
v Assimilation
de lammonium :
∆ problème daccumulation
à cause du déséquilibre quil entraîne chez les autres cations.
|
Environnement |
|
Plante |
|||
|
N
2
NO2ˉ |
Symbiose
(Nitrogénase) Absorption
dans le sol Absorption
+ NR + NiR |
|
-
Acides aminés
(Glutamines,
Asparagine)
=
molécules mobiles et solubles
® forme
majoritaire pour le
transport de lazote (via le
phloème)
-
Amides (Glutamates, Aspartames)
® : 3 stratégies :
-
La voie de la
glutamine,
-
Lamination
réductrice,
-
La transamination.
Ø Assimilation de NH par transamination :
§ Mécanisme général :
R R R R
| | | |
C = O + CHNH2 ® CHNH2 + C = O
| | | |
COOH COOH COOH COOH
A. organique 1 A. aminé
2 A. animé 1 A. organique 2
§ Synthèse de laspartate :
Aspartate transaminase
Oxaloacétate +
glutamate ®
Aspartate +
a cétoglutarate
COOH COOH
| |
C = O CHNH2
| |
CH2 (CH2)2
| |
COOH COOH
Aspartate
synthase
Aspartate + NH3 ® Aspartagine +
H2O
COOH (ou NH4OH) COOH (ou 2 H2O)
| |
CHNH2 CHNH2
| |
CH2 CH2
| |
COOH CONH2
v Conclusions :
Ø Régulation de lassimilation de lazote :
Expérience
sur la lentille deau ayant subit une carence en azote pendant 24 à
48H :
Activité
de
![]()
 Témoin
Témoin
NO3ˉ
![]()
![]()
![]() + Cytoheximide (inhibiteur de
+ Cytoheximide (inhibiteur de
La
nitrate réductase est induite par son substrat. Il sagit dun enzyme coûteuse
en énergie : elle nest secrétée quen présence de nitrate (Turn over très
court : quelques heures)
§ Assimilation du NO3+ dans les cellules foliaires :
Paroi (pas de sélectivité de transport)

![]()
![]() Membrane plasmique Chloroplaste
Membrane plasmique Chloroplaste
GOGAT
![]()
![]() Gln
Gln
2 Glu
![]()
![]() GS Glu Transamination
GS Glu Transamination
![]()
![]() NH4+ A.A
NH4+ A.A
![]() NiR
NiR
![]() ATP Protéines
ATP Protéines
![]() Transporteur (pas
toxique) NO2ˉ (toxique)
Transporteur (pas
toxique) NO2ˉ (toxique)


![]()
![]()
![]() NO3ˉ T NO3ˉ NR
NO3ˉ T NO3ˉ NR
![]()
![]() Anion Anion Vacuole
Anion Anion Vacuole
ADP + Pi
Stockage
Sans
compartimentation
Ø Cycle de lazote dans la biosphère :
§ Dénitrification :
=
Retour de lazote sous forme nitrite gazeux N2
dans latmosphère.
Chez
les bactéries hétérotrophes pour le carbone (et aussi autotrophes pour le
carbone)
Nitrococcus
denitrificans
Pseudomonas
denitrificans
Protéines N2

![]()
![]()
![]()
![]() Acides aminés
Acides aminés

![]()
![]() Acides
Acides
![]()
![]() Cétoniques NH4+
Cétoniques NH4+
 Énergie
Énergie
![]()
![]()
![]() NADH + H+
N2O
NADH + H+
N2O
Catabolisme
![]() énergétique
NO2ˉ
énergétique
NO2ˉ
![]()
![]() Substrats
NO3ˉ
Substrats
NO3ˉ
Organiques Dénitrification
![]()
Nitrate
Surtout
dans les régions plus tropicales quand le sol est asphixique (à cause des inondations)
et dans les intersaisons.
§ ![]()
 Cycle de
lazote :
Cycle de
lazote :
N2



![]() Déjections
Déjections
![]()

![]()
Protéines animales

![]() Putréfaction Fixation
Putréfaction Fixation
![]() Protéines végétales biologique
Protéines végétales biologique
![]()
![]() Humification Dénitrification
Humification Dénitrification

![]()
![]() Humus Acide aminé
Humus Acide aminé
Ammonification
Amination


![]() NH4+ NH4+
NH4+ NH4+
Absorption

![]()
![]() NO3ˉ
NO3ˉ
![]() Lessivage Absorption
et réduction
Lessivage Absorption
et réduction
Dans la plante.
Dans le sol.
![]()
![]() Nitrate " Nitrite NO3ˉ Nitrite " Nitrate
Nitrate " Nitrite NO3ˉ Nitrite " Nitrate
NR Nitrification
D°G < 0 D°G < 0
Pourquoi ? puisque
cest une réduction Normal,
car cest une oxydation
NO2ˉ
Nitrite " Ammonium Ammonium " Nitrite
NiR Nitrosation
(chez les végétaux
supérieurs) (chez
les bactéries nitreuses)
![]()
![]()
![]()
![]() Photosynthèse " 8 H+ + 6eˉ NO3ˉ 2H+ + H2O
Photosynthèse " 8 H+ + 6eˉ NO3ˉ 2H+ + H2O
D°G = 95kCal D°G = 84 kCal
Pourquoi ? puisque cest une réduction Normal, car cest une oxydation
2
H2O NH4
”
O2
Autotrophie pour
le Carbone " Stockage de lénergie sous forme de
molécules.
Autotrophie
pour lAzote " Utilisation dun peu dénergie
v Modalités :
Ø Définition
:
![]() Le
développement est constitué de :
Le
développement est constitué de :
![]()
![]() Croissance : Augmentation
irréversible de la taille (masse sèche)
Croissance : Augmentation
irréversible de la taille (masse sèche)
"
Phénomène quantitatif
![]()
![]()
![]() Différenciation : Augmentation
irréversible de la taille (masse sèche)
Différenciation : Augmentation
irréversible de la taille (masse sèche)
"
Phénomène qualitatif
Ø  Croissance
des différents organes :
Croissance
des différents organes :
§ Croissance racinaire :
Pas de croissance
observée
24 heures
Zone spécialisée
Traits
équidistants pour
la croissance
Apex
Pas
de croissance

![]() Cylindre
central
Cylindre
central
Zone de différenciation cellulaire
= Zone dhistogenèse

Élongation cellulaire
= Zone dauxésis
Quand la paroi est
définitivement installée,
il ny a plus
de croissance.
Faible
ratio noyau /cytoplasme
![]() Zone dentretien de la coiffe
Zone dentretien de la coiffe
![]()
![]()
![]() Coiffe
Multiplication cellulaire
Coiffe
Multiplication cellulaire
=
Zone de mérésis
Centre quiescent
Important
ratio noyau /cytoplasme
·
Croissance
en diamètre :
Elle est effectuée par le méristème
secondaire (= cambium) qui nexiste que chez les dicotylédones.
·
Ramification
(racines latérales) :
![]()
![]()
 Épiderme Xylème (sève brute, ascendante)
Épiderme Xylème (sève brute, ascendante)
![]()
![]() Parenchyme
cortical Phloème (sève élaborée, descendante)
Parenchyme
cortical Phloème (sève élaborée, descendante)
![]()
![]() Endoderme Cylindre central
Endoderme Cylindre central
![]()
![]()
Péricycle Parenchyme médullaire
Les
cellules du péricycle sont des cellules différenciées qui subissent une
différenciation et deviennent des cellules totipotentes (qui refont une
nouvelle racine)
§ Croissance de la tige
(feuillée) :
Méristème dattente

![]() Ébauche
de feuille
Ébauche
de feuille
![]() Régénération des cellules utilisées
pour les ébauches foliaires
Régénération des cellules utilisées
pour les ébauches foliaires
![]() Méristème
médullaire
Méristème
médullaire

![]() Méristème dattente
Méristème dattente
Lanneau
initial est à lorigine
![]() de
la prochaine ébauche foliaire
de
la prochaine ébauche foliaire
Anneau initiale
Ø Régulation
hormonale de la croissance :
On
ne sintéresse quaux facteurs endogènes :
-
Composés oligotrophiques (en trop
petite quantité pour dire quils ont un rôle nourricier "
inintéressant)
-
Phytohormones (¹
Hormones animales)
" Hormonologie
Structures très variées dans une même
famille.
Dans une même famille "
plusieurs fonctions.
Selon léquilibre hormonal, il y a des conséquences totalement différentes
" Endocrinologie
1 hormone
" 1 structure
" 1 fonction
On
a établi 4 critères pour quune molécule soit une hormone végétale :
-
Spécification dans le cycle de
synthèse,
-
Molécule active à très faible
concentration,
-
Site daction différent du site
de synthèse (valeur de signal),
-
Nature universelle de lhormone
(même structure dans différentes espèces)
v Les auxines :
Il
a fallu 50 ans pour les découvrir et faire accepter leur existence.
Travaux
sur le coléoptile davoine :
 Coléoptile
(= gaine de protection de la première faille)
Coléoptile
(= gaine de protection de la première faille)
![]() Racines
séminales (3 pour les monocotylédones)
Racines
séminales (3 pour les monocotylédones)
![]()
![]()
![]()
![]() Faisceau
intense sur lapex
Faisceau
intense sur lapex
![]()
Obscurité
Il
excite forcément 2 sites (au moins) :
-
Un de perception,
-
Un de réaction.
"
Transmission dun signal
Ø Auxines
et grandissement cellulaire :
§ Découverte de lAIA
(principales étapes) :
Expérience
sur le coléoptile découvert :
 j
j
![]()
Apex
juste reposé
"
Plus de croissance Reprise de la croissance
Þ Lapex contrôle la croissance du coléoptile.
Mais le contrôle est de quelle nature ?
|
Plaque de platine |
Permet un signal électrique |
û |
|
Couche lipidique |
Permet un signal chimique
lipidique |
û |
|
Couche de mica |
Empêche tout type de signal |
û |
|
Bloc de gélose |
Permet un signal chimique
hydrophile |
ü |
![]() k
k
l
![]() "
Reprise de la croissance
"
Reprise de la croissance
Þ La
gélose mime lapex car elle contient des molécules hydrophiles.
![]()
![]()
![]()
 m
m
 Coléoptile de
monocotylédone Tige de dicotylédone décapitée
Coléoptile de
monocotylédone Tige de dicotylédone décapitée
LAIA
(acide indole_3_acétique) est lauxine naturelle la plue répandue.
Elle
peut être libre ou fixée à dautres radicaux.
Il
existe dautres auxines moins naturelles et dérivées de lAIA, mais elles
présentent un rendement plus faible. On y trouve :
-
Les auxinomimétiques (de
synthèse),
-
Les régulateurs de croissance,
-
Les désherbants.
LAIA
est une molécule thermolabile et photosensible : elle est dégradée sous
les effets de la chaleur et de la lumière.
Les
auxinomimétiques sont non sensibles à la chaleur et à la lumière.
Dans
le cas dune lumière anisotrope (inégale) :
-
Lauxine est détruite là où il y
a de la lumière,
-
Et elle est produite là où il ny
a pas de lumière
" Les cellules à lombre sallongent et il y a
une courbure vers la lumière.
§ Dosages :
·
Dosage
biologique de lAIA = test de Went (ou test avoine) :
 Les
lieux de synthèse de lAIA sont très spécifiques : lapex foliaire et les
organes reproducteurs.
Les
lieux de synthèse de lAIA sont très spécifiques : lapex foliaire et les
organes reproducteurs.
a
![]()
 20
20
"
Croissance asymétrique
10
![]() AIA
(107 g.mol1)
AIA
(107 g.mol1)
1 2 3
·
Dosage
par analyse physicochimique :
j Chromatographie dextraits naturels : Test de Salkowski (1885) qui donne la
concentration à 105
g.mol1 près (méthode moins précise mais plus pratique)
k Couplage chromatographie et spectrométrie de
masse :
sensibilité importante (détection dune quantité de 5 à 10 ng)
l Méthodes immunologiques : Test élisa : sensibilité énorme
(détection dune quantité de 0,1 ng)
§ Transport :
Le
transport de lAIA est polarisé (ou vectoriel) : de lapex vers la base.

Segment sousapical
" Reprise de la croissance
Þ Il y a bien un transport de lAIA.

" Pas de reprise de la croissance
Le
mécanisme du transport polarisé de lAIA se fait dans les cellules du liber.

![]() Paroi neutre
électriquement
Paroi neutre
électriquement
"
Elle peut franchir le
plasmalemme
Plasmalemme
Cytosol
![]() Transporteur
+ ATPase
Transporteur
+ ATPase
(au
pôle basal)
§ Métabolisme de lAIA :
·
Synthèse
de lAIA :
Il
existe 2 voies de synthèse.

Le
précurseur de lAIA est le Tryptophane :
Ou
« I » pour le noyau imidazole :



Acide cétonique
![]()
 Transamination Décarboxylation
Transamination Décarboxylation
Acide aminé
CO2
I CH2 CO COOH I
CH2 CH2 NH2
Acide
indol_pyruvique Tryptophane


![]() H2O
H2O
Décarboxylation Désamination oxydative
CO2 NH3 + H+
I
CH2 CHO
![]()
![]()
![]() Indol_acétaldéhyde
Indol_acétaldéhyde
Voie principale Voie privilégiée
dans lapex de coléoptile
![]() H2O + NAD+
H2O + NAD+
Oxydation
NADH + H+
I
CH2 COOH
AIA
·
Catabolisme
de lAIA :
De
trop grandes quantité dauxines causent une prolifération cellulaire
désorganisée. Il existe donc des enzymes de décarboxylation oxydative :
les auxines oxydatives.
Il existe dautres possibilités de
réactions cataboliques, comme la régulation par la fixation de lAIA . Tant que celle ci est conjuguée,
elle nest plus fonctionnelle.
I
CH2 COOH
AIA
 O2
O2
CO2 + H2O
Oxy_indole_3_méthylène
Indole_3_aldéhyde
§ Mode daction de lAIA :
Lélongation
concerne les cellules jeunes, où il ny a encore que la paroi IAIRE
de développée.
Schéma
de la paroi IAIRE :
![]()
 Myofibrille
Myofibrille
![]() = Trame
= Trame
![]()
![]() Pectine
(pouvoir gélifiant)
Pectine
(pouvoir gélifiant)
Hémicellulose
(plus petite et ramifiée) Matrice
+
Extensine (15%)
(
surtout des liaisons hydrogène et ionique
" liaisons labiles)
·
Les
polymères pariétaux :
j La cellulose : b
(14)glucane
Les
liaisons b
(14) entraînent une forme en hélice et apporte une grande solidité à la
cellulose (indigeste)
Les
liaisons a
(14) entraînent une forme plane et concerne lamidon.
k Les hémicelluloses : (très grande famille)
Il
sagit dhétéropolymères (= combinaison de différents polymères)
l Les pectines : a
(14)galacturonanes
On
observe une fonction carboxylique libre. Les pectines sont présentes dans la
paroi IAIRE.
COOˉ L H+ COOˉ L H+ COOˉ L H+

Les
cations bivalents jouent le rôle dune pince à linge pour relier 2 pectines.
m Lextensine : glycoprotéines à hydroxyproline
MM = 86 kDa " 300 acides aminés ⅔ doses et ⅓
dacides aminés
·
Les
effets de lAIA :
j Augmentation de la plasticité de la
paroi :
Expérience
de Heyn (1991) puis Tagawa et Bonne (1957) :

20
minutes
On
retire de poids
5
minutes
a

at
+
AIA ae
at ap >>> ap
ae ap
Témoin ap
0 20
25 (minutes)
k Stimulation de lextension pariétale :
![]() Milieu physiologique Segment
dhypocotyle de soja
Milieu physiologique Segment
dhypocotyle de soja
(pH = 7
±
AIA)
D
longueur (µm)

1500
pH pH + AIA
7 5
Témoin (toujours
un peu dAIA dans la plante)
0
0 20 90 (minutes)
Cytosol

AIA
Pompe à proton inactive
ATP
H+
Pompe à proton active
ADP + Pi
Lacidification
de la paroi entraîne une perte de cohésion et donc une plus grande plasticité.
« On
fait de la place en écartant les livres pour pouvoir en ranger dautres »
l Stimulation du métabolisme :
Expérience sur lépicotyle de pois +
AIA :
 Unités
relatives
Unités
relatives
15
Cellulose
10 (petit
effet retard)
ARNM celluloase
5
1
0 12 24 48 (heures)
LAIA
induit la transcription et la traduction.
"
Effet à court et moyen terme.
|
Résumé |
|
|
Au
niveau pariétal (quelques
minutes) |
Au
niveau moléculaire (quelques
heures) |
|
Extrusion
de H+ $ Perte
de cohésion Trame
/ Matrice
|
Activation
de la transcription $ Activation
de la traduction
Synthèse
denzymes (remaniement
des polymères pariétaux) |
![]()
Extension de la paroi
= croissance par élongation cellulaire
§ Liaisons auxines
récepteurs :
Il
existe 2 types de récepteurs.
Très
mal connus
"
Comparaison des points communs des structures des phytohormones de type
auxines.

·
Auxines
de synthèse :
:
AIA
-
 Acide
a_naphtalène
acétique
Acide
a_naphtalène
acétique
= ANA
-
 Acide
a_naphtalène
oxyacétique
Acide
a_naphtalène
oxyacétique
-
 Acide
2,4_dichlorophénoxyacétique
Acide
2,4_dichlorophénoxyacétique
= 2,4D
Cest la plus puissante.
Elle est utilisée, en grande quantité,
comme désherbant puissant par multiplication.
En
plus, elle est biodégradable.
-
 Acide
2,4,5_trichlorophénoacétique
Acide
2,4,5_trichlorophénoacétique
= 2, 4, 5T
-
Acide 2_méthyl_4_chlorophénoacétique
 =
MCPA
=
MCPA
·
Points
communs :
j La chaîne latérale doit être courte :
AIA : ICH2COOH
AIP : ICH2 CH2COOH moins
efficace
AIB : I CH2 CH2 CH2COOH beaucoup
moins efficace
ICH2 CH2 CH2 CH2COOH plus
dactivité
k Présence dun protons H libre en position
« ortho » :

 2, 4D 2, 6 D
2, 4D 2, 6 D
Pas
dactivité
l le noyau doit présenter des doubles liaisons
(= liaisons éthyléniques) :
d+
Acide
benzoïque Acide
cyclohexanoïque


Pas
de mouvements des charges
Théorie
de Kenneth Thimann (1904 1997) :
 AIA 2,
4 D
AIA 2,
4 D


 Þ
Þ
Récepteur à 2 points dancrages à
une distance précise
Ø Auxines
et multiplication cellulaire :
Les
effet des auxines sont dosesdépendants.
-
Grandissement cellulaire = Auxésis
Pour de faibles concentration : [ AIA ] = 107
à 1011 g.mL1
-
Multiplication cellulaire :
[
AIA ] = 102 à 106
g.mL1
-
Organogenèse :
[ AIA ] = 107
à 106 g.mL1
§ Mise en évidence :
·
Prolifération
cellulaire non contrôlée, anarchique :
Soit
des fragments végétaux dans un milieu gélosé ou aqueux + [ AIA ] = 102 g.mL1
![]()
4 semaines
Obtention
de « cal » (= amas de cellules ressemblant à une tumeur)
Sil
lon ajoute de lAIA, la prolifération continue ; sinon, il y a un arrêt de la croissance.
·
Prolifération
cellulaire organisée :

Phloème
Cambium
( 3 couches de cellules )
![]()
Xylème + [ AIA ] = 106 g.mL1
8
assises (= couches) cellulaires
Þ Action cambiostimulante de lAIA.
§ Cas de crown gall :
Gall
= multiplication cellulaire en désordre,
due à une piqûre dinsecte.
¹
Crown
gall = multiplication cellulaire en
désordre, due à une bactérie
(Agrobacterium
temufaciens)
Le
crown gall est une tumeur naturelle (qui se manifeste sur un tissu jeune) On
parle aussi de tumeur IAIRE
qui correspond au point de départ de linfection.
Les bactéries sont en multiplication et
causent un excès dauxines.


![]() renferme les
bactéries
renferme les
bactéries
![]()
![]()
Lorsque la tige grandit : Tumeurs
secondaires
Elles ne contiennent pas lagent
infectieux.
Les
cellules se multiplient même sans apport dAIA. Þ Habituation hormonale
Les
cellules des tumeurs IAIRES
ont acquis la capacité de synthétiser lAIA alors quelle « tait réservée
à lapex.
" Il y a eu un transfert dinformations
génétiques de la bactérie à la plante.


 ADN bactérien Plasmide Ti (Tumeror inducing)
ADN bactérien Plasmide Ti (Tumeror inducing)
responsable de la tumeur

Gène
de réplication
Gène de virulence
TL
TR
ADN de transfert Séquences de bordure (TL et TR)
(ADNT)
Production dopine (= facteur de
croissance de la bactérie) et denzymes végétales
et
gènes ONC responsables de lontogenèse
·
Production
de plante transgène (OGM) :
j Fabrication dun vecteur de transfert :
"
Utilisation denzymes de restriction pour retirer les gènes responsables de la
tumeur et insérer le gène dintérêt.
1 P P 1
![]()
Sélection
végétale Gène dintérêt
k Transformation bactérienne :

GSB
Gène de sélection bactérienne
TL TR
1 1
GSV Gène dintérêt
P P
l Sélection :
On
effectue une culture avec un antibiotique spécifique.
" Seules les bactéries modifiées survivent, les
autres meurent.


m Transformation de plantes par Agrobacterium
GM :
Plante
mère Disques foliaires scarifiés
Incubation en présence de Agrobacterium GM
" "
Milieu
de sélection des cellules Antibiotique
pour détruire
transformées (GSV) les
bactéries restantes

"
n Quelques applications (gènes dintérêt) :
-
Résistance aux
insectes (maïs, coton, pomme de terre, colza),
-
Résistance aux
herbicides,
-
Résistance aux
virus (tabac, laitue, colza, pomme de terre),
-
Réduction des
introns azotes (optimisation de lazote donné),
-
Amélioration des qualités
nutritives :
Huile plus riches en acides gras
essentiels avec modification que de la graine,
Composition
de lamidon de pomme de terre,
-
Résistance aux
stress abiotiques (froid, sécheresse, sols salés, etc.),
-
Production de médicaments
(protéines humaines, hémoglobine, etc.)
"
Il y a un avantage sur les bactéries GM (en plus de la biomasse) : la
présence de gène effecteur de gènes (activateur)
o Quelques problèmes :
-
Résistance aux
antibiotiques (dont la canabicine) quil vaut mieux ne pas diffuser,
-
Les partielles expérimentales
nécessitent un périmètre de sécurité avec interdiction de faire pousser des
hybrides pouvant sautocroiser avec lOGM.
Maïs : OK, il ny a pas dhybrides,
Colza : plus problématique car il y a une hybridation
possible avec la ravelle.
"
Problème de dispersion.
-
Problème déthique avec les
manipulation du vivant.
Ø Auxines
et organogenèse :
§ Rhizogenèse :
j Bouturage de la vigne Vitis
vinifera :
![]() Bourgeon
auxiliaire (végétatif)
Bourgeon
auxiliaire (végétatif)

![]() AIA ?
AIA ?
![]()
![]() Sable humide Racines
adventives
Sable humide Racines
adventives
Le
bourgeon auxiliaire est nécessairement obligatoire pour avoir des racines.
Comme il est végétatif, il ny a pas de photosynthèse.

 k Décortication annulaire :
k Décortication annulaire :
"
Ce qui fait quil y a des racines passe par le Phloème.
LAIA y passe






l Expérience de Cooper (1935) sur Citrus
sp. :
Bouture : Rebouture :
![]()
AIA :
105 g.mL1 Plus
de racines adventives
"
Les composés endogènes
oligotrophiques jouent un rôle de régulation
(des composés macrotrophiques nont pas
été trouvés)
"
La rhizogenèse est due à lAIA et à des composés oligotrophiques (vitamines)
§ Caulogenèse :
j Exemple avec une plante tropicale Allopectus :
 "
Néoformation de bourgeon sur une feuille
"
Néoformation de bourgeon sur une feuille
![]()
![]()
![]() Sable
humide Blessure à lapex de la feuille
Sable
humide Blessure à lapex de la feuille
(trou)
![]() Nervure principale épaisse
Nervure principale épaisse
|
[AIA] = 108
g.mL1 |
" |
Bourgeons
adventives |
|
[AIA] >
108 g.mL1 |
" |
Bourgeons et
racines adventives |
|
[AIA] = 105
g.mL1 |
" |
Racines
adventives |
|
[AIA] >
105 g.mL1 |
" |
Gall |
![]()
![]()
![]() AIA
AIA

?
k Exemple avec Crambe
maritima (chou
avec une grande racine) par Stroughton et Plant (1940) :
Soit
un segment de longueur variable :
8 cm
2 cm

Gradient dAIA
Gradient dAIA
" "
Caulogenèse
Surtout de la rhizogenèse
§ Quelques applications :
|
|
|
|
|
|
j Bouturage :
k Marcottage :
 On
retrouve cette application dans la nature chez les fraisiers. On peut la
réaliser artificiellement :
On
retrouve cette application dans la nature chez les fraisiers. On peut la
réaliser artificiellement :
-
Marcottage par couchage :
-
 Marcottage
aérien :
Marcottage
aérien :
 l Expérience de Nitsch (1950) :
l Expérience de Nitsch (1950) :
La
fraise est un polyakène (plusieurs fruits)
Après
fécondation :
-
On retire les carpelles :
" La fraise ne grossit pas.
-
Si on nen laisse quun :
" Atrophie là où il ny a pas de carpelles.
-
On retire les carpelles et on
pulvérise de lAIA :
" Obtention de fruits parthénocarpiques.
(=
production de fruits sans quil ny ait eu
développement
dune graine, naturelle ou mimée)
Exemple :
|
|
Parthénocarpe
naturelle ? |
Induction
par les auxines |
|
Tomate |
Oui Sil
y a un stress (mécanique, ou abiotique) ou une pollinisation inter espèce |
AIA ;
AIP ; AIB ; ANoA |
|
Aubergine |
Non |
AIA ;
2,4D ; ANA ; DefH9iaaM
(= trangène chimérique) |
|
Banane |
Oui Par
sélection variétale et avec un meilleur rendement |
AIA ;
2,4D ; ANA |
|
Concombre |
Oui (contrôle
génétique) |
AIA ;
2,4D ; ANA |
Cela permet dobtenir des fruits plus
nombreux, daugmenter le rendement et de faire de la culture hors saison.
m Culture in vitro :
La
1ère culture a été effectuée par Roger Jean Gautheret (1910 1997),
président de lacadémie des Sciences.
n Désherbage hormonal :
Il
sagit de laccumulation des auxines de synthèse, entraînant une prolifération
cellulaire létale.
"
Il consiste en un herbicide
sélectif : les monocotylédones (= graminées) deviennent plus résistantes.
Il
diffère du désherbage chimique comme avec le chlorate. Ce dernier est un
analogue du nitrate. Il ny a aucune différence pour la plante mais la NR ne le
reconnaît.
"
Il y a une accumulation létale et une rémanence longue dans le sol.
Alors que le désherbant hormonal est
biodégradable.
v Les gibbérellines :
Ø Découvertes
et structures :
§ Découverte :
Dans
les rizières, les cultivateurs asiatiques observaient des élongations anormales
des entrenuds. Ce gigantisme entraînait la verse puis la stérilisation par
épuisement.
" « foolish
seedlings » = « bakanae » =
« plantesfolles »
En 1926, Eiichi Kurosawa a découvert un
champignon parasite à la base des plantesfolles (riz) Il sagit dun
ascomycètes : Gibberella funjikoroï
En
pulvérisant un broyat de ces champignons sur du riz sain, il observa de nouveau
le gigantisme.
§ Structure :
-
1939 : La molécule active est isolée et purifiée par
cristallisation,
-
1956 : La structure est élucidée.

Noyau
gibbérellane :
(numéro
dordre de découverte)

Pont formant un autre cycle
Þ GA 3 =
acide gibbérelique
(le plus puissant des
gibbérellines)
Ø Rôle
:
-
Levée de la dormance
embryonnaire,
-

 Levée de la
« dormance » des bourgeons axillaires,
Levée de la
« dormance » des bourgeons axillaires,
-
Élongation des entrenuds.
![]()
Pois nain
Pois
WT Pois nain + 10
ng de GA 3
Ø Modes
daction :
§ Synergisme gibbérellines
AIA :
Expériences
sur les jeunes tiges :
![]() j
j
Apex coupé " Pas de
croissance.
![]()
k
" Pas de
croissance.

 l
l
" "
Þ Synergie
Gibbérelline AIA pour lélongation cellulaire.
Les
gibbérellines favorisent la synthèse de lAIA :
-
Augmentation de la
transcription :
-
Protéase pour la protéolyse,
-
Cellulase : enzyme clé de
lélongation cellulaire.
-
Augmentation de la stimulation de
lanabolisme protidique :
 GA3 Acide
pyruvique Acétyl_CoA
GA3 Acide
pyruvique Acétyl_CoA
Acide acétique (
Acide oxaloacétique
Acide malique Acide
citrique
KREBS
Acide succinique Acide acétoglutarique
Acide
glutamique Protéines
Ø Applications
:
§ Floraison des bisannuelles
ornementales :
Ces
plantes ont un cycle de 2 ans avec une floraison la 2ème année. Avec
les gibbérellines, la floraison est donc contrôlée et rapide.
§ Obtention de fruits
parthénocarpiques :
Les
gibbérellines sont identiques que les auxines mais pour des espèces
différentes.
§ « Raccourcissement »
des céréales par des anti-gibbérellines :
Ils
interfèrent avec les gibbérellines.
Exemples :
-
Le chlorure de
2_chloroéthyl_triméthylamonium (CCC),
-
Le Cycocel (chlorure de
chlorméquat)
v Les cytokinines :
Kines = division Cyto
= cellulaire
Ø Découverte
:
-
Johannes Van Overbeck (1941) a
effectué une culture dembryon isolé in
vitro de Datura avec lapport de lait de coco et dAIA.
-
Stewart et Shantz (1954) ont
découvert la diphénylurée :
![]()
NH -
CO - NH
Le problème est que cette molécule
découverte nest pas universelle.
"
Elle nest donc pas une hormone mais juste un facteur de croissance.
-
Folke K. Stkoog (1908 2001) a
travaillé, en 1956, sur des cultures de tissus de tabac et a remarqué le besoin
dune molécule avec une base structurale dadénine (que lon trouve en grande
quantité dans le sperme de hareng)
"
Il sagit de la 1ère cytokinine isolée :
 6_furfuryl_aminopurine (ou
6_furfuryl_adénine)
6_furfuryl_aminopurine (ou
6_furfuryl_adénine)
En fait, il sagit dune
cytokinine de synthèse (pas présente dans la plante mais de bon marché)
-
D. S. Letham (1963) a découvert
la 1ère cytokinine naturelle dans le maïs : la zéatine.
Prix hors taxe : 29,30
les 5 mg
59
le gramme
-
Les cytokinines de
synthèse :
-
La benzyl_aminopurine (BAP)
ou benzyl_adénine :

Il sagit de la cytokinine la plus
active.
Les
cytokinines sont synthétisées dans les racines, graines et fruits. On les
retrouve dans les parties aériennes de la plante via la sève montante.
Ø Action
sur la croissance :
§ Stimulation des divisions
cellulaires :
Exemple
de cultures de moelle de tabac in vitro :
-
Sans hormone : " Pas de division, pas délongation,
-
Avec de lAIA : " Elongation cellulaire mais pas de division,
-
Avec des cytokinines : " Divisions cellulaires mais pas délongation,
-
Avec les 2 (lait de coco) : " Divisions et élongation cellulaires.
Þ Il y une
synergie pour les divisions cellulaires.
Test
de Skoog :
Pour savoir si un tissu contient des
cytokinines, on ajoute au tissu de lAIA.
Sil y a des divisions cellulaires, il y
a des cytokinines.
§ Caulogenèse :
Travaux
sur des fragments de Funaria in vitro :
Nombre
de bourgeons adventifs
 (en unité relative)
(en unité relative)
1000
Avec cytokinines
100 Sans cytokinines
10 14 16 Temps
Exemple
de balances hormonales :
|
|
AIA |
Cytokinine |
|
|
Balance
auxinique : |
2.106
g.mL1 |
108
g.mL1 |
" Racine |
|
Balance
cytokinique : |
2.106
g.mL1 |
Plus
de 108 g.mL1 |
" Bougeon |
Si
la balance est mal ajustée, il y a soit aucun effet, soit leffet inverse.
Si
on remplace lAIA par lABA, il faut revoir la balance.
v Acide abscissique et
éthylène :
Ø La
chute des feuilles :
Les
effecteurs (climatiques et etc.) sont : la sécheresse, les jours
courts, la compétition interorganes, etc.
Au
niveau dun nud :
 Tige Pétiole
Tige Pétiole
![]()
![]() Couche
régénératrice (cellules pallissadiques)
Couche
régénératrice (cellules pallissadiques)
Elle
apparaît en 1ère.
Couche
dabscission
Elle
est mise en place par la couche régénératrice
Les
2 couches forment la zone dabscission.

La couche dabscission est le siège de
sécrétions denzymes de dégradation : les « ases » (cellulase,
etc.)
Elle entraîne ainsi :
-
la digestion cellulaire de la
couche régénératrice,
-
la sécrétion de liège
cicatrisant,
-
et la chute par mouvement
mécanique.
Ø Régulation
hormonale :
§ Intervention des
auxines :
j
Concentration en AIA dans les feuilles lors de
la chute en automne :
En jours longs, la concentration en
AIA est constante.
Durant les jours courts, celleci
diminue.
k
Un
apport dAIA retarde la chute des feuilles, expérience sur le Coleus :
Si on supprime le limbe (source de
lAIA), il y a la chute du pétiole.
Si on remplace le limbe par un bloc
imbibé dAIA, il ny a pas de chute.
§ Intervention des
cytokinines :
j Lors dun stress hydrique, les feuilles
tombent.
Si on applique des cytokinines (105
g.mL1) sur
une feuille basale, celleci échappe à la sénescence comme sil sagissait
dune jeune feuille
feuille basale = feuille à la base de la tige, donc
plus ancienne
k Si on apporte des cytokinines sur un seul
coté de la feuille (105
g.mL1), on
observe une concentration en AIA différente de part et dautre de la
feuille :
-
-
Þ
Les cytokinines ont un rôle indirect sur la sénescence en faisant
augmenter la concentration en AIA.
§ Rôle de létylène :
H2C 9 CH2
Il
sagit dun gaz, il peut donc diffuser facilement dun tissu à un autre.
Il
est synthétisé à des moments précis :
-
Maturation des fruits dits
climactériques (fruit maturé grâce à un pic déthylène)
-
Tissus âgés, comme la
feuille, qui entrent en sénescence
Il
joue un rôle dans :
-
Le déclenchement de labscission
des feuilles, fleurs et fruits
-
La levée de dormance des
bourgeons axillaires (effet inverse de lauxine qui maintient les bourgeons en
dormance)
-
Migration à partir dune synthèse
de 0,5 mL.h1.kgMF1
Son
émission est maximale à
Léthylène
est dit « antiauxine ».
Synthèse de
léthylène :

Adénosine
Activation ACC
Synthase ô
 S CH3
S CH3
+ ATP + PP + Pi +
CH2 COO
Adénosine
* ô C
CH2 NH3+
=
ACC
= AminoCyclopropane Carboxylique
![]() CH2
COO ACC Oxydase
CH2
COO ACC Oxydase
![]() ô C H2C 9 CH2
ô C H2C 9 CH2
CH2 NH3+
+ + CO2 + H2O + HCN
½ O2
Application au
contrôle du mûrissage des fruits :
j
Atmosphère contrôlée « postrécolte » (non saturé) :
-
Pomme,
poire, banane : CO2 " Stabilisation
- Banane, pêche, abricot : CH4 " Facilitation
de la maturation
postrécolte
- Melon, avocat, tomate " Ventilation
pour le stockage
-
Fruits
tropicaux " Réfrigération
(hydrocooling)
Blocage des mécanismes
(maturation
complexe) " Récolte
pile à maturité
Froid
humide (chambre froide)
k
Génie génétique :
-
Inhibition de la synthèse
déthylène (au niveau de lACC oxydase) par les techniques antisens. Exemple : la tomate long life (anti ACC oxydase), la tomate mid life
"
Intéressantes pour les coulis, concentré, etc.
 ADN ARN Protéine
ADN ARN Protéine
![]() Transcription Traduction
Transcription Traduction
![]()
![]() impossible
impossible
Hybridation
avec
un antisens
Remarques :
Mûrissage
des bananes : 95 % de N2 et 5 %
déthylène pendant 24 H à
§ Intervention de lacide
abscissique :
Lacide
abscissique est découvert en 1963 dans le cotonnier.
-
Il favorise la formation de la
couche abscissique (antiauxine)
-
Il y a une accumulation en jours
courts dans les graines et les bourgeons
"
Il joue un rôle dans lentrée en
dormance des bourgeons auxiliaires (dormine)
-
Il stimule la tubérisation.
-
Il sagit dune hormone de
« détresse »
v Dautres hormones ?
-
Lacide salicylique : Inhibiteur de la synthèse déthylène
-
Lacide jasmonique : Stimulateur de la éthylène,
Accélérateur de la dégradation des
pigments,
Inhibiteur de la croissance des racines
-
Les polyamines
v Aspects morphologiques et
biologiques :
Ø Définition :
Il
sagit du processus de différenciation (changement qualification détat :
potentiel de la plante à fleurir)
Ø Transformation
de lapex :
Il
sagit du passage de létat végétatif à létat reproducteur :
 Apex végétatif :
Apex végétatif :
![]() Proméristème
sporogène
Proméristème
sporogène
![]() Anneau initial
Anneau initial
![]() Proméristème
respectaculaire
Proméristème
respectaculaire
![]()
![]() Méristème
médullaire
Méristème
médullaire
=
Méristème dattente
Apex floral :

![]() A
lorigine des organes floraux :
A
lorigine des organes floraux :
![]()
Réceptacle floral
-
Sépales, (de
lextérieur)
-
![]() Pétales,
Pétales,
-
Etamines,
-
Carpelles (vers lintérieur)
Ø Cycle
biologique :
La
transformation dépend de la plante : floraison unique, annuelle, à une
certaine saison, après 30 années de vie végétative.
"
On parle daptitude à fleurir.
Germination :
Début de la croissance d'une graine mûre, généralement dormante Emergence :
Apparition des organes aériens à la surface du sol. Montaison :
Développement et croissance de la plante Epiaison :
Chez les graminées, apparition de l'épi (blé) ou de la panicule (avoine) au
sommet de la dernière gaine. Fruitaison :
Apparition du fruit.
§ Plantes monocarpiques :
Ces
plantes ne fleurissent quune seule fois.
Exemple des
céréales :
![]() j
Dites « de printemps » : cycle
denviron 8 mois
j
Dites « de printemps » : cycle
denviron 8 mois
|
Automne |
Hivers |
Printemps |
Eté |
|
|
|
|
Germination Emergence |
Montaison Epiaison |
… Mort |
![]() k
Dites « dhivers » :
k
Dites « dhivers » :
|
Automne |
Hivers |
Printemps |
Eté |
|
|
|
Germination Emergence |
|
Montaison Epiaison |
… Mort |
Ce
sont des fausses bisannuelles : elles sont à cheval sur 2 années civiles
mais leur cycle est inférieur à 12 mois.
Ces
céréales nécessitent de passer lhivers sous forme de rosette. Si elles sont
plantées au printemps, il ny a pas de graines.
Cas des
bisannuelles :
Carottes,
betteraves, digitales,
![]() j
Exemple de
j
Exemple de
|
Printemps |
Eté |
Automne |
Hivers |
Printemps |
Eté |
|
|
Germination Emergence |
Développement
uniquement végétatif |
Montaison |
Fruitaison |
… Mort |
||
De
même que les céréales dhivers, les bisannuelles ont besoin de basses
températures pour quil y ait une floraison.
Cette
application aux basses températures est appelée vernalisation. Mais on verra quil ne faut pas que cette condition.
k
Cas des plantes pluriannuelles mais monocarpiques :
Agare,
Lannée
de floraison est la dernière année du cycle.
§ Plantes polycarpiques :
Il
y a plusieurs floraisons sur plusieurs années successives.
§ Acquisition des compétences
nécessaires à la mise à fleur :


Méristème
Méristème Méristème
Pas pour les annuelles végétatif inflorescentiel floral
|
Méristème végétatif |
|
Méristème apte à fleurir |
Conditions tropiques
photopériodiques : |
Initiation florale |
Croissance des organes floraux |
|
|
-
Plante
indifférente, -
Plante
préférente, -
besoin
absolu de la vernalisation |
|
-
Plante
indifférent, -
Plante
de jours courts, -
Plante
de jours longs |
=
Mise en place des organes floraux |
|
v Aspects physiologiques =
conditions trophiques et thermiques :
Ø Conditions
trophiques :
Une
plante a besoin de réserve (ce nest pas quun aspect quantitatif mais
aussi qualitatif) :
-
Pour la floraison " Réserve de composés carbonés
-
Pour la poursuite de létat
végétatif (ébauche de feuille) " Réserve de composés azotés
Ø Thermoinduction
froide = Vernalisation :
§ Les différents besoins en
froid :
Plantes à
besoins nuls :
Il sagit des plantes
indifférentes : les plantes annuelles (céréales de printemps)
Plantes à
besoins relatifs :
Il sagit des plantes préférentes :
j Exemple des
céréales dhivers (fausse bisannuelle)
Exemple des
céréales dhivers (fausse bisannuelle)
Floraison
tardive
« 25
feuilles »
« 7
feuilles »
« 1 à 2
feuilles »
k Exemple de
 Jusquiame
(bisannuelle vraie) :
Jusquiame
(bisannuelle vraie) :
Printemps Eté Automne
Hivers Printemps
Eté
6 semaines à ![]()
Mort
![]() "
Cycle annuel
"
Cycle annuel
![]()
![]()
![]()
On
parle de besoins relatifs car, des fois, ils peuvent être absolus.
§ Caractéristiques de la
vernalisation :
·
Maturation
de vernalisation :
Une
plante mature est une plante réceptrice de la vernalisation.
-
Pour les céréales dhivers,
cest au stade de semence,
-
Pour la Jusquiame noire
bisannuelle, cest au stade de rosette.
·
Sur
des tissus métaboliquement actifs :
Exemple :
Les céréales dhivers :
Si
on les hydrate et on les met au froid, les graines réagissent comme celles de
céréales de printemps.
|
Vernalisation pas
efficace : |
Eléments nécessaires à la
vernalisation : |
|
Grains
secs |
H2O |
|
Grains
hydratés + 2,4 DNP (dinitrophénol) |
O2 (activité respiratoire) |
|
Embryon
isolé |
Réserves
de Carbone |
·
Température
optimale de vernalisation :
Exemples :
-
Céréales dhivers : 1 mois à 2
5 °C
-
Jusquiame noire
bisannuelle : 6 semaines à 5 °C
-
Olivier : quelques
semaines à 13 °C
·
Application
du froid continue ou discontinue :
Exemple :
Les céréales dhivers :
On
peut effectuer une alternance de 2 3 jours à 2 5 °C sur 2 3 jours à 12 13
°C.
"
Il faut que la somme des périodes
froides soit supérieure à 1 mois.
·
Dévernalisation
:
Exemple :
Les céréales dhivers :
On
applique un froid (2 à 5 °C) pendant un mois puis, immédiatement après, 7 jours
à 35 °C. "
On aura alors une floraison tardive.
Si
on attend avant dappliquer les 35 °C, il ny aura pas de retard dans la
floraison.
§ Mécanisme de la
vernalisation :
La
vernalisation est différente de la floraison. Il sagit en fait de
lacquisition dune aptitude à fleurir.
j Exemple de
greffage :
|
Greffon |
Porte greffe |
Résultat |
|
Rameau
de Jusquiame noire bisannuelle non vernalisée |
Jusquiame
noire bisannuelle vernalisée |
Floraison
du greffon " Signal |
|
Jusquiame
noire annuelle |
Floraison " Signal présent naturellement |
|
|
Tabac
(plante annuelle) |
Floraison " Signal universel |
Þ Il y a
la présence dun signal transmis par hormone.
A ce jour, on
ne la toujours pas isolée mais elle a déjà un nom : la vernaline
k Rôle
des gibbérellines :
-
GA3 induit la floraison.
Exemple de la carotte qui peut fleurir
sans être vernalisée avec, à la place, un apport de GA3. Mais cela ne marche
pas avec toutes les espèces.
-
CCC supprime leffet de la
vernalisation.
-
Les gibbérellines nagissent pas
seules
§ Applications :
Elles
sont dordre agronomiques et horticoles.
Petite
histoire qui a posé un problème déthique : laffaire Lyssenko Trofime (1898 1976)
Les
soviétiques avaient leur autonomie mais il y avait des problèmes
climatiques : la belle saison était trop courte pour le blé de printemps
et lhivers était soit trop rigoureux (Ukraine), soit trop doux (Sud du
Caucase) pour le blé dhivers. Il a fallu la vernalisation artificielle des
grains de blé dhivers.
Lyssenko : « On sen fout de lorigine génétique de
lindividu, lenvironnement change tout. La génétique na plus besoin dêtre
enseignée car il ne sagit que de croisements hasardeux »
"
Théorie de la dominance des facteurs environnementaux sur lorigine génétique.
Un
ajout qualitatif permet de modifier un individu et de le transmettre à se
descendance.
Lyssenkisme = divergence jusquen 1962 avec la génétique
mendélienne et de Watson et Cricks.
Ø Thermoinduction
chaude :
Elle
entraîne la formation débauches florales. Il sagit plus quune acquisition de
potentiel.
Elle
concerne essentiellement les plantes à bulbe.
Exemples :
-
Les tulipes : températures douces (20
25 °C)
-
Lail et les oignons : températures fraîches (10 15 °C)
§ Exemple de la tulipe :
·
Cycle
de culture :
|
Octobre
Novembre |
Janvier
Février |
Mars
Avril |
Juin |
|
Plantations
des bulbes |
Début
de végétation |
Floraison |
Retrait
des bulbes |
·
Conditions
thermiques optimales :

Eté Printemps Hivers
20
°C
Ebauches Levée
de dormance
Florales par les basses températures Réchauffement
progressif
« dormantes » ( ≠ Vernalisation ) " Epanouissement de la fleur
8 °C
Automne Hivers
3 16 21 Semaines
v Aspects physiologiques =
photopériodes et mise à fleur :
Ø Définitions :
Photopériodisme :
Ensemble
des réactions dun organisme influencées par lalternance quotidienne des jours
et des nuits avec ses variations annuelles.
Nycthémère :
Répartition
jour nuit sur une journée (24H)
![]()
0
H 24H
Héméropériode Nyctipériode
ou Photopériode ou Scotopériode

§ Espèce indifférente à la
longueur du jour :
·
Plante
apériodique :
Exemple :
Pomme de terre

F = F = F = F
·
Plante
photopériodique :
Exemple :
Tomate, Pois, Lilas, Cerisier

F F = F
= F
MT
MT : Minimum
trophique =
minimum de lumière pour la photosynthèse
Environ 5 Heures, jusquà 8 H
§ Espèce sensible à la longueur
du jour :
·
Plante
héméropériodique absolue :
Exemple :
Céréales dhivers, Bruyère, Carotte,
Jusquiame
noire bisannuelle

f
f
F
F F F
MT
HC
HC :
Héméropériode critique =
durée déclairement à dépasser pour avoir une floraison
MT <
HC Plus
elle sera dépassée, plus la floraison sera importante (= plante de jours longs)
·
Plante
héméropériodique préférente :
MT=HC .

f
f
F
F
MT=HC
·
Plante
nyctypériodique absolue :
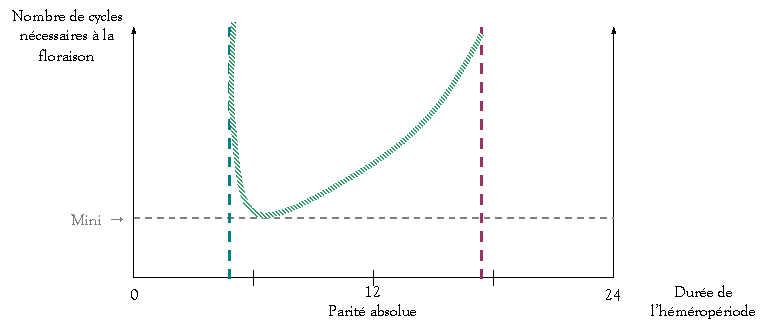
f
f
F
F
MT HC
HC : Héméropériode
critique =
durée déclairement à ne dépasser pour avoir une floraison
Plus
on sen approche, plus la floraison est importante (= plante de jours courts)
·
Plante
nyctipériodique préférente :

f
f
F
F
F
MT HC
·
Plante
amphipériodique :
Exemple :
quelques variétés de tomates

f f
f f
F F
F F
F F
MT
HC1 HC2
HC1 :
Héméropériode critique =
durée déclairement à dépasser pour avoir une floraison
HC2 :
Héméropériode critique =
durée déclairement à ne dépasser pour avoir une floraison
Ø Caractéristique
du photopériodisme :
§ Eupériode et
dyspériode :
Eupériode :
Conditions photopériodiques favorables à la floraison (= initiation florale)
Exemples :
-
Plante nyctipériode : Lampourde " 1 jour court
-
Plante héméropériode : Céleri " 4 jours longs
Betterave " 18 jours longs
Dyspériode :
Conditions photopériodiques défavorables à la floraison.
§ Efficacité des éclairements
faibles :
j Espèces
de jours courts en eupériode :
 950
W.m2
950
W.m2
Þ
Floraison
50 W.m2
Þ
Pas de floraison
(réversion de linitiation
= éclairement faible florale)
(» Éclairement de la lune)
k Espèces
de jours longs en dyspériode :
 950
W.m2
950
W.m2
Þ
Pas de floraison
50 W.m2
Þ
Floraison
·
Spectre
daction des éclairements :
Lefficacité de l
dépend de sa longueur donde et de son intensité.
J.m2
Efficacité
 de l :
de l :
 250 25
000
250 25
000
200 20
000
150 15
000
100 10
000
50
5 000
(UV)
560 600 640 680 720 760 800 (IR)
Rouge clair Rouge sombre
R ; red FR ; far red
»
665 nm »
735 nm
§ Antagonisme rouge clair /
rouge sombre :
Exemple :
la Lampourde (plante de jours courts) :

"
Floraison
Flash
FR
"
Floraison
Flash R
"
Pas de floraison
"
Floraison
Si
on termine par un flash de rouge clair, il ny a pas de floraison.
Si
on termine par un flash de rouge sombre, il y a une floraison.
·
Le
phytochrome :
= Chromoprotéine
Protéine
S S Chromophore
=
tétrapyrrole ouvert
Pour
le dernier pyrrole, il existe 2 conformations possibles (Cis et Trans)
Conversion Pr
Û Pfr :

Synthèse Réversion enzymatique Dégradation
La
nuit, le Pfr nest pas éclairé. Il subit donc sa
dégradation et sa réversion en Pr.
§ Spectre dabsorption :

665 735
300 400 500 600 700 800 l (nm)
·
La Pfr est toujours la forme active :
j Plantes
de jours longs :
La Pfr
stimule la floraison.

Pr
En position JOUR, le Pr est converti en Pfr qui saccumule
![]()
![]() Durée
déclairement (665 nm) minimale pour constituer le Pfr.
Durée
déclairement (665 nm) minimale pour constituer le Pfr.
Pfr =
HC à dépasser
 "
Pas de Floraison
"
Pas de Floraison
"
Floraison
Pr
9
Conversion en Pfr
k Plantes
de jours courts :
La Pfr
inhibe la floraison.
En position NUIT, le PFR est dégradé en Pr.

Pfr Durée
minimale pour dégrader le Pfr.
= HC à ne pas dépasser
Pr
·
Phytochrome
et photomorphogenèse :
Exemple écophysiologique : Lombre verte en sous
bois :
Il
y a une compétition plante plante pour la lumière, ainsi quun autoombrage
des feuilles à lapex sur les feuilles plus basses.

Exemple :
Le trèfle :
-
Chute dintensité de la lumière " Diminution du taux de ramification
-
Chute du ratio Pr / Pfr " Sans effet sur la ramification
Augmentation de la longueur du pétiole
|
|
Conditions
standard |
Ombre
forte |
|
Intensité I |
500 µmol.m2.s1 |
150
µmol.m2.s1 |
|
Ratio Pr / Pfr |
1,15 |
0,1 |
|
|
Stolons
très ramifiés Pétioles
courts |
Stolons
peu ramifiés Pétioles
longs |
|
|
Occupation
maximale de lespace optimum |
|
Photosensibilité
des gènes : Séquences promotrices
photosensibles :
Exemple :
Promoteur du gène rbcS de la sousunité de la rubisco (chez le pois)
|
|
|
|
+ + + |
|
|
+ + |
|
|
+ |
|
|
|
|
|
+ + + |
+ + + |
|
+ + + |
|

Ø Nature
hormonale du photopériodisme :
§ Site de perception différent
du site de réaction :
Exemple :
La lampourde (plante de jours cours) :
|
Greffon |
Porte
greffe |
|
|
Bourgeon
auxiliaire en
jours longs |
Feuilles
isolées en
jours longs "
Dyspériode |
" Pas de floraison |
|
Feuilles
isolées en
jours longs "
Eupériode |
" Floraison |
§ Le stimulus agit à faible
concentration :
Exemple :
La lampourde :

Une
feuille en eupériode permet de déclencher une floraison chez toute la plante.
§ Le stimulus peut être
inhibé :
Exemple :
La lampourde :

"
Pas de floraison
"
Floraison plus abondante
Les
feuilles en dyspériode créent une inhibition.
§ Linhibition peut être
totale :
Exemple :
Lépinard (plante de jours longs) :

Le
signal dyspériodique peut être suffisamment important pour annuler le signal eupériodique.
§ Le stimulus est non
spécifique :
|
Greffon |
Porte greffe |
|
Rameau
défolié de tabac (jours courts) cultivé en jours longs |
Jusquiame
bisannuelle (jours longs) cultivée
en jours longs |
"
Floraison.
Quelle est
lhormone ?
Une hormone
florigène, appelée anthocaline, mais elle nest pas encore découverte
Ø Conclusion
:
La
mise à fleur est une différenciation, un changement détat, du méristème
végétatif en méristème reproducteur puis floral.
j Cas
complexe :
Il y a
un nombre élevé de conditions différentes.
Exemple
de la jusquiame noire bisannuelle :

k Cas
particulier :
Exemple
des bulbes :

l Cas
simples :
Exemple
des lilas, pois, cerisier :
