
Retour au sommaire des cours |

Une version pdf est à votre disposition ici. |
v Introduction :
Physique
& biologie ?
® Filière
scientifique, non ?
Prétention
de la physique :
compréhension d’objets inertes, des plus petits aux plus grands.
Physique
ancienne :
Le
voyage sur la Lune était déjà, théoriquement, possible
(Il manquait
juste des petits détails pratiques…)
+ Concept de
continuité de la matière (lumière, matériaux comme une planche de bois)
Or, c’est
faux !
La
lumière est discontinue (émission de particules), une planche de bois n’est
qu’un assemblage de vide.
® Physique
moderne :
Changement
de vision des choses
Maintenant,
il est possible de calculer une probabilité de position d’un électron autours
d’un atome.
v Les objets de
l’univers :
Ø L’univers :
Âge : 13,7.109 ans
Soit
4,32.1017 secondes
Son
origine est le BIG-BANG, une explosion de matière dont de la lumière. De là, on
peut deviner sa taille :
v
= d / t d = c . t =
Taille : 1,3.1026 m.
Une
telle distance est inconcevable en mètres, il faut chercher une autre
unité : les années–lumière (= la distance que la lumière parcourt en 1 année)
1
année-lumière = 365 . 24 . 3 600
. 3.108
= 9,48.1015 m
Taille : 13,7.109 années-lumière.
Ø Le
domaine humain :
=
dimensions à l’échelle humaine :
Plus
grand : quelques dizaines ou centaines de kilogrammes, mètres, secondes,
heures ou jours. Plus petit : quelques micromètres.
Ø L’atome :
Ordre
de grandeur : l’angström 1 Å = 10–10 m.
Il
est constitué d’un noyau et d’électrons. Le noyau est constitué de A nucléons.
dont
Z protons,
+
A – Z neutrons.
L’ensemble
des protons – neutrons constitue les nucléons (composés chacun de 3 quarks)
Tout
atome est neutre : les électrons sont au même nombre que les
protons : Z.
Un
élément chimique est défini par le nombre Z de protons dans le noyau.
La
masse de la matière est exclusivement dans le noyau. m = 1,66.10–27 kg. La masse
d’un électron est 1836 fois moindre.
Noyau
![]()
![]()
![]()
( 1mm) (
1 µm)
Dimensions . 1012
Ø Notion
de temps :
|
Univers |
Temps de
vie : |
13,7.109 ans = 4,7.1017 s |
|
Homme |
Temps de
vie : |
75 ans = 2.109 s |
|
Atome |
Période de
vibration : |
10–14 s |
|
Noyau |
Temps de la
lumière pour le traverser : |
3.10–24 s |
v Interactions entre ces
objets :
Ø Interaction
gravitationnelle :
=
force de gravité.
Découverte par
Newton.
=
Force entre 2 objets massiques.
m1 . m2
![]() FG = G . G =
6,67.10–11 MKSA
FG = G . G =
6,67.10–11 MKSA
d²
C’est
elle qui gouverne le cosmos, le mouvement des planètes, les marées, la gravité.
Ø Interaction
électromagnétique :
=
Force entre 2 objets chargés.
1 q1 . q2 1
![]()
![]()
![]() FE = . =
9.109 MKSA
FE = . =
9.109 MKSA
4. π . e0
d² 4. π
. e0
C’est
cette force qui gère l’interaction entre 2 objets chargés, mais aussi les
frottements (résistance) La charge électrique en mouvement entraîne une force
magnétique sur une autre charge électrique.
Le
noyau pose problème : les protons (particules chargées à l’intérieur du
noyau) se repoussent.
Ø Interaction
nucléaire forte :
Elle
assure la cohésion du noyau et la cohésion des quarks dans le nucléon. Leur
découverte reste empirique : on ne visualise que leurs effets. On sait que
leur portée est petite, de l’ordre du noyau (10–15 m) et
suffisamment forte pour contrecarrer la force électromagnétique.
Ø Interaction
nucléaire faible :
Elle
permet de modifier les quarks de type U en type D et vice–versa. Cela entraîne
la transformation de proton en neutron et réciproquement.
Elle
est 106 moins forte que l’interaction
nucléaire forte et sa portée est de 10–18 m. Mais elle
explique le phénomène de fusion des atomes d’Hydrogène en atome d’Hélium dans
le soleil. Sans cette fusion il n’y a pas d’énergie nucléaire, donc pas de
soleil et donc aucune vie possible sur la Terre.
Proton
(charge +) " Neutron
+ b+ +
1 neutrino
Þ Radioactivité b + b+ : électron
qui porte une charge + e (= anti–électron)
Neutrino : particule sans masse (ou très faible)
qui
a une interaction quasi nulle
avec la matière.
Neutron
" Proton
+ bˉ +
1 antineutrino
Þ Radioactivité bˉ bˉ :
électron « classique » qui porte une charge –
e.
On utilise le « b » pour indiquer que cet électron n’est pas originaire du cortège électronique.
bˉ et b+ =
particule et antiparticule.
La
rencontre d’une particule avec son antiparticule entraîne une disparition de la
matière et une libération d’énergie sous forme de photons.
Ce
processus est utilisé dans l’imagerie médicale avec l’émission de b+ qui, une fois
qu’ils rencontrent de la matière, rencontrent forcément des électrons.
![]()
Rayonnement g
(
b+ ; eˉ ) et
disparition de la matière.
Comprendre
un atome avec la précision la plus fine :
" Comprendre un
noyau :
9 Calcul des 4
interactions entre les nucléons 2 à 2.
Possible quand il n’y en a pas trop, comme l’Hydrogène ou Hélium…
+ Calcul des 4 interactions avec et dans le
cortège électronique.
Alors essayer de
comprendre 2 atomes...
À
l’échelle macroscopique :
On
ne considère pas les manifestations des interactions entre les atomes ; il
suffit de travailler avec les forces gravitationnelles et coulombienne.
À
l’échelle de l’atome :
On
ne cherche pas à voir ce qui se passe à l’intérieur du noyau ; il suffit
de travailler avec la force coulombienne (la force gravitationnelle est
négligeable)
À
l’échelle du noyau :
On
ne travaille qu’avec les interactions Proton – Proton : la force
coulombienne et l’interaction nucléaire forte.
v Mesures d’une grandeur –
Outils et méthodes :
Expérience " mesures
" corrélation entre les des différentes
mesures.
Les
quantités fondamentales : Longueur – Temps – Masse – Intensité
électrique
Les
unités du Système International SI ou MKSA :
Longueur :
le Mètre, m
Masse : le
Kilogramme, kg
Temps : la
Seconde, s
Intensité de
courant : l’Ampère, A
+ Température : le Kelvin, K
Quantité de
matière : la Mole, mol
Ø La
longueur :
|
10–6 m |
1
µm (cellule) |
|
10–9 m |
1
nm (molécule) |
|
10–10 m |
1
Å (atome) |
|
10–12 m |
1
pm = 1 picomètre |
|
10–15 m |
1
fm (noyau) |
Défini par un mètre étalon en alliage de titane. Mais une définition vis–à–vis d’un objet est risquée car l’objet peut être perdu.
"
|
10–3 kg |
|
|
10–6 kg |
1 mg |
|
10–9 kg |
1 µg |
|
10–12 kg |
1 ng |
|
10–18 kg |
1 fg |
Ø La
masse :
Défini par un kilogramme étalon, il en existe 10 exemplaires précieusement gardés.
=
propriété de tout objet qui, lorsqu’il est en présence d’un autre objet,
l’attire.
1
atome : 1,66 . 10–27
kg
" 1u.m.a = 1 unité de masse atomique
= 1/12 de la masse d’un atome
de carbone
La
masse d’une mole (soit NA
atomes) de
1 . 12 . 10–3
12 . 6,03 . 1023
Ø Le
temps :
Au
départ, on observait une périodicité (jour–nuit ; saisons)
Maintenant, on définit la seconde à partir des vibrations de l’atome de Césium 133.
" 1 seconde = le
temps que l’atome de Césium vibre 9 192 631 770 fois.
On
obtient un temps différent selon que l’on est au niveau de la mer ou en
altitude : ceci est dû à la gravitation.
Ø L’énergie :
La
masse peut disparaître : ce n’est pas une unité fiable. L’énergie est
partout et est fiable. C’est une quantité fondamentale dans le sens où, sans
énergie, on ne fait rien.
Exemple : les réserves de
pétrole :
À
activité constante (sans tenir compte de l’émergence de la Chine et de l’Inde),
elles seront vides dans 50 à 70 ans.
Unité :
-
En
MKSA : le Joule
-
En
cm g s : l’erg
-
Pour
l’atome : l’eV
1
eV = l’énergie donnée à un électron quand on le soumet à un potentiel de 1
Volt.
|
103 eV |
1
keV |
|
106 eV |
1
MeV |
E = q . V
= 1,6 . 10–19 Coulomb . 1 Volt
= 1,6 . 10–19 Joule
Ø Dimension
et analyse dimensionnelle :
Soit : [ L ] ; [ M ] et [ T ]
Distance
= d Û
[ L ] Vitesse
= v = d/t Û
[ L ] . [ T ]–1
Accélération = a = v/t Û [ L ] . [
T ]–2 Force
= m.a Û
[ M ] . [ L ] . [ T ]–2
Énergie
= ? On recherche des
expressions de l’énergie :
E = m.c2 = [ M ] .
[ L ]2 . [ T ]–2
E = m.g.h = m.a.h = [ M ] . [ L ]2 . [ T ]–2 ( g = a)
Avec 2 expressions, on obtient une même dimension : ça ne veut pas dire que l’on a forcément bon, mais ça veut au moins dire que cette relation n’est pas délirante.
1
Joule =
=
=
= 107 erg.
Soit
2 grandeurs A et B :
Si A = B Þ [ A ] = [ B ]
Mais Si [ A
] = [ B ] ¹> A = B
E = h . n
= h . c /l h = 6,626 . 10–34 J.s
E
= k /l
(eV) (Å)
"
Trouvons k :
Soit la gamme du
visible : 4000 à 8000 Å
(m.s–1)
E = h .
c /l
(J) (J.s) (m)
(eV) 6,626
. 10–34 . 3 . 108 . 1010 (Å.s–1) 12 400 (eV. Å) = k
1,6 . 10–19 . l (Å) l (Å)
Si l = 4 000 Å alors E
= 3,1 eV
l
= 8 000 Å
alors E
= 1,55 eV
 T =
période = f( m, g, l )
T =
période = f( m, g, l )
ℓ
T = m A . g B . ℓ C
![]() m,
g [
g ] = [ L ] . [ T ]–2
m,
g [
g ] = [ L ] . [ T ]–2
T
[
T ]1 = [ m
] A . [ g ] B . [ ℓ ]
C
![]()
[
T ]1 = [ M
] A . [ L ] B . [ T ] –2B . [ L
] C
[ T ]1 = [ L ] 0 . [ T ] 1 . [ M ] 0
Donc : –2B = 1 Þ B = – ½
A
= 0
B + C = 0 Þ C = ½
D’où : T = √(ℓ /g) . 2π
Ø Chiffres
significatifs :
On
peut : Compter " valeur exacte
Mesurer " incertitude
Soit
une longueur mesurée ℓ = 41,55 cm
On émet des doutes sur le dernier chiffre, on ne garde que 3 chiffres significatifs.
Autre
exemple :
E = a .
C avec C = 2 250
On
mesure : E =
30,85 keV Þ a
= 0,013 711 111 11
Si
on reprend le calcul de E avec des valeurs plus ou moins précises de a
déterminée à partir de la mesure :
|
a =
0,013 711 111 11 |
E = 30,85 |
|
a =
0,013 711 |
E
= 30,84975 |
|
a =
0,013 71 |
E
= 30,8475 |
|
a =
0,013 7 |
E
= 30,825 |
|
a =
0,014 |
E
= 31,5 |
|
a =
0,01 |
E
= 22,5 |
Ø Les
incertitudes sur les mesures :
Soit
La mesure d’une grandeur X
donnant un résultat x,
Et le résultat réel : x0.
L’erreur : e
= x – x0 Soit
positive, soit négative.
L’incertitude : Dx = |e| On prend toujours l’arrondi
au dessous.
L’incertitude
relative : Dx / x0 Problème : on ne
connaît pas x0 !
" Dx / x
Exemple :
La
masse du soleil = 1,9889
± 0,0030
DM /M =
0,0020 /1,9889 = 1,508 . 10–3
La
masse de la Terre = 5,974 ± 0,009
DM /M =
0,009 /5,974 = 1,506 . 10–3
Mesure
directe :
![]()
![]()
![]() On mesure : x " Dx = DR + Dx ℓ + D xE
On mesure : x " Dx = DR + Dx ℓ + D xE
Mesure
indirecte :
On
a mesuré :
B
DB A avec une erreur DA
 B avec une erreur DB
B avec une erreur DBA
![]()
DA
Périmètre = 2
(A+B) = P
" DP = (PMAX – PMIN)/2
![]()
![]()
![]()
![]() 2 (A + DA + B + DB) – 2 (A – DA + B – DB)
2 (A + DA + B + DB) – 2 (A – DA + B – DB)
![]() =
=
2
= 2 (DA + DB) P0 =
P ± DP
Surface = A . B = S
" DS = (SMAX – SMIN)/2
(A + DA) . (B + DB) – (A – DA) . (B – DB)
![]() =
=
2
![]()
![]()
![]()
![]() A.B + A.DB + DA.B + DA.DB – A.B + A.DB + DA.B – DA.DB
A.B + A.DB + DA.B + DA.DB – A.B + A.DB + DA.B – DA.DB
![]() =
=
2
= A . DB + DA . B
SV = S ± DS
D f
d f
![]()
![]() f’(x) = =
f’(x) = =
D x (x " 0) d x
S = f ( a , b )
d S d S
![]()
![]() dS = .
da + . db
dS = .
da + . db
d a d b
= b
. da +
a . db
![]()
![]()
![]()
![]() dS dS
dS dS
![]()
![]() Þ DS = .
Da + . Db = b
. Da + a . Db
Þ DS = .
Da + . Db = b
. Da + a . Db
da db
Exemples
de fonction :
Soit une grandeur G
et 2 quantités mesurées a et b.
|
Relation : |
Dérivée : |
Incertitude : |
|
G = a + b |
dG = da + db |
DG =
Da
+ Db |
|
G = a – b |
dG = da – db |
DG =
Da
+ Db |
|
G = a . b |
dG =
a.db + b.da |
DG =
|a|.Db
+ |b|.Da |
|
G = a / b |
a.db – b.da
b2 |
|a|.Db + |b|.Da
b2 |
|
G = am |
dG = m.am–1 . da |
DG = |m.am–1| Da |
|
G = ea |
dG = ea . da |
DG = ea . Da |
|
G = ln( a ) |
dG =
da / a |
DG =
Da / a |
TP
émission a :
 Y
Y
yB
yA
xA xB X
L = √ ( X2 + Y2 ) X = xB – xA et Y =
yB – yA
Avec
les incertitudes : DxA, DxB, DyA, DyB.
L2 = X2 + Y2 que l’on dérive :
2L . dL = 2X . dX
+ 2Y . dY
dL = X/L
. dX + Y/L . dY
|X| |Y|
![]()
![]() DL =
. DX + . DY
DL =
. DX + . DY
L L
Mesure
d’une grandeur fixe : (rare)
![]()
![]()
![]() x
x
![]() x
x
x
![]()
![]()
![]() x
x
x
![]()
![]()
![]() x
x
Domaine de compatibilité
" Ça vaut le coût
de faire plusieurs mesures de la même grandeur.
Mais il n’est pas possible d’effectuer plusieurs fois la mesure d’une même grandeur dans un système dynamique !
Mesure
de 2 grandeurs :

Y
X
Comportement
linéaire :

![]()
" Soit la loi
n’est pas linéaire ; soit la dernière valeur n’est pas bonne.
Comptage
d’un phénomène géré par une probabilité :
Exemple : la probabilité
qu’un traitement donné a un effet donné sur une espèce donnée.
On
fait systématiquement une erreur statistique en ne prenant pas en compte
des fluctuations.
Nombre
de
lapins
morts

"
Distribution de Poisson
n lapins morts.
v Notion de relativité :
Soit
2 repères : R, le repère fixe
et R’, le repère mobile.
Et les vitesses : v, la vitesse de
quelqu’un qui marche à pied par rapport à R ;
v’, la vitesse
d’un train par rapport à R ;
V, la vitesse de
quelqu’un qui marche dans un train et dans le même sens de déplacement que ce
dernier par rapport à R.
 R R’
R R’
![]()
v
v’ v
V = v’ + v
0
![]() xB – xA Dx
xB – xA Dx
![]()
![]() v = =
v = =
tB – tA Dt
La
vitesse de la lumière :
Pendant
quelques millisecondes, on peut considérer que la Terre a un mouvement
rectiligne uniforme.
La mesure de la vitesse de la lumière dans R et R’ est la même
Travaux
d’Einstein :
![]()
![]() xA xB x’A x’B
xA xB x’A x’B
R R’
tA tB t’A t’B
xB – xA x’B – x’A
![]()
![]() v = v’ =
v = v’ =
tB – tA t’B – t’A
xB
– xA ¹
x’B
– x’A
Or : v = v’
Donc : tB
– tA ¹
t’B
– t’A
" Le temps n’est plus une grandeur absolue.
Cela
remet en cause toutes les théories incluant le temps.
m0
![]() m = m :
masse ; m0 : masse au
repos
m = m :
masse ; m0 : masse au
repos
√(1 – v2/c2)
10
ans après, les mathématiciens ont démontré que cette formule est la seule à
pouvoir expliquer ce phénomène.
![]()
![]()
![]() m0 . v
m0 . v
√(1 – v2/c2)
E0 = m0 . c2
m0 . c2
![]() ETotal
= ET = m.c2 = ET = E0 + EC
ETotal
= ET = m.c2 = ET = E0 + EC
√(1 – v2/c2) m0 . c2
![]() =
=
√(1 – v2/c2)
![]() m0 . c2
m0 . c2
![]() EC = – E0 = m0 . c2 (1 – v2/c2)–½ – 1
EC = – E0 = m0 . c2 (1 – v2/c2)–½ – 1
√(1 – v2/c2)
On
travaille régulièrement avec des vitesses largement inférieures à la vitesse de
la lumière :
(1+e)N = 1 + Ne + N(N–1) e2/2! + …
(1 – v2/c2)–½ = 1 – ½ . (– v2/c2) = 1 + ½(v2/c2)
EC = m0 . c2 . (v2/2c2) = ½
m0 . v2
" Il s’agit de la
forme classique de l’énergie cinétique.
Que
se passe–t–il si l’on travaille avec les électrons ?
m0 = 9,1 . 10–31 kg E0 = 9,1 . 10–31 . (3 . 108)2 = 8,9 . 10–14 J = 511 keV
Valeur de référence à connaître.
Calcul
de la vitesse d’un électron :
m0 . c2 E0
![]()
![]() ET = E0 + EC = =
ET = E0 + EC = =
√(1 – v2/c2) √(1 – v2/c2)
 E0 E0
2
E0 E0
2
![]()
![]() √(1 – v2/c2) = (1
– v2/c2) =
√(1 – v2/c2) = (1
– v2/c2) =
E0 + EC E0 + EC



E0 2 E0 E0
![]()
![]()
![]() (v2/c2) = 1 – =
1 + . 1 –
(v2/c2) = 1 – =
1 + . 1 –
E0 + EC E0 + EC E0 + EC
 ½
½
EC 2 .
E0 + EC
( v/c ) = .
E0 + EC E0 + EC
" Il
s’agit de la forme relativiste (= absolue) utilisable pour toutes les
particules.
Avec
la physique classique, on obtient :
Ec = ½
. m0 . v2 = ½
. m0 . c2
. (v2 /c2)
(v2
/c2) = 2.EC
/m0
( v/c
) =
√(2.EC /m0)
Pour
un électron à différentes énergies cinétiques :
|
EC |
( v/c)
classique |
( v/c)
relativiste |
Écart |
|
E0/100 =
5,11 keV |
0,141 |
0,140 |
0,7
% |
|
E0/10 =
51,1 keV |
|
0,416 |
|
|
E0 =
511 keV |
1,414 |
0,866 |
63 % |
Et
encore, on n’a pas pris de grandes énergies cinétiques ; dans une réaction
nucléaire, un électron peut avoir quelques MeV.
Déjà, via la méthode de la physique classique, la dernière valeur est délirante :
L’électron
serait 1,4 fois plus rapide que la lumière !? ...
E0 Si : v "
c,
![]() ET = E0 + EC = v/c
" 1,
ET = E0 + EC = v/c
" 1,
√(1 – v2/c2) v2/c2 " 1,
1 – (v2/c2) " 0,
√(1
– v2/c2) " 0,
E0 /√(1 – v2/c2) " ∞
Le
calcul relativiste est nécessaire pour une particule ayant une vitesse
supérieure à 0,1 c. Avant, l’approximation de la physique classique est admise.
E0
![]() ET =
ET =
√(1 – v2/c2)
E02
m0 . v
![]()
![]() ET2 = Impulsion
p =
ET2 = Impulsion
p =
(1 – v2/c2) √(1 – v2/c2)
m02 . v2 . c2 m02 . v2 . c2
![]()
![]() p2 . c2 = p2 . c2 + m02.c4 = + m02.c4
p2 . c2 = p2 . c2 + m02.c4 = + m02.c4
(1 – v2/c2)
(1 – v2/c2)
![]()
![]()
m02 . v2 . c2 + m02.c4 – m02.c4.v2/c2
![]() p2 . c2 + m02.c4 =
p2 . c2 + m02.c4 =
(1
– v2/c2)
m02.c4
![]() p2 . c2 + m02.c4 = = ET2
p2 . c2 + m02.c4 = = ET2
(1 – v2/c2)
![]()
ET = E0 + EC = √( p2 . c2 + m02.c4 ) " Expression
relativiste
Le
cas d’un photon :
m0 = 0 E0 = m0
. c2 = 0
?? Le photon n’aurait
pas d’énergie ? Si !!
ET =
E0 + EC = √( p2 . c2 + m02.c4 )
= √( p2 . c2 ) = p
. c
p = ET
/c
" Le photon
transporte de l’énergie et d’impulsion.
Calcul
des énergies au repos :
|
Particule : |
Masse : |
Énergie au
repos : E0 = m0 . c2 |
|
Électron |
9,1 . 10–31 kg |
511 keV |
|
Nucléon |
1 u.m.a = 1,66
. 10–27 kg |
931,5 MeV |
|
Proton |
1,00782 u.m.a |
938,272 MeV |
|
Neutron |
1,00866 u.m.a |
939,563 MeV |
m0 Électron » 1/2000 . m0 Nucléon
Þ E0 Électron » 1/2000 . E0 Nucléon
Explication
de E = m . c2 :
A A 0
Rayonnement b+ : X ® Y* + b+ + n
Z Z–1 +1
b+ : positron
= anti–électron
Ce
b+ est émis avec une certaine impulsion
dans la matière. Il y est freiné au point que sa vitesse devient nulle. Il va
être attiré par le premier électron qui passe (attraction de 2 charges électriques
opposées) Ils vont se regrouper en un point précis :

g1
g1
( b+ ; eˉ ) " émission de photons g.
Conservation
de l’énergie : E = 2 .
m0 . c2 = Eg1 + Eg2
L’impulsion d’entrée
= l’impulsion de sortie
![]()
![]()
![]()
![]() pE = pS pE = 0
pE = pS pE = 0
Ils sont à l’arrêt
![]()
![]()
![]()
![]() 0 = pS = p g1 + p g2
0 = pS = p g1 + p g2
![]()
![]() |p g1| + |p g2| = E g1 /c + E g2 /c
|p g1| + |p g2| = E g1 /c + E g2 /c
![]()
![]() E g1 = – E g2 (angle
à 180°)
E g1 = – E g2 (angle
à 180°)
E g1 = E g2 = m0 . c2 = 511
keV
Application : IM par émission g–g.
On
prend un noyau (ou atome) émetteur b+ que l’on insert
dans une molécule biologique et on l’intègre dans l’organisme.
On place le patient dans un cylindre (= ensemble de
détecteurs de g) appelé caméra
TEP.
Les
capteurs détectent les photons g0 à partir des g détectés à 180 ° et d’énergie
511 keV.
On
arrive à converger vers l’organe où la molécule s’est intégrée.



" Visualisation
de l’organe qui a fixé la molécule marquée.
Exemple
d’application sur le cerveau :
La maladie de Parkinson résulte de la perte de neurones dopaminergiques. Ces neurones sont caractérisés par la fixation de Fluor.
Lorsque
l’on effectue une greffe, on vérifie son évolution en injectant au patient du 18Fluor qui émet
des b+. Si, lors de
l’IRM, on observe des taches signifiant un rayonnement g, cela indique
que la greffe a pris.
En
demandant au patient de penser à des souvenirs datant de 10 ans, on voit
évoluer les tâches nous permettant de visualiser la ou les zones qui
travaillent.
v
Rayonnement
électromagnétique : Onde & corpuscule :
Ø Notion
d’ondes et de particule :
La
particule : Objet massique, localisé : x ;
y ; z ; t
![]() " de là, on peut
déterminer sa vitesse v : vX ; vY ;
vZ ; t
" de là, on peut
déterminer sa vitesse v : vX ; vY ;
vZ ; t
L’onde : Perturbation – Déformation – Vibration
Elle n’est pas localisable.
De ce fait, elle
est difficile à définir...
On travaillera
avec l’exemple le plus simple : le mouvement ondulatoire de la corde.
Ø Propriété
ondulatoire : la propagation :
Prenons
notre exemple : pour une corde que l’on fait onduler selon un mouvement sinusoïdal
entretenu, on peut définir par une fonction : Y( x, t )
=
a . sin( w.t
– k.x )

x
à un temps t.
(" photo)
Y(x,
t)
: Déformation,
w : Pulsation,
t : Date,
k. : Vecteur
d’onde,
x : Position.
§ Périodicité :
Périodicité
temporelle : Il existe un temps T tel que :
Y(
x, t+T ) =
Y(
x, t )
a . sin[
w.(t+T)
– k.x ]
=
a . sin(
w.t – k.x )

q’ ( q
+ q’ )
q
" sin( q + q’ ) ¹ sin( q )
+ sin( q’ )

" sin( q + 2π ) = sin ( q )
Û w.t
+ w.T – k.x =
w.t
– k.x + n.2π (à n tours près ;
pour faciliter l’équation,
Û w.t + w.T – k.x = w.t – k.x + 2π on
prend n = 1)
Û w.T =
2π Û T =
2π/w
Périodicité
spatiale :
![]()
 l
l
Il
existe une longueur l telle
que : Y( x+l, t ) =
Y(
x, t )
a . sin[
w.t – k.(x+l) ]
=
a . sin(
w.t – k.x )
Û w.t
– k.x – k.l =
w.t
– k.x + n.2π (à n tours près ;
pour faciliter l’équation,
Û w.t – k.x – k.l = w.t – k.x – 2π on
prend n = –1)
Û k.l = 2π Û l = 2π/k
= longueur d’onde
Y( x, t ) ; Y( x, t+dt )
x
– x+dx

Y(
x, t ) =
Y(
x+dx , t+dt )
a . sin(
w.t – k.x )
=
a . sin[
w.(t+dt)
– k.(x+dx)
]
Û w.t – k.x = w.t + w.dt
– k.x
– k.dx
Û w.dt = k.dx
Or,
la vitesse : v = dx
/dt = w/k
2π/T
![]() =
=
2π/l
= (2π/T) . (l/2π)
v = l/T Þ l = v .
T
et
avec la vitesse de la lumière :
l
= c . T
§ Interférence :
Écran
 Exemple :
Exemple :
S1 point P
Source
S2


" Interférence destructive " Interférence constructive
(il n’y
a pas de tache lumineuse au point P) (il
y a une tache lumineuse au point P)
La
nature des interférences dépend de la distance source – écran et du temps.
 l
2l Si :
S2 – S1
= n.l
l
2l Si :
S2 – S1
= n.l
" Interférence
constructive.
Si :
S2 – S1
= n.l + l/2
"
Interférence destructive.
l/2
§ Diffraction :
Écran

lumière par
Propagation rectiligne
![]()
Lumière par
diffraction
Ø
Propriété corpusculaire :
§ Démonstration par des
exemples :
·
Éclairage
de la roue à barreaux :
Soit
une roue aux frottements négligeables (roulement à bille) et bien équilibrée.
On
pose sur chaque barreau :
-
Une
feuille de papier noir (sur un coté)
-

![]() Et une feuille d’aluminium (sur l’autre
coté)
Et une feuille d’aluminium (sur l’autre
coté)


Quand
on allume la lampe, la roue se met en mouvement.
Cela
démontre qu’il y a transport de quantité de mouvement (impulsion et énergie)
·
La
cellule photoélectrique :

Intensité
A
Anode
Photons électrons
V +
ˉ
Cathode
Lorsque
l’on allume la lumière, on mesure une intensité électrique.
Les
photons qui frappent la cathode arrachent des électrons.
Cela
démontre un état corpusculaire des photons à une certaine énergie (à une
certaine longueur d’onde)
![]()
![]()
 Anode
Anode
F = q .
E
F
est la force créée E
F
par
le potentiel Électron
du
générateur.
Cathode
![]()
![]()
q est négatif, le champ électrique E est dans le sens opposé de la force F.
Si
le potentiel de la pile n’est pas assez puissant, alors le champ n’est pas
puissant. La probabilité que les électrons arrachés soient récupérés par
l’anode est, elle aussi, réduite. Les électrons peuvent être réabsorbés soit dans
la cathode, soit dans le gaz résiduel.
I

![]() I1
I1
 I2 < I1
I2 < I1
![]()
Lorsque
l’on utilise des filtres, limitant la lumière à certaines longueurs d’ondes, il
n’y a plus d’électricité.
E g = h . n Te = h . n – EL
= énergie cinétique des électrons
U0 =
Potentiel d’arrêt EL = Énergie de
liaison des électrons
q . U0 = h . n
– EL
Un
photon correspond à un quantum d’énergie :
E = h . n
= h . c / l
= 12397 eV.Å / l
(en Å)

Pour
un champ uniforme :
![]()
![]()
![]()
![]()
![]()
F = q .
E =
– dEP /dx . uX E
= – dV/dx . uX |E| = V/d
Si EPhoton < EL , il
n’y a pas d’électrons d’arrachés " Intensité est nulle.
Exemple :
l =
7 000 Å (par un filtre) " E g » 1,77 eV
" I = 0
Si
l
< 7 000 Å " I ¹ 0
Cellule
à vide :
 I
I
V
Cellule
à gaz :

![]()
![]() I
I
Quand
Te > ELiaison
moléculaire ,
![]()
il
y a une ionisation.
½ m . v2 = q .
V
V
Potentiel
d’ionisation
Dans
la matière, on rencontre des particules massives et chargées : les
électrons, les ions, les particules α, … et des particules neutres
massives : les neutron et non massives : les photons.
L’existence
de différentes particules induit l’existence de différentes interactions.
Les
particules chargées " Interaction
coulombienne avec les électrons.
Les
particules neutres :
Neutrons
" Interaction nucléaire (probabilité très
faible)
Photons " Interaction électromagnétique avec les électrons
mais non coulombienne.
v
Interactions
photon – matière :
Soit
un matériau d’une épaisseur e

N0 N(e) < N0
(absorption dans la matière)
dx
N(x) N(x
+ dx)
dN = N(x
+ dx) – N(x) (dN est négatif)
Soit
µ, la probabilité d’interaction d’un photon par unité
de longueur de matériau traversé :
dN = – µ . dx . N(x)
On
prend un dx tendant vers 0, permettant un calcul infinitésimal. On
obtient alors une équation différentielle du 1er ordre :
dN/dx + µ . N(x) = 0
dN/ N(x) = – µ . dx
" ∫ dN/ N(x) = ∫ – µ . dx
Ln (N) = – µ
. x
+ C
N =
exp(– µ . x + C)
N
= exp(C) . exp(– µ
.
x)
Détermination
de exp(C) :
Avec les conditions
initiales : N(0) = N0
N(0)
= exp(C) . exp(0)
N(0) =
exp(C)
Þ N(e) = N0 . exp(– µ . e)
![]()
![]()
 0 x1
x2
0 x1
x2
g
S Détecteur
N0
N(x1)
N(x2)
N( x1) = N0 . exp(– µ
. x1)
N( x2) = N0 . exp(– µ
. x2)
 Ln N
Ln N
Ln N( x1) = – µ
. x1 + Ln N0 pente = – µ
Ln N( x2) = – µ
. x2
+
Ln N0
x
Qu’est
– ce que µ ?
Il
s’agit du processus d’interaction des photons dans la matière.
3
Processus :
-
Effet
photo–électrique,
-
Effet
Compton,
-
Matérialisation
(= création de paires eˉ; e+)
Ø Effet
photo–électrique :
![]() Eg eˉ
Eg eˉ
![]()
 Te =
Eg – EL
Te =
Eg – EL
Il est dominant à basse énergie : Eg inférieur à 500 keV.
Il
s’agit d’un processus à seuil : Eg > EL

Probabilité
Couche L
Couche
K
Eg
De
plus, il y a une réorganisation du cortège électronique :

![]() Rayons X
Rayons X
ou
électron Auger
L K
Ø Effet
Compton :
Il
est dominant pour Eg » 1 MeV. On parle de diffusion :
Il
est basé sur la conservation de l’énergie et d’impulsion.
 g’ Eg’ ; Pg’
g’ Eg’ ; Pg’
q
Eg ; Pg E0
g eˉ j
Te ; E0 ;
Pe
eˉ
E0 = me . c2 Eg = Pg . c
Équation de la relativité : ETotale2
= Pe2 .
c2 +
E02.
![]()
![]() (E0 + T)2 = E02 + T2 + 2 W0
T " E02 + T2 + 2 E0T = Pe2 . c2 + E02
(E0 + T)2 = E02 + T2 + 2 W0
T " E02 + T2 + 2 E0T = Pe2 . c2 + E02
" Pe2 . c2 = T2 + 2 E0T
![]()
![]() Conservation de ETotale : Eg + E0 = Eg’ + E0 + Te Eg = Eg’ +
Te.
Conservation de ETotale : Eg + E0 = Eg’ + E0 + Te Eg = Eg’ +
Te.
Il s’agit de la conservation d’énergie
classique que l’on retrouve dans toute diffusion élastique.
![]()
![]()
![]()
![]()
Conservation de P : Pg = Pg’ + Pe
 Y
Y
![]()
Pg q
j
X
Projections
sur les axes : x : Pg = Pg’ . cosq
+ Pe . cosj
y : 0 = Pg’ . sinq
– Pe . sinj
Mais
on a plusieurs inconnues : Eg’ ; Te ; q ; j
" Eg’ est fonction
de Eg
et de q.
Pe2 = (Pg – Pg’.cosq)2 + (Pg’2 . sin2q)
= Pg 2 +
Pg’ 2.cos2q – 2.Pg.Pg’.cosq +
Pg’
2.sin 2q
Pe2 = Pg 2 + Pg’ 2
– 2.Pg.Pg’.cosq
Pe2 . c2 = Pg 2.
c2 + Pg’ 2.
c2
– 2 . Pg. c2 .
Pg’. c2 . cosq
Eg2 = Pg 2 . Pg’ 2
+ m02
. c4
Pour
un photon : Eg = Pg . c
Pour
un électron : Ee2 = Pe2 . c2 + m02
. c4
= (m0 . c2 + Te )2
= m02.c4 + Te2 + 2.Te.m0 . c2
Pe2 . c2 = Te . (Te + 2.m0.c2)
=
Pg
2. c2 + Pg’ 2. c2
– 2 . Pg.
c2 . Pg’. c2
. cosq
Te . (Te + 2.m0.c2) = Eg2 + Eg’2 – 2 . Eg2 . Eg’2 . cosq
= (Eg – Eg’) (Eg – Eg’ + 2.m0.c2)
= Eg2 – Eg.Eg’ + 2.Eg.m0.c2 – Eg.Eg’ + Eg’2
– 2.Eg’.m0.c2
– 2.Eg.Eg’.cosq = –2.Eg.Eg’ +
(Eg–Eg’).2.m0.c2
![]()
2.Eg.Eg’.(1–cosq) = (Eg–Eg’) . 2.m0.c2
![]()
1/(
m0.c2) . (1–cosq) = (Eg–Eg’) /(Eg.Eg’)
= (Eg) /(Eg.Eg’) – (Eg’) /(Eg.Eg’)
1/(
m0.c2) . (1–cosq) = 1/Eg’ – 1/Eg
![]() Si q
=
0 :
Si q
=
0 :
1/Eg’ – 1/Eg = 0 " Eg’ = Eg
Et comme : Eg = Eg’ + Te Alors : Te
= 0
![]() Si q
=
180 :
Si q
=
180 :
" Il s’agit d’un
cas limite.
1/Eg’ – 1/Eg = 2 /511 m0c2 = 511 keV (1–cosq) = 2
Et comme : Eg = Eg’ + Te Alors : Te
= Eg – Eg’
Exemple :
137Cs " E = 662 keV
Effet photo–électrique : E = EL + Te " E Transférée au milieu
Effet Compton : E Transférée à l’électron va de T=0 à TMAX
1/Eg’ – 1/662 = 2/511 " Eg’ = 185 keV Eg = Eg’ + Te
(" Max de
l’énergie transférée par le photon)
" TMAX = 478 keV
![]()
 Maximum
Maximum
Plateau Compton
![]() Effet
photo–électrique
Effet
photo–électrique
Effet
Compton
Énergie déposée
TMAX
Eg
1/Eg’ – 1/Eg = 1/( m0.c2) .
(1–cosq) = (1–cosq) /511
Cas
de Eg
très grand :
Eg >> 511
keV
1/Eg << 1/511 Donc : 1/Eg’ » (1–cosq)/511
Eg’ » 511 keV
" Te = Eg – Eg’ » Eg
Par effet Compton, si l’énergie du photon est grande, ce photon transmet une grande énergie Te @ Eg dans la matière.
Cas
de Eg
très petit :
Eg << 511
keV
1/Eg >> 1/511 Donc : 1/Eg’
» 1/Eg
" Eg’ » Eg
Si Eg <<
511 keV, Alors, il y a
diffusion :
Eg’ @ Eg
![]()
L’électron
a une énergie bien supérieure à celle du photon. Il ne bouge pas (ou peu) lors
du choc et le photon est diffusé.
Ø Matérialisation
:
La
masse peut être transformée en énergie. Le sens inverse est aussi possible. On
suppose que c’est ce qui s’est passé lors du Big–Bang.
 e +
e +
Énergie E
e ˉ
E = meˉ . c2 + me+ . c2 + Teˉ + Te+
=
2 me . c2 + Teˉ + Te+ E > 2 me . c2
=
1,022 MeV
Cet
effet est dit « à seuil » : il faut au minimum d’ 1,022 MeV
d’énergie
Photons :
Eg1 Eg2
 (
e + ; eˉ de la matière)
(
e + ; eˉ de la matière)
e + Ralentissement
Énergie E
e ˉ
EDétectée = Teˉ + Te+
= E
– 2 . 511 keV
N
(ED) = N fois que
l’on
 détecte telle
énergie
détecte telle
énergie
Aucun
photon perdu *
1 photon perdu *
2
photons perdus *
![]() 511 keV
511 keV
2
. 511 keV
![]()
EDétectée
* : dans le
détecteur.
Ø Réaction
nucléaire :
Il
s’agit d’interactions photon – noyau mais elles sont marginales (rares)
Photon g + ( A ; Z ) Þ Neutron n + (
A –1 ; Z )
Par
exemple :
les atomes de Carbone et
d’Oxygène :
Photon g +
Photon g + 168O Þ Neutron n + 158O

![]()
![]()
![]()
![]()
![]()
N0 x N(x) = N0 . exp(–µ.x)
µ = µPE : la probabilité d’interaction par effet
photo–électrique,
+ µC : la probabilité d’interaction par effet
Compton,
+ µMat : la probabilité d’interaction par
matérialisation,
+ µNucl : la probabilité d’interaction nucléaire
(négligeable)
Ø Évolution
des probabilités :
§ Évolution de la probabilité
d’interaction par effet Compton :
Les
interactions par effet Compton (et donc leur probabilité) augmentent avec la
densité du matériau.
On
rappelle qu’il s’agit de réactions avec les électrons de la matière et que la
densité augmente avec le nombre d’atomes dans le matériau.
La probabilité d’interactions par effet Compton diminue quand l’énergie augmente.
µC est
proportionnelle à 1/E
§ Évolution de la probabilité
d’interaction par effet photo–électrique :
Les
interactions par effet photo–électrique (et donc leur probabilité) dépendent de
la densité du matériau, de l’énergie et de la charge Z des éléments.
On
rappelle qu’il s’agit de réactions avec les électrons de la matière et que la
densité augmente avec le nombre d’atomes dans le matériau.
La probabilité d’interactions par effet photo–électrique diminue quand l’énergie augmente.
Densité . (charge Z des éléments) ^3
![]() µEP est
proportionnelle à
µEP est
proportionnelle à
Énergie E ^2
C'est–à–dire :
-
µEP & avec & de la densité,
-
µEP &&& avec & de la charge Z
des éléments,
-
µEP (( avec & de l’énergie,
§ Évolution de la probabilité
d’interaction par matérialisation :
Il
s’agit d’interactions à effet seuil : leur probabilité est nulle pour une
énergie inférieure ou égale à 1,022 MeV.
La probabilité d’interaction par
matérialisation augmente avec l’énergie, avec la charge Z des éléments et avec
la densité.
§ La courbe d’évolution est
pour un matériau donné (charge et densité données) :
µ

PE
M
C
E
511 keV 1,022
MeV
-
À basse énergie, bien inférieure
à 511 keV :
"
Il y a une dominance de l’effet photo–électrique. et non une exclusivité !
-
À moyenne énergie, aux alentours
de 511 keV :
"
Il y a une dominance de l’effet Compton.
-
À haute énergie, supérieure à
1,022 MeV :
"
Il y a une dominance de la matérialisation.
Pour un matériau, on détermine sa
densité, et son épaisseur moitié. Elle est l’épaisseur pour laquelle N0
est diminué de moitié et on la calcule par : log(2) /µ
.
v
Interactions
particules chargées – matière :
-
Électrons (les plus importants
car ils sont mis en mouvement à chaque fois qu’il y a une interaction avec des
photons)
-
Protons,
-
Les particules alpha,
-
Les ions lourds.
Ø Interactions
électrons – matière :
§ Collision :
Il s’agit d’une interaction coulombienne
entre un électron « projectile » (en mouvement) et un électron
« cible » (de la matière)

T ;
P
1 e2
![]()
![]() F = .
F = .
4. π . e0
d²
 Cette
interaction est répétée avec d’autres atomes et leur cortège électronique
jusqu’au ralentissement et l’arrêt de l’électron projectile.
Cette
interaction est répétée avec d’autres atomes et leur cortège électronique
jusqu’au ralentissement et l’arrêt de l’électron projectile.
b
Le
paramètre b correspond à la distance des 2
particules s’il n’y avait pas de déviation.
Des
échanges d’énergie y sont associés (dans les cas limites) :
|
b : |
0 |
¥ |
|
DT : |
troponine |
0 |
|
Probabilité : |
0 |
¥ |
Toute l’énergie est transférée de l’électron projectile à l’électron cible. L’électron projectile est juste en face de l’électron (assimilable au carreau dans la pétanque)
La probabilité est importante de croiser un électron à une grande distance dans la matière.
Les
échanges sont plus souvent de faible quantité d’énergie avec parfois un échange
de forte quantité.
·
Le
pouvoir d’arrêt par collision :
Il
est noté SC et exprimé en
MeV.cm–1. Il signifie la perte d’énergie
par cm de matière traversée.
SC /r (densité) en (MeV.cm–1)/(g. cm–3) = en MeV.cm+2. g–1
SC dépend du
matériau (ce qui est évident puisqu’il dépend de la densité d’électrons
dans la matière) et de l’énergie cinétique T des électrons projectiles.

Pendant tout ce temps, il y a un échange d’énergie.
Si
l’énergie cinétique T de l’électron projectile augmente, alors sa vitesse
augmente. Donc ce dernier « voit » (= interagit) moins longtemps avec
l’électron cible, et donc il y a moins d’énergie transférée.
Exemple
de l’eau :
SC

2Mev.cm–1
T
300 keV 1MeV 10 MeV
À
partir de 300 keV d’énergie cinétique, il n’y a plus que 2MeV de transférés par
cm.
§ Freinage :
Il s’agit d’une interaction entre un
électron « projectile » (en mouvement) et un noyau de la matière.
C’est un phénomène plus rare mais inévitable.
 T ; P
T ; P
Photons X de
freinage
Noyau (chargé positif)
T’ ;
P’
Le
transfert d’énergie au noyau : DT = T –
T’
L’énergie
perdue par l’électron ne peut être transmise au noyau qui est trop gros pour
être déplacé par gain d’énergie cinétique (sa masse est 2 000 fois plus
importante que celle de l’électron)
Une
perte d’énergie se fait sous forme de rayonnement de freinage.
·
Le
pouvoir d’arrêt par freinage :
Il
est noté SR = DT/Dx , exprimé en
MeV.cm–1.
SR /r (densité) en
MeV.cm+2. g–1
S

SC
SR
2Mev.cm–1
T
![]() 0,3 MeV 1MeV
10 MeV
0,3 MeV 1MeV
10 MeV
La collision est le phénomène le plus importante pour une énergie moyenne et un matériau léger.
(énergie
très importante pour un électron)
Application :
En
radiothérapie, on utilisait (et on utilise encore dans certains cas) le Cobalt
60 qui émet des photons gammas de 1,17 et 1,33 MeV.
Maintenant,
on utilise des photons X de 15 à 25 MeV.
On
les fabrique à l’aide d’un accélérateur d’électrons à haute énergie par
attirance de ces électrons vers une anode portée à un potentiel de 30 . 106 Volts (= 30 MV)
L’avantage
est qu’avec 2 boutons on règle l’énergie et la quantité des photons.


Anode
anti–cathode
Freinage
Électrons
T = 30 MeV Photons X
Patient
Quand
il s’agit de tissus biologiques, on peut les assimiler à de l’eau.

NX
EX
30
Le
seuil d’énergie transférée par collision est de 2 MeV.cm–1. Le freinage
(interaction avec un noyau) est peu important en dessous de quelques MeV ;
mais il devient important avec une grande énergie et des matériaux lourds.
§ Notion de dégâts occasionnés
:
On
évalue le nombre d’ionisations et d’excitations.
L’énergie
moyenne nécessaire pour ionisation (= arracher un électron) d’une molécule est
de 16 eV. Mais il y a aussi un changement d’énergie des électrons (=
excitation) et des effets thermiques qui consomment aussi 16 eV.
Il
faut réellement donc 32 eV, en moyenne, pour ioniser une molécule d’eau.
2
MeV.cm–1
= DT/Dx = 2 000 000 eV.cm–1 perdus
=
200 000 eV.mm–1 perdus
Nombre
d’ionisations par millimètre de tissus traversé = 200 000 / 32 = 6 250
Si
l’on compare ce nombre avec le nombre total de molécule d’eau dans
§ Parcours des électrons dans
la matière :
Pour
des électrons dont l’énergie cinétique T est supérieure à 300 KeV, le pouvoir d’arrêt
par collision est de 2 MeV.cm–1.
" Quelle est l’épaisseur d’enfoncement (de pénétration) des électrons dans la matière ?
Dx = DT
/ SC
Soit la
distance parcourue par les électrons dans la matière : R (Range)
» DT
/
SC
Et
pour un arrêt total : DT = T R
= T / SC

Pas
réellement un plateau,
 " Une légère
pente mais cette surévaluation
" Une légère
pente mais cette surévaluation
est
pratique en terme de sécurité.
|
Énergie de
l’électron T : |
2 MeV |
5 MeV |
10 MeV |
|
Parcours pour
un arrêt total dans l’eau : |
|
|
|
C’est
un peu moins : ce sont des ordres de grandeur, mais on reste encore
raisonnable dans les arrondis. Voilà des valeurs plus détaillées :
|
Matériau |
Énergie (en MeV) |
DT/Dx
collision (en
10–3
MeV.cm–1) |
DT/Dx freinage (en
MeV.cm–1) |
Parcours R |
|
Aluminium r = |
0,5 |
1,58 |
1,83 . 10–5 |
|
|
5 |
1,66 |
1,29 . 10–4 |
|
|
|
10 |
1,638 |
2,82 . 10–4 |
|
|
|
Air r = 1,29 mg.cm–1 |
1 |
1,657 |
1,76 . 10–5 |
|
|
5 |
1,83 |
8,12 . 10–5 |
|
|
|
10 |
1,97 |
1,78 . 10–4 |
|
|
|
Eau r = |
1 |
18,7 |
1,76 . 10–5 |
|
|
5 |
19,4 |
8,20 . 10–5 |
|
|
|
10 |
20,3 |
1,80 . 10–4 |
|
Ø Interactions
des autres particules chargées avec la matière :
Dans
tous les cas, il y a une force de frottement.
Pour
la collision, il y a une force de Coulomb :
1
Z1 . Z
2
. e2
![]()
![]() FE = .
FE = .
4. π
. e0
d²
Z :
la charge de la particule incidente (= projectile)
Pour
un électron :
1 e2
![]()
![]() FE = .
FE = .
4. π
. e0
d²
Pour
une particule a ou un
ion :
1
Z . e2
![]()
![]() FE = .
FE = .
4. π
. e0
d²
Pour
expliquer les pertes d’énergie, on utilise la formule de Bethe :
Force
de frottement :
 4. π
. z2 . e2 2 . me . v²
4. π
. z2 . e2 2 . me . v²
![]()
![]() – dE/dx =
. n* . Z Ln – Ln (1 – b2) – b2
– dE/dx =
. n* . Z Ln – Ln (1 – b2) – b2
me . v² I
b
= v/c :
vitesse de la particule,
z :
charge de la particule incidente,
n* : noyaux d’atomes cibles par unité de volume,
Z :
charge des atomes cibles,
I :
potentiel de ionisation.
Cette
force de frottement va varier selon z2/v2. De toute
apparence, il n’y a pas de variation selon la masse. Donc on aperçoit un
parcours à peu près identique pour un électron que pour un proton.
À peu près, mais
pas réellement...
" On sait que la
vitesse a une influence et qu’elle est en relation avec l’énergie transférée et
donc avec la masse.
Quelques
chiffres :
|
Particules : |
Énergie (en MeV) |
Vitesse (en cm.s–1) |
Parcours R (en
µm) |
||
|
Dans l’eau |
Dans l’air |
Dans l’eau |
Dans l’air |
||
|
Électron |
10–2 |
5,8 |
|
2,15 |
|
|
1 |
28,23 |
28,23 |
4 300 |
3,8 .106 |
|
|
5 |
29,87 |
29,87 |
25 00 |
21,9 . 106 |
|
|
10 |
29,96 |
29,96 |
48 00 (~ |
40 . 106 |
|
|
Proton |
1 |
|
|
|
|
|
5 |
3,1 |
350 |
|||
|
10 |
4,39 |
1 220 |
|||
|
Particule a |
1 |
0,69 |
0,69 |
6,8 |
6,9 . 103 |
|
5 |
|
1,55 |
|
34 . 103 |
|
|
10 |
2,19 |
2,19 |
103,3
(~ |
102
. 103 (~ |
|
Pour des vitesses similaires, on obtient des parcours comparables.
Pourtant, la charge d’un proton est z=1 et celle d’une particule a
est z=2 ; mais il y a une
compensation du fait que la masse du proton est moins importante que celle de
la particule a.
À
Et
les rayons g
sont bien plus nocifs. On se trouve dans la même situation avec les électrons
de 5 MeV.
 Électrons
Électrons
cm
4 MeV 2 MeV 1
MeV
Plus ils traversent des tissus, plus ils
déposent de l’énergie car SC > 2 MeV
quand Te < 300 keV

 dE des électrons dE/dx
dE des électrons dE/dx
2
MeV
x E
Ø Interactions
des neutrons avec la matière :
Ce
sont des particules particulières : elles sont non chargées, mais elles
ont une masse. Elles sont régies par une probabilité d’interaction (parce
qu’elles sont neutres)
Il
y a 2 modes d’interaction : la collision (ou diffusion) et la capture des
neutrons par des noyaux (la radioprotection se fait en 2 étapes : les
neutrons sont ralentis puis capturés)
§ Collision et
ralentissement :
Il
s’agit d’interaction entre des neutrons et les noyaux de la matière. Il y a
transmission d’énergie du neutron au noyau :

Quel
est le matériau le plus efficace ?
" l’Hydrogène.
Un
neutron de 2 MeV va transmettre toute son énergie avec :
-
19
collisions dans de l’Hydrogène,
-
519
collisions dans du Fer.
§ Capture :
6 7
n + Li " Li 3 3
|
1
10 4 7
n + B " a + Li0
5 2
3
|
113 114
n
+ Cd " Cd
+ g
|
158 159
n + Gd " Gd + g |
Pour
les particules chargées :
Il
y a des interactions directes avec une pénétration donnée dans le matériau et
on parle de parcours pour exprimer
la profondeur traversée (toutes les particules sont arrêtées à une distance
précise, le parcours)
Pour
les particules neutres et les photons :
Il
y a des interactions indirectes avec une traversée du matériau et on parle d’atténuation
du faisceau qui est due à une probabilité d’interaction des particules dans
le matériau.
Elle
est caractérisée par une épaisseur moitié (où le faisceau a été atténué d’un
facteur 2)
Atténuation
du faisceau :
Soit
un matériau d’une épaisseur e

N(x) N(x + dx)
N0 N(e)
dx
Soit
µ, la probabilité d’interaction d’un photon par
l’unité de longueur :
dN /N(x) = – µ . dx
N(x)
= N0 . exp(– µ
.
x)
N( x½
) = N0 / 2 x½
= Ln( 2 )/ µ
Le
générateur de rayons (= photons) X :
C’est
un accélérateur d’électrons qui vont interagir avec les noyaux de l’anode (=
freinage)
Il
présente un rendement du photon inférieur à 1 % de l’énergie fournie.
v
Grandeurs
et unités utilisées en radioprotection :
L’objectif
de la radioprotection est l’évaluation quantitative des risques pris devant une
source radioactive.
Autrement
dit : J Que
représentent ces différentes unités ?
Qu’est–ce que c’est que ces bêtes là ?
Il
y a un problème d’unités : rem,
rad, sievert…
" La traduction
en MKSA est incontournable.
Ø Grandeurs
liées à la source :
§ Nombre de particules ou de
photons :
-
Si
la source de rayonnement est un générateur de rayons X, alors il est plus
intéressant de connaître le nombre de photons X produits. Ce nombre est donné
par les caractéristiques de la machine (paramètres contrôlables et
contrôlés : le courant, la tension et le filtre)
-
Si
la source est radioactive, il est plus intéressant de connaître l’activité (=
le nombre de désintégrations par seconde) de cette source.
N(t)
= N0 . exp(– l . t)
N(t) :
le nombre de noyaux radioactifs,
l : la
probabilité de désintégration
Et
on a comme paramètre le temps, car le rayonnement d’une source n’est pas
constant (pas linéaire) dans le temps.
Une
désintégration correspond à l’émission d’éléments : a, b ou g.
A(t)
= A0 . exp(– l . t)
Pour
un noyau donné, on connaît le nombre de désintégrations (relation entre N et A)
[A] = Becquerel
(Bq) = 1 désintégration par seconde
= Curie (Ci) = 3,7 . 1010 désintégrations
par seconde = 3,7 . 1010 Bq
(échelle
plus pratique)
On
définit aussi la période T½ qui correspond
au temps au bout duquel la moitié des noyaux se sont désintégrés.
T½ =
Ln(2) /l
§ Énergie des
rayonnements :
En
MKSA, l’énergie s’exprime en Joules ; mais on utilise une autre
échelle : l’électronvolt (eV, keV, MeV voire GeV)
1 eV = 1,6 . 10–19 Joules

Source Cible
On
prend en compte le flux : f
= dN/dS
= Fluence de particule (ou fluence particulaire)
= Nombre de
particules par unité de surface.
On
prend aussi en compte le temps et on obtient :
Le débit de flux : f°
= df/dt =
d2N/(dS.dt)
= Nombre de particules par unité de surface et par unité de temps.
Fluence
énergétique :
F = dE/dS = Énergie par unité de surface.
Débit
de flux énergétique : F°
= dF/dt =
d2E/(dS.dt)
= Énergie par unité de surface et par unité de temps.
Ø Grandeurs
liées au milieu irradié :
§ Notion de dose :
On
peut lire sur un médicament : « Ne pas dépasser la dose
prescrite »
Définition
médicale et pharmaceutique : La quantité « dose » est
la quantité d’un agent chimique qui produit un effet donné.
La
quantité prise au–delà de cette dose peut produire des effets secondaires
indésirables. La dose est définie en fonction de l’âge (ce qui cache en réalité
la masse de l’individu)
Pour
le rayonnement :
La dose est la quantité d’énergie déposée (qui a un effet ionisant) par unité
de masse. Elle est exprimée en Joules.kg–1 qui
correspondent à des Grays, Gy (unité MKSA) Mais
on utilise aussi les rads : 1 rad =
10–2 Gy
D = EDéposée / Masse
" Comment fait–on
pour définir les doses ?
On
a commencé à les définir par l’observation des effet immédiatement mesurables.
Par
exemple :
on administre différentes quantités de poison et on observe les effets.
Quand l’individu
commence à vaciller et claque,
c’est que l’on a
dépassé la dose vitale… L
Dans
ce sens, un médicament est un poison : tout est une question de dosage.
Pour
le rayonnement,
les premières manifestations observées sont des rougeurs sur la peau.
" Pour une source
donnée et une quantité donnée, à partir de quand a–t–on un début de
rougeur ?
Puis
on compare différents rayonnements sur les tissus biologiques avec d’autres
sources.
" Comment fait–on
pour quantifier les doses ?
La
dose absorbée : D = dE/dM " il y a un
problème pour calculer :
 Milieu
Milieu
Élément du
milieu de masse dM
a
b
g
dE
= EE – ES
EE :
énergie entrante ES :
énergie sortante
D
= (EE – ES)/dM
… la matérialisation !
Eg = Teˉ + Te
+ + 2m0.c2 =
1,022 MeV
Cette
énergie ne fait pas de dégât : la fabrication de masse n’est pas nuisible
et ne doit donc pas être prise en compte.
D = dE / dM
= (EE – ES – EM)/dM
dE est l’énergie déposée dans le milieu qui va arracher des électrons.
dM
ne peut pas être infiniment petite car la probabilité d’interaction serait trop
faible.
Elle
ne peut non plus être infiniment grande car la dose moyenne n’aurait plus de
sens.
Application
numérique :
Un
milieu de masse
-
Nombre
de photons à l’entrée : 1,332 . 109 photons pour
chaque énergie.
-
Nombre
de photons à la sortie : 20 % de ces photons et 9,6 . 108 photons
d’énergies différentes moyennées à 0,5 MeV.
Quelle
est la dose absorbée par ce milieu ? "
3,5 . 10–3
Gray
§ Équivalent de dose :
Or :
les particules a ne pénètrent que quelques
µm d’eau,
les
électrons ne pénètrent que quelques mm d’eau,
et
la même énergie y est déposée (pour 1 MeV d’incidence)
Donc que
ce soit une irradiation de particules a ou d’électrons,
il y a le même dégât…
…
le même dégât, oui, mais pas la même densité de dégât.
À
même dépôt d’énergie, cette densité de dégâts est plus grande avec un parcours
court qu’avec un parcours long.
Parcours Ion lourds < Parcours Particules a < Parcours Électron
Notre
gros problème du moment : l’ADN

Des
liaisons sont cassées à cause du départ de l’électron responsable de la
liaison. Une seule cassure n’est pas importantet car l’ADN présente un système
de réparation.
Mais
ce système a une faille : la réparation se fait par rapport à ce qu’il y a
à coté ; donc si, à coté, il y a une faille, la réparation est mauvaise.
La
gravité des dégâts est relative à la quantité de ces dégâts sur une petite
zone.
Elle
est caractérisée par une dose efficace : H = D . Q exprimé
en Sievert (Sv)
Q :
facteur de qualité sans unité.
Elle
correspond à l’intégration de la gravité des dégâts.
Le
Sievert est l’unité MKSA, mais on utilise encore le rem. On retrouve la même
correspondance entre le Sievert et le rem qu’entre le Gray et le rad :
1 Sievert = 100 rem
1 Gray = 100
rad
La
valeur du facteur de qualité Q est en lien avec le transfert linéique d’énergie
(TEL) exprimé en MeV.cm EAU
–1
:
|
Particules |
Facteur de
qualité Q |
TEL en MeV.cm
EAU –1 |
|
Photons X et g |
1 |
|
|
Électrons
d’énergie supérieure à 300 keV |
1 |
2 |
|
Électrons
d’énergie supérieure à 30 keV |
1 |
2,5 |
|
Électrons
d’énergie inférieure à 300 keV |
1,7 |
5,7 |
|
Neutrons lents |
3 |
12 |
|
Neutrons
rapides |
10 |
53 |
|
Protons |
10 |
53 |
|
Particules a |
20 |
175 |
|
Ions lourds |
20 |
175 |
Plus
le facteur de qualité Q augmente, plus le transfert d’énergie augmente aussi
(mais ce n’est pas linéaire pour autant)
Ø Synthèse :
|
Grandeur |
Symbole |
Unité SI |
Unité pratique |
Correspondance |
|
Activité |
A |
Becquerel (Bq) |
Curie (Ci) |
1 Ci = 3,7 .
1010 Bq |
|
Fluence |
f |
Particules.m–2 |
Particules.cm–2 |
1 cm2 = |
|
Débit de
fluence |
f° |
Particules.m–2.s–1 |
Particules.cm–2.s–1 |
– |
|
Énergie |
E |
Joules ( J ) |
MeV ou eV |
1 MeV = 1,6 .
10–13 J |
|
Dose absorbée |
D |
Gray (Gy) |
Rad |
1 Gy = 100 Rad |
|
Débit de dose |
D° |
Gy.s–1 |
Rad.h–1 |
1 Gy.s–1 = 36 .104 Rad.h–1 |
|
Équivalent de
dose |
H |
Sievert (Sv) |
Rem |
1 Sv = 100 Rem |
|
Débit
d’équivalence de dose |
H° |
Sv.s–1 |
Rem.h–1 |
1 Sv.s–1 = 36 .104 Rem.h–1 |
v
Calcul
de dose :
Ø Particules
indirectement ionisantes (photons et neutrons) :
§ Les photons :
N(x)
= N0 . exp–m
x
Nombre
d’interactions : NI = N(x)
– N0
= N0 . (1 – exp–m
x)
On
calcule la dose maximale en considérant de façon excessive que tous les
photons, qui ont interagi, ont déposé toute leur énergie.
C’est vrai pour l’effet photoélectrique
mais pas forcément pour l’effet Compton et la matérialisation...
DMax = EMax/M
DMax = NI . E /M mais : DRéel < DMax
Dans
l’expression de D, on va retrouver :
-
µEN (cm–1),
-
E
(MeV),
-
f (cm–2)
" MeV.cm–3 Or la dose est en MeV.g–1,
il faut la densité r (g..cm–3)
µEN . E . f
![]() D
= Mais les
unités ne sont pas dans le Système International.
D
= Mais les
unités ne sont pas dans le Système International.
r
Il
faut une conversion :

µEN (cm–1) . E (en MeV) .
f (cm–2)
![]() D
= 1,6 . 10–10 .
D
= 1,6 . 10–10 .
r (g.cm–3)
On
simplifie la formule :
-
Pour
un tissu biologique : on prend r = rEAU = 1 (au lieu de
0,98) Ça va...
-
Pour
tout photon dont l’énergie est supérieure à 60 keV (donc quasiment tous) :
on
prend µEN = 3 . 10–2 cm–1
-
f = nombre de
photons . cm–2 n’est pas connu, par contre on
connaît l’activité de la source (en Becquerel ou en Curie) : A = nombre de
photons . s–1
f° = A /(4 . π . R2) en nombre de photons . m–2 . s–1
![]()
![]() 3 . 10–2 . E (MeV) . A (Ci) . 3,7 . 1010
3 . 10–2 . E (MeV) . A (Ci) . 3,7 . 1010
![]() D°
= 3600 . 1,6 . 10–10 .
D°
= 3600 . 1,6 . 10–10 .
![]() (Gy.h–1) 1 . 4
. π . R2 (m2)
(Gy.h–1) 1 . 4
. π . R2 (m2)
Activité par
heure

![]() E (MeV) . A (Ci) . P
E (MeV) . A (Ci) . P
![]() D = 0,54 . 1
Gy = 100 Rad
D = 0,54 . 1
Gy = 100 Rad
(Rad.h–1) R2 (m2)
" Il est plus
simple de diviser par 2 que multiplier par 54…
Avec
l’activité, ce que l’on vient de calculer est le nombre de désintégration
subies par une source.
Mais…
 Toutes les
désintégrations n’émettent pas des photons :
Toutes les
désintégrations n’émettent pas des photons :
94,6 %
bˉ
5,4 %
Ba*
g eˉ
89
% 11 %
P
= 0,946 . 0,89 = 0,81
Pour
100 désintégrations, il y a 81 photons g.
P est le rapport d’embranchement.
Les
radiations subies lors des TPs :
On utilise une source 137Cs d’activité A0 = 5 µCi achetée
en 2000 et ayant une demi vie de 30 ans.
L’activité
A en 2005 = A0 . e–l.t = A0 . e–
( Ln2.t )/ t½ = 4 µCi
À une distance de
= 10–6 Rad.h–1
= 10–2 µGy.h–1
À une distance de
Lors du TP, on est en moyenne à

La
référence en terme de radioprotection :
Pour
les professionnels les plus exposés, la dose maximale annuelle est de 20 mSv par
an.
Si
on ramène cette dose annuelle à l’heure de travail (on en considérait 2000
avant les 35 heures), on arrive à une dose horaire de 25 µSv . h–1 soit 25 µGy
. h–1.
Alors, avec
notre pauvre petit 3 . 10–2 µGy . h–1…

… On
rigole !
Exemple : le Cobalt
Il y a une descente en cascade et différentes possibilités de désintégrations avec des photons d’énergies différentes.

Co
Ni
Il
y a une « voie » principale de désintégration proche de 100 %. Les
autres sont de l’ordre de 0,00…% et sont donc négligeables.
![]() Dg = (0,54 . A . E1 . P1) + (0,54 . A .
E2 . P2) / d2
E1 = 1,17 MeV E2 = 1,33 MeV
Dg = (0,54 . A . E1 . P1) + (0,54 . A .
E2 . P2) / d2
E1 = 1,17 MeV E2 = 1,33 MeV
Mais comme P1 ~ P2 ~ 100 %
![]() Dg
= (0,54 . A . (E1 + E2) / d2
Dg
= (0,54 . A . (E1 + E2) / d2
Il
existe différentes façons de calculer les doses dont l’utilisation de courbes
appelées abaques.
Ces
abaques ont pour abscisse l’énergie des particules émises, et pour ordonnée
soit une dose, soit un équivalent de dose.
Autre
cas :
P1
![]()
![]() P2 B*
P2 B*
g1 ; E1
g2 ; E2
D(g1) + D(g2) Rien ne change car l’activité A
correspond à celle des noyaux de départ.
= (0,54 . A . E1 . P1) + (0,54 . A .
E2 . P2) / d2
§ Les neutrons :
Ce
que l’on vient de dire est applicable pour les neutrons à une adaptation
près :
N(x) = N0 . e–m
x
= N0 . e–n*
r
x ( m = n* . s )
On
observe un plateau de 1 MeV à 100 MeV.
" 7 neutrons par
cm2 et par seconde correspondent à 1
milli rem par heure.
Ø Particules
chargées :
Ces
interactions sont toujours présentes car il s’agit d’interactions avec les
électrons de la matière.
Elles
correspondent à une perte d’énergie dans la matière de ces particules
caractérisées par le pouvoir d’arrêt d’une seule particule par unité de
longueur.
Pour
une dose, il va y avoir :
-
Le
pouvoir d’arrêt d’une particule en MeV.cm–1,
-
Le
flux : le nombre de particules envoyées par la source en cm–2,
-
La
masse volumique du matériau en g.cm–2.
(MeV.g–1)
D = f . S / r
(Joules.kg–1)
D = 1,6 . 10–10 . f . S / r
Ici,
le problème qui se pose est de connaître le S (pouvoir d’arrêt)
Formule
pratique pour les électrons d’énergie supérieure à 300 keV et pour une
distance de
Pour
cette formule, on se limite aux électrons : il n’est pas possible de
mettre toutes les particules dans le même panier.
Le
pouvoir d’arrêt, S, est égal à 2 MeV.cm–1 (pour l’eau : r = 1g.cm–1 )
pour une énergie incidente entre 300 keV jusqu’à
de très grandes énergies.
D = 1,6 . 10–10 . f . S / r
(Gray) Avec : r = A / (4 . p . d2)
 Débit
de dose à
Débit
de dose à
(rad.h–1)
Soit
on utilise ce calcul, soit on utilise une abaque.
Pour
toutes les autres particules chargées, notamment les particules a, on doit
utiliser la formule classique.
Mais
cela ne pose pas trop de problème car, en général, ces particules sont stoppées
dans l’air. Un risque n’est présent que si on est en contact direct de la
source.
v
Les
normes fondamentales :
Ø Historique :
Très
tôt après la découverte de ces rayonnements, il y eu la création d’un comité
international ayant pour mission de formuler des recommandations sur la
protection (1950)
En
1950, ce comité devient le CIPR (Commission Internationale de Protection
Radiologique)
Son
rôle est de protéger les individus exposés, pas par le biais de lois à cause de
son caractère international, mais par le biais de recommandations sur
l’observation des personnels directement exposés
(chercheurs,
médecins, armée, les populations d’Hiroshima et de Nagasaki, l’exposition
naturelle de faibles doses, les animaux de laboratoire, etc.)
Ø Principe :
 Le but est la
protection des individus, leur descendance et plus globalement le genre humain.
Le but est la
protection des individus, leur descendance et plus globalement le genre humain.
Ø Moyens :
-
On
réclame une justification de l’utilisation de radioéléments pour le personnel.
C’est déjà un peu plus délicat pour la médecine avec les techniques de
traitement et de diagnostics.
-
Exemple :
Le TEP consiste en une injection d’émetteurs b+. Il faut
justifier son utilisation et savoir si une autre technique n’aurait pas pu la remplacer
comme l’échographie, la Résonance Magnétique Nucléaire
(mais,
pour la RMN, il n’y a pas beaucoup d’appareil en France donc on soumet des
patients à des rayonnements alors que l’on pourrait parfois faire autrement)
-
On
optimise la radioprotection. Si on soumet quelqu’un à un rayonnement, il faut
qu’il soit le plus faible possible avec l’utilisation de filtres (pour le
patient et aussi pour le manipulateur)
-
On
fixe la dose à des valeurs limites et classifie les effets en 2 catégories.
|
Les effets non
aléatoires |
Les effets
aléatoires |
|
Ce sont des
effets déterminés pour une dose déterminée. Ils sont dits
« à seuil » : on est en mesure de voir les conséquences
immédiates ou presque (1 heure, 1
jour, etc.) Il s’agit
d’effets précoces. |
Ils sont régis
par une probabilité d’apparition en fonction de la dose reçue. Ils ne
présentent pas de seuil. Ce sont des
effets tardifs. |
|
La norme = le seuil Ils sont
faciles à gérer : on se met en dessous de ces doses et on ne risque
rien. |
Les normes = les chiffres
limites où la probabilité est « acceptable » |
|
Exemples : -
Altération de la formule sanguine Rougeurs de la
peau « coup de soleil », -
Chute des cheveux (aussi une cause chimique), -
Dermite, -
Cataracte : usure et opacification du
cristallin (naturelle chez les personnes âgées) prématurées par les rayonnements
ionisants, -
Atrophie, -
Stérilité, -
Etc. |
|
Ø Valeurs
pratiques des normes :
§ Effets non aléatoires :
Une
limite de dose HL est 500 mSv pour
tous les tissus. Sauf le cristallin, elle est fixée à 150 mSv.
§ Effets aléatoires :
Il
va falloir gérer un risque (développement de cancer) On définit le risque
d’apparition de cancer pour une quantité reçue de rayonnement donné
(c’est–à–dire pour une dose donnée)
Le
risque est différent entre les hommes et les femmes.
" Le nombre de
cancers observés par Sievert de dose reçue :
Pour
la femme : 1,65 . 10–2 Sv–1
Pour
l’homme : 1,40 . 10–2 Sv–1
Il
s’agit ici du risque global sur tout l’individu. Mais des radiations peuvent n’affecter
qu’un seul organe.
Exemple : l’os :
Si on injecte un produit qui se fixe sur l’os, les désintégrations vont surtout altérer les tissus osseux.
Exemple : la thyroïde :
C’est
une glande qui absorbe quasiment tout l’Iode.
On
définit un risque partiel qui correspond au risque au niveau d’un tissu.
Exemple de
risques partiels :
Moelle osseuse : 0,20 . 10–2 Sv–1,
Sein et thyroïde : 0,08 . 10–2 Sv–1,
Poumons : 0,20 . 10–2 Sv–1,
Os : 0,016 Sv–1,
Les
risques partiels (ou locaux) sont reliés au risque global par des facteurs de
pondération de chaque tissu T : WT.
Ce
facteur de pondération du tissu T : WT = risque partiel / risque global
Exemple : le
poumon :
WP = 0,20 . 10–2 Sv–1 / 1,65 . 10–2 Sv–1 (pour la femme)
= 0,12
Une
dose de 1 mSv reçue sur les poumons correspond, en terme de risque, à une dose
de 0,12 mSv reçue sur tout l’organisme.
Le
risque associé à 1 mSv pour les poumons = 0,2 . 10–2 . 10–3 = 2 . 10–6
Le
risque associé à 0,12 mSv sur tout l’organisme = 0,12 . 10–3 . 1,65 . 10–2 = 1,98 . 10–6
La
dose limite pour les effets aléatoires est fixée à 50 mSv/an
Or,
pour les effets non aléatoires, la dose limite fixée à 500 mSv/an s’applique à
tous les tissus.
Alors
que, pour les effets aléatoires, la dose limite fixée à 50 mSv/an s’applique
pour une globalité de l’organisme.
Si
on calcule les doses limites par tissus : HL = WT . HTL
Quand
il y a plusieurs tissus touchés : HL = S Wi . Hi
HTL = HL / WT
Exemple : les
poumons :
HTPoumon = 50 mSv / 0,12
= 420
mSv
Dose pour les
effets non aléatoires = 500 mSv
Exemple : l’os :
WT = risque partiel / risque global = 0,016 Sv–1
HOS = 50 mSv–1 / 0,016 = 4,125 Sv
C’est bien trop, on ne doit dépasser la
dose pour les effets non aléatoires :
500 mSv
Il
existe des contraintes différentes entre les effets non aléatoires et les
effets aléatoires, on respecte la plus petite.
Des
adaptations des risques sont faites en fonction des différentes catégories
socio–professionnelles.
Les
professionnels en contact avec des sources acceptent des risques différents
accompagnés d’un suivi médical qui doit compenser l’excès de risque (un suivi
plus strict et plus régulier permet une détection plus précoce des maladies et
donc des soins plus appropriés)
-
Professionnels
de catégorie A : H > 6
mSv/an " HL = 20 mSv/an
-
Professionnels
de catégorie B : H < 6 mSv/an
-
Public : H <
1 mSv/an " HL = 1 mSv/an
-
Femmes
en âge de procréer : C’est le
moment où elle ne sait pas encore qu’elle est enceinte qui est le plus
dangereux.
Le
fœtus est considéré comme un être vivant, donc « public ».
Mais
si la mère fait partie du personnel de catégorie A, le fœtus peut subir pendant
le premier mois de grossesse un rayonnement supérieur à la limite public.
" On place alors
les femmes en âge de procréer en catégorie A.
Contamination
interne :
Un
problème se pose pour les radioéléments volatiles (exemple : l’Iode) ou
présents dans du lait contaminé.
On
a alors défini la LAI (Limite annuelle d’Incorporation)
Exemple :
L’Iode
inhalé présente une activité 2 . 106 Bq " 50 mSv/an
L’Iode
ingéré présente une activité 1 . 106 Bq " 50 mSv/an
" On fait alors
la correspondance avec la dose efficace engagée par unité d’incorporation en
Sv.Bq (simple règle de 3)
On
utilise une autre valeur pratique : la LDCA (Limite Dérivée de
Concentration dans l’Air)
Elle
s’exprime en Bq.m–3 et conduit à 50
mSv/an pour quelqu’un qui travaille pendant 2000 heures (volume horaire calculé
avant le passage au 35H et conservé après)
Doses
des travailleurs :
|
|
Travailleurs |
Apprentis et
étudiants (de 16 à 18
ans) |
Femmes
enceintes (grossesse
déclarée) |
|
|
Dose efficace |
20 |
6 |
Les
dispositions prises pour l’exposition de la femme dans son emploi doivent
être telles que l’exposition de l’enfant à naître soit aussi faible que
raisonnablement possible et en tout état de cause en dessous de 1 mSv. |
|
|
Dose équivalente |
Cristallin |
150 |
50 |
|
|
Mains,
avant–bras, pieds et chevilles |
500 |
150 |
||
|
Peau (dose
moyenne sur 1 cm2) |
500 |
150 |
||
|
|
Zone non surveillée |
Zone
surveillée |
Verte |
Jaune |
Orange |
Rouge |
||||||||
|
Risque unique
d’exposition externe |
|
5 mSv/an 2,5 µSv/h |
13 mSv/an 7,5 µSv/h |
7,5µSv/h |
2 mSv/h |
2 mSv/h |
|
|||||||
|
Risque unique
d’exposition interne |
|
1/10 LCDA |
3/10 LCDA |
1 LCDA |
10 LCDA |
4000 LCDA |
|
|||||||
|
Accès du
personnel A |
Autorisé |
Autorisé |
Autorisé |
Autorisé
pour une durée limitée |
Service
compétent |
Interdite |
||||||||
|
Accès du
personnel B |
Autorisé |
Autorisé |
Autorisé
pour une durée limitée |
Service
compétent |
Interdite |
Interdite |
||||||||
|
Accès du
personnel non accompagné |
Autorisé |
Autorisé
pour une durée limitée |
Interdite |
Interdite |
Interdite |
Interdite |
||||||||
§ Bilan :
Les
effets précoces :
Ils
ne sont pas observés en dessous de 500 mSv.
" Effets à seuil.
-
Exemple :
au niveau des testicules, au dessus de 2 Sv, on observe une stérilité
transitoire.
-
En
dessus de 6 Sv, on observe une stérilité définitive.
Pour
la peau :
-
De
3 à 8 Sv : rougeurs,
-
De
7 à 10 Sv : cloques,
-
À
partir de 11 Sv : mort du tissu.
Les
effets tardifs :
Il
n’y a pas encore eu d’identification d’effet sur la santé humaine en dessous de
100 mSv (pas encore)
§ Calcul de risque :
Le
risque R correspond à la probabilité d’occurrence de problème de santé lié à
une action particulière :
R =
nombre de morts / nombre de personnes ayant fait cette action.
Exemple :
3
. 106 hongrois fument chacun 9 000
cigarettes par an. 29 000 meurent chaque année du tabac.
R =
29 000/(3.106) » 1 %
" Fumer 1
cigarette correspond à un risque 1/100 . 9000 » 10–6 risque soit
environ 1 µ risque.
Effet
stochastique (Hiroshima, Nagasaki) :
-
Il
y eu 210 000 victimes à cause du souffle de l’explosion sur
1 530 300 habitants.
-
86 572
survivants ont reçu, en moyenne, une dose 100 mSv. 7 827 d’entre–eux ont
développé un cancer entre 1950 et 1990 (l’enquête a été arrêtée faute de
réalité dans les résultats vis–à–vis des personnes âgées mais les
développements de maladies ont encore pu se déclarer)
Le
nombre de cancers que l’on attendait pour une telle population était de 7406.
7 827 –
7 406 5
![]()
![]() R = = pour
100 mSv
R = = pour
100 mSv
86 572 1000
Risque
et normes :
Il
n’existe pas d’action qui ne comporte pas de risque.
Situation
générale : 10 à 100 µ risque par an
pour les professionels.
Situation
particulière :
-
Mineurs : 800 µ risque par an,
-
Pécheurs : 1 800 µ risque par an,
-
Opérateurs
dans les centrales : 125 µ risque par an.
Normes
relatives aux rayonnements :
-
Professionnels
de catégorie A : 20 mSv par an,
Bilan
des radiations reçues annuellement :
|
|
Valeur moyenne |
Valeur élevée |
|
|
Radiations
cosmiques |
0,4 mSv (au niveau de
la mer) |
2 mSv (en altitude) |
|
|
Radiations du
sol |
0,5 mSv |
40 mSv |
|
|
Radiations
lors de radiodiagnostic |
1 mSv |
20 mSv |
|
|
Radiation
naturelle |
2,5 mSv |
||
|
Expérience
médicale (un seul
examen) |
Radio
pulmonaire |
0,3 mSv |
|
|
Radio
abdominale |
1 mSv |
||
|
Scanner thorax |
5 mSv |
||
|
Scanner
abdominal |
2 à 15 mSv |
||
|
Traceur Scintigraphie
osseuse |
4 mSv |
||
|
Traceur Scintigraphie
cardiaque |
20 mSv |
||
|
Traitement de
doses absorbées localement pour détruire des tissus tumoraux (radiothérapie
et curiethérapie) |
10 000 à
100 000mGy |
||
|
Opérateurs de
centrale |
2,5 mGy |
||
|
Manipulateurs
de radio en médecine |
0,5 mGy |
||
|
Pilotes
d’avion (selon
l’altitude) |
2 à 3 mGy |
||
|
Mineurs (confinement
et minéraux) |
1 à 10 (plus
risque de grisou) |
||
Remarque : On a découvert
des populations vivant depuis toujours avec des radiations au niveau du sol
environnant les 150 mSv et qui ne présentent pas de problèmes particuliers.
v
Détecteurs
et dosimètres :
Il
s’agit de capteurs utilisant des matériaux solides, liquides ou gazeux. On
utilise les interactions des rayonnements dans le capteur soit par le
biais :
-
De
processus d’ionisation directs ou indirects " courant
électrique,
-
De
processus d’excitation des électrons de la matière (pas d’arrachement de ces
électrons donc pas de courant) " émission de
lumière lors du retour à l’état fondamental (signal électrique),
-
De
processus physicochimiques " production de
radicaux ou de nouvelles molécules.
Ø Processus
d’ionisation – exemples de détecteur :
§ Le plus courant : le
détecteur à gaz :
Il
consiste en un simple cylindre de gaz…

Fil
d’anode central
…
avec un circuit électrique.
 Anode
Anode
Cathode
Signal
Borne
– Condensateurs
Résistance
Borne
+
On
met un courant dans notre fil d’anode.

g
Molécule
de gaz
– Électrons +

Molécule ionisée (cation)
Électron
Il
y a une possibilité de ne pas collecter les électrons sur le fil d’anode et que
ceux–ci se recombinent avec des molécules de gaz ionisées.
Pour
éviter les recombinaisons, il faut augmenter la tension d’anode.
 I
I
(échelle log)
I II III IV V
Compteur
proportionnel
Zone de Chambre d’ionisation Compteur
recombinaison Geiger–Muller
Semi
proportionnel
Particules a
Électrons
-
Zone de recombinaison :
On
ne collecte pas tous les électrons issus de l’ionisation des molécules de gaz.
-
Chambre d’ionisation :
On
collecte tous les électrons produits par les particules ionisantes incidentes,
aucun ne s’est recombiné. Mais on a le problème d’avoir un tout petit courant,
difficilement détectable par un voltmètre.
-
Compteur proportionnel :
On
collecte plus d’électrons que ceux issus de l’ionisation. Les électrons
arrachés des molécules de gaz ont assez d’énergie cinétique pour arracher un
autre électron d’une autre molécule de gaz.
Malgré
cette amplification, on garde la proportionnalité entre le nombre d’électrons
collectés et l’énergie des particules incidentes.
-
Compteur Geiger – Muller :
Il
y a une grande cascade d’ionisation. L’amplification est tellement grande que
l’on perd la proportionnalité avec l’énergie des particules incidentes. Il ne
permet que de compter.
-
Si on augmente encore le courant :
Il
y a formation d’arcs électriques. Ce n’est plus un détecteur mais un appareil à
souder.
Ce
type de détecteur fonctionne pour les particules ionisantes. Il existe une
probabilité mince que les photons interagissent avec le gaz.
§ Détecteur
semi–conducteur :
Énergie des électrons

Bande de
conduction
BC
« Gap »
Bande de
valence
BV
Pour
utiliser un matériau, il faut que les électrons de la bande de valence puissent
passer dans la bande de conduction.
Si
le gap est trop important, on a affaire à un matériau isolant. S’il n’y a pas
de gap, on a affaire à un matériau conducteur.
Pour
les matériaux semi–conducteur, le gap est d’environ 1 eV.

BC
Niveau donneur dans la Bande interdite
(BI)
« Gap »
Niveau accepteur dans la Bande interdite
(BI)
BV
Ce
type de matériau est difficile à manipuler (refroidissement du matériau dans
l’azote) mais offre une très grande qualité de mesure.
Ø Processus
d’excitation :
§ Scintillateurs :

PM
NAI (matériau
transparent ressemblant au plexiblas)
Aluminateur (un noir
absolu est nécessaire pour ne pas avoir d’interactions avec l’éclairage de
l’extérieur)
PM :
Photomultiplicateur (cellules photo–électriques pour transformer la
lumière en électricité)
1 photon g " 1
électron " 104 photons
visibles " 102 électrons " PM
Les
scintillateurs organiques dépendent des propriétés intrinsèques de la
molécule indépendantes de son état solide ou liquide (cristaux, liquides,
plastique)

Absorption Phosphorescence
d’énergie Fluorescence (lent)
(rapide)
Les
scintillateurs inorganiques correspondent à peu près à des détecteurs semi–conducteurs
avec ou sans activateur (exemple : NAI, CSI)

État
excité de l’activation : création de niveau d’énergie dans la zone de
bande interdite.
État
fondamental.
![]()
Le
tube PM
constitue une structure multiplicatrice où on observe un phénomène de cascade
(cf TD)

La largeur à mi–hauteur est due à la qualité plus ou
bonne du détecteur.
(plus la qualité augmente, plus la largeur à
mi–hauteur diminue)
662
keV (où toute l’énergie est transférée)
Ø Transformation
physico–chimique :
§ Exemple de l’émulsion
photographique :
É![]() lectron
lectron
![]() H2 = H
∙ — ∙ H " H ∙ ; H ñ
H2 = H
∙ — ∙ H " H ∙ ; H ñ
Photon
On
utilise un support de gélatine et d’ions Bromure–Argent. Ces ions deviennent
des atomes d’Argent, des traces qui noircissent par révélation et déterminent
la quantité d’ionisation.
§ Détecteur solides de
traces :
Ils
sont basés sur le même principe.
" Le rayonnement transforme les matériaux et
les fragilise. On produit alors des agressions chimiques (comme avec l’acide)
formant alors des micro–trous aux endroits fragilisés.
On
compte alors ces trous à l’aide d’un microscope.
aux
scientifiques qui emploient cette technique !
v
Atome
Hydrogène, modèle de Bohr :
Quand
on soumet un atome d’Hydrogène à une décharge électrique, on observe des raies
à des longueurs d’onde précise.
Ø D’un
point de vue mécanique :
On
sait gérer un mouvement circulaire et une force d’attraction (force
coulombienne)
![]() 1 e 2
1 e 2
![]()
![]()
![]()
![]() Fn = . . n avec n , un vecteur unitaire.
Fn = . . n avec n , un vecteur unitaire.
4. π . e0
r ²
![]()
![]() La somme des forces est égale à
l’accélération : S F = m .
g
La somme des forces est égale à
l’accélération : S F = m .
g
Pour
un mouvement circulaire : g = v2 / r

1 e 2 v
![]()
![]() . = m .
g =
m . v2 / r
n
. = m .
g =
m . v2 / r
n
4. π . e0
r ²
r
1 e 2
![]()
![]() . = m . v2
. = m . v2
4. π
. e0
r
L’énergie
d’un électron :
ETOTALE = ECINETIQUE + EPOTENTIELLE
EC d’une particule
classique = y m v2
EP = ?
Soit
une craie posée sur une table avec une énergie de référence :

![]() Au repos Toujours
au repos mais elle
Au repos Toujours
au repos mais elle
(énergie
de référence) présente
une énergie potentielle.
EP = m . g . h
EP = 0 si r " ¥
EP = ¥r¦ Fn dx = ¥r¦ 1/(4.π.e0) . e2 . dx / x2
= e2 /(4.π.e0) . [–1/x]r¥ = e2 /(4.π.e0) . [–1/¥
– (–1/r]
= 0
= e2 /(4.π.e0) . 1/r
ET = EC + EP = y m v2 + e2/(4.π.e0) . 1/r
= y 1/(4.π.e0) . e2/r – 1/(4.π.e0) . e2/r


ET = – y 1/(4.π.e0) . e2/r =
ET = f(r) avec r allant de 0 à ¥.
Énergie
de liaison d’un système :

![]()
EP + EC = ET(i)
On
suppose qu’ils sont à une distance r = ¥
et qu’ainsi ils sont au repos :
v
= 0 EC = 0 Et comme r = ¥ , EP = 0
Donc
ET(f) = 0
ELiaison
+ ET(i) = ET(f)
EL = ET(f) – ET(i) = – ET(i) = y 1/(4.π.e0) . e2/r
Cela
supposerait que l’électron de l’atome H pourrait avoir toutes les énergies
possibles.
Or
expérimentalement, c’est faux à causes des longueurs d’onde précises.
Ø Postulats
de Bohr :
Beaucoup
de bidouilles…
§ 1er
postulat : postulat mécanisme :
n ![]() N
N
m.v2 = 1/(4.π.e0) . e2/r et s
=
n.h
=
m.v.r donc v =
n.h
/(m.r)
Donc m.n2.h
2 /(m.r)2 = 1/(4.π.e0) . e2/r
On
fige alors r : r = n2.h
2 /(m. e2) . 4.π.e0 et r = n2.r0
ET = – y 1/(4.π.e0) . e2/r
ET = – y [1/(4.π.e0)]2 . e4.m /(n2.h
2)
ET
= – y [1/(4.π.e0)]2
. e4.m
/h
2 . 1/n2
ET = – E0 /n2 avec E0 = 13,6 eV
En = – E0 /n2 rn = n2.r0 r0 = 0,53 Å (n=1)
§ 2ème
postulat : postulat optique :
L’électron
peut se déplacer entre les différents états d’énergie accessibles. n ![]() N
N
(n=1)
(n=2) (n=3) (n=4)
En = –13,6 eV ;
–13,6/4 ; –13,6/9
; –13,6/16
État initial i " État final f
Ei Ef
Si
Ei < Ef, l’électron absorbe de
l’énergie (= Ef – Ei)
Si
Ei > Ef, l’électron émet de
l’énergie (= Ei – Ef)
Transitions :
L’électron
va de n=4 à n=1. E4 = –13/16 E1 = –13 eV
E = E4 – E1 = 13,6 (1 –
1/16) = 15/16 . 13,6
" Possible pour
toutes les transitions (avec tous les états)
E = Ei – Ef
= – E0 ( 1/ni2 – 1/nf2) (= énergie émise)

Voir le site http://www.physique–eea.unicaen.fr/~tice/coursenligne.html " Atome
de Bohr
Absorption
d’énergie par l’atome :
La
structure atomique peut stocker de l’énergie par un changement du niveau
d’énergie de l’électron.
Mais
il faut apporter l’énergie correspondant précisément à un état possible pour
l’électron.
Si
on apporte une énergie entre En et En+1, rien ne se
passe.
Si
on apporte une énergie supérieure à l’énergie de liaison EL, l’électron
quitte l’atome. On parle d’ionisation de l’atome.
L’apport
d’énergie peut se faire par une décharge électrique ou par des photons.
Tout
élément tend vers son état fondamental.
Quand
l’électron est sur une couche différente que sa couche fondamentale, il y
retourne en libérant son surplus d’énergie par un quantum (= photon) d’énergie.
Pour
l’atome de Bohr, l’état fondamental de l’électron est n=1 et correspond à
l’énergie de liaison maximale avec l’atome.
L’électron a la possibilité de passer de l’état n à l’état fondamental directement ou par une cascade jusqu’à l’état fondamental.
Les
photons libérés ont une longueur d’onde différente en fonction des différences
d’énergie entre les états.
Toutes
les transitions d’un état n>2 vers n=2 (= série de Balmer) ont pour
conséquence l’émission de photons avec des longueurs d’ondes dans le domaine du
visible.
v
Généralisation
aux atomes hydrogénoïdes :
Ils
ressemblent à l’Hydrogène (= avec un seul électron)
" §
H ;
¸ He+ ; 63
Li2+ ; etc
; 20882
Pb81+
(on sait le faire)
Pour
l’atome de Bohr :
F = 1/(4.π.e0) . e2/r2
Pour
un atome hydrogénoïde :
F = 1/(4.π.e0) . Z . e2/r2
En = – E0 . Z2 /n2
v
Généralisation
à tous les atomes :

Les
autres électrons font écran
au noyau.
F = 1/(4.π.e0) . ZEff . e2/r2
F = 1/(4.π.e0) . (Z–se) . e2/r2
En = – E0 . (Z–se)2 /n2
√(En) est
proportionnel à Z √(En) = √(–
E0 /n2) . Z – se
Cette démarche est bonne au point de vue de l’énergie mais pas au point de vue de la localisation.
La
position de l’électron n’est pas définie mais seulement une fonction d’onde Y(x, y, z, t)
telle que la
probabilité de trouver l’électron entre x et x+dx ; y et
y+dy ;
z et z+dz et entre t et t+dt correspond à dP
= |Y(x, y, z, t)|2
dx dy dz dt
La
position de l’électron n’est pas définie sur une sphère parfaite avec un rayon
précis. On peut trouver un électron partout dans l’espace ; la probabilité
dP n’est donc jamais nulle.
Ø  Modèle
de Bohr Summerfeld :
Modèle
de Bohr Summerfeld :
n : nombre quantique principal
l : nombre quantique orbital (= rapport grande
orbite/petite orbite)
m : nombre quantique magnétique
(angle entre l’horizontale et le grand axe)
s : nombre quantique de spin
(rotation de l’électron sur lui–même)
n : 1 ; 2 ; 3 ; 4 ; 5 ; etc.
Couche : K, L, M, N, O, etc.
l : 0 ;
1 ; 2 ; 3 ; … ; n–1
Sous–couche : s ;
p ; d ;
f ; …
mL :
projection de m :
– l ≥ mL ≥ l
mS :
projection de s : +/– y
Quand
n augmente, l’énergie
E augmente et l’énergie de
liaison EL diminue.
Pour
un n donné :
Quand
l
augmente, l’énergie E augmente et l’énergie de liaison EL diminue.
L’état
d’un électron est donné par n, l, mL et mS. Exemple : n=1 l=0
L’état
fondamental correspond à l’état d’énergie de liaison maximale (= état le plus
stable)
§ Tableau de Mendeleïev :
|
Nombres
quantiques |
Sous–couche |
Couche |
Nb d’électrons
dans la sous–couche |
Nb total sur
la couche |
|||
|
n |
l |
mL |
mS |
||||
|
1 |
0 |
0 |
+/– y |
1 s |
K |
2 |
2 |
|
2 |
0 |
0 |
+/– y |
2 s |
L |
2 |
8 |
|
1 |
–1 0 1 |
+/– y |
2 p |
6 |
|||
|
3 |
0 |
0 |
+/– y |
3 s |
M |
2 |
18 |
|
1 |
–1 0 1 |
+/– y |
3 p |
6 |
|||
|
2 |
–2 –1 0 1 2 |
+/– y |
3 d |
10 |
|||
|
4 |
0 |
0 |
+/– y |
4 s |
N |
2 |
32 |
|
1 |
–1 0 1 |
+/– y |
4 p |
6 |
|||
|
2 |
–2 –1 0 1 2 |
+/– y |
4 d |
10 |
|||
|
3 |
–3 –2 –1 0 1 2 3 |
+/– y |
|
14 |
|||
Le
nombre total d’électrons par couche : NT = 2n2
On
ne peut pas avoir 2 électrons avec les mêmes nombres quantiques n, l, mL et mS.

§ Organisation en
énergie :
" Couplage spin –
orbite.
![]()
j = l + s
![]()
|
l – s | <
j < | l
+ s |

![]()
![]() j = l + s
j = l + s
![]()
![]() j = l – s
j = l – s
|
n=1 |
l=0 |
s=+/– y |
j = y |
Une
seule valeur d’énergie |
K |
|
n=2 |
l=0 |
s=+/– y |
j = y |
Une
seule valeur d’énergie |
LI |
|
l=1 |
s=+/– y |
J = y ;
” |
2
valeurs d’énergie |
LII et LIII |
|
|
n=3 |
l=0 |
s=+/– y |
j = y |
Une
seule valeur d’énergie |
MI |
|
l=1 |
s=+/– y |
J = y ;
” |
2
valeurs d’énergie |
MII et MIII |
|
|
l=2 |
s=+/– y |
j =
” ;
5/2 |
2
valeurs d’énergie |
MIV et MV |
![]()
3 énergies
différentes
 Exemple : 63
Li
Exemple : 63
Li
LIII
LII
LI
K
État État État
fondamental
excité ionisé
v
Absorption
et émission d’énergie par la structure atomique :
Ø Absorption :
§ Excitation :
 LIII
LIII
LII
LI
K
État fondamental
État excité
L’énergie
apportée est exactement : E = ELIII – EK
De
plus, il faut que la sous–couche LIII ne soit pas
déjà occupée par des électrons.
Ce
processus peut permettre des réactions chimiques, dites photo–induites (=
excitation par des photons)
§ Ionisation :

L’énergie
apportée : E ≥ E l K
E
= E l K + Teˉ
Ø Émission
:
§ Fluorescence :
Point
de départ : État excité (voire
ionisé)

E = ELIII – EK
= E l K – E l LIII
Rayon X
 63 Li*
63 Li*
EX1
EX2
OU
EX
Rayon X
EX3
E = – EK = E l K
§ Nomenclature des transitions
électroniques donnant les raies X les plus intenses :

La1 La2 Lb1 Lb2
Ka1 Ka2 Kb1 Kb2
On établie une table d’énergie pour tous les éléments.
Loi
de Moseley :
√(EKa1)
 (en keV)
(en keV)
" Droite presque
parfaite
№ atomique
v
Interaction
rayonnement – matière :
Ø Application
:
La
lumière blanche :
Il
s’agit d’un mélange de toutes les radiations :
Bleu :
480 nm

Cyan :
500 nm Magenta :
720 nm
Vert :
530 nm Rouge :
700 nm
Jaune :
590 nm
Exemple : La
chlorophylle absorbe le magenta, on voit donc la couleur verte.
La
vision nocturne :
Elle
est possible grâce à la sensibilité des cellules à bâtonnet.
Sensibilité
relative 5100 Å
5550 Å
 (arbitraire)
(arbitraire)
Vision
nocturne (cellules à bâtonnets)
=
Sensibilité aux bleus
Vision
diurne (cellules à cône)
=
Capacité de supporter de grandes variations
d’intensité
de la lumière.
"
peu de sensibilité dans les bleus
et une grande finesse dans le rouge.
La
longueur d’onde 5550 Å correspond à la
couleur verte " les lunettes de
soleil ont un reflet vert.
Le
soleil et la peau :
Le
soleil émet des longueurs d’onde de 3 000 Å et 50 000 Å. Entre le soleil et nous, il y a l’atmosphère qui
filtre.
Intensité
à la surface : UV : 8 % entre
0,2 µm et 0,4 µm
Visible : 41 % entre
0,4 µm et 0,4 µm
IR : 51 % entre
0,7 µm et 5 µm
Intensité
 Sensibilité
de la peau
Sensibilité
de la peau
Spectre
du soleil au zénith
Tout
petit domaine en longueur d’onde
qui
fait réagir la peau (rougeurs)
" Protection par une crème.
l
(en µm)
0,28 0,3 0,32 0,34 0,36
L’épaisseur
de la couche d’atmosphère va jouer sur le filtrage (différence aussi entre le
niveau de mer et l’altitude)

Le laser :
(Light Amplification by Stimulated Emission Radiation)
Il
est souvent utilisé dans des applications médicales. Il est basé sur le
principe du stockage d’énergie dans les structures atomiques et en la
concentration de cette énergie.
Un
électron va de la couche K vers une couche supérieure par excitation. Celui–ci
va retomber de la couche M à K, lors de la réorganisation atomique, avec
l’émission d’un photon.

Pour
le laser, on utilise des matériaux tels que la retombée se fasse sur le niveau
2 (niveau métastable) pendant quelques millisecondes.
Il
y a alors un fort peuplement d’électrons dans ce niveau. On parle d’inversion
de population du niveau 1 au niveau 2.

On
éclaire ensuite ces atomes ayant cette configuration avec des photons d’énergie
E = E2 – E1.
Il
y a une retombée des électrons du niveau 2 au niveau 1, avec 2 fois plus de
photons d’énergie E = E2 – E1.
Il
s’agit d’un stockage de l’énergie et de sa libération instantanée sous forme
lumineuse. De plus, une direction fine du faisceau est possible.
Son
utilisation :
-
Show
laser en discothèque,
-
Applications
médicales :
-
Chirurgie
fine (soudure de petit vaisseaux sanguins),
-
Stérilisation
(pas de contact avec les instruments),
-
Choix
des réactions (avec le choix de couleur),
-
Chirurgie
avec incision fine avec une diminution de la douleur,
-
Etc.
-
Opthalmologie (avec
un laser excimètre : UV) :
-
Décollement
de la rétine,
-
Défaut
de vision par la modification de la forme de la cornée,
-
Etc.
-
Détatouage
(dissociation des molécules d’encre),
-
Etc.
v
Le
noyau :
Ø Description
rapide :
-
Sa
taille est de l’ordre du Fermi (10–15 m) de 1 à 10
fm.
" La taille de
l’atome est de l’ordre de l’angström (10–10 m)
-
Sa
masse constitue plus de 99 % de la masse de l’atome.
-
Les
forces qui y sont exercées sont des répulsions coulombiennes entre les protons.
Pour les contrecarrer, il faut une force colossale : la force nucléaire.
Le
noyau radioactif est un noyau instable. Le terme d’ « atome
radioactif » est mal adapté puisqu’il s’agit plus particulièrement du
noyau.
La
radioactivité est le seule transformation qui se fait toute seule.
Ø Nomenclature
:
§ Noyau :
A
: nombre de nucléons (= nombre de masse) 1 uma = 1 masse d’un
nucléon
Z
: nombre de protons (= de charge) = nombre d’électrons (pour un atome neutre)
" Il permet la
définition d’un élément chimique.
N
: nombre de neutrons = A – Z
Exemple : L’élément Iode 53 protons
" 53I
et différents
nombre de neutrons (127, 129, 131, 132, etc.)
" Définition des différents isotopes de l’Iode.

Carte
des noyaux :
Z N = Z
(jamais
observés,
mais recherchés)
Zone
(ou vallée) de la stabilité
(environ
300 noyaux sur 3 500 étudiés)
N
Plus
on s’éloigne de la vallée de stabilité, plus les noyaux sont instables et plus
leur durée est courte.
On
peut considérer que tous les noyaux sont radioactifs, mais avec des durées de
vie plus ou moins longues.
Au
dessus de la zone de stabilité, les noyaux sont riches en protons.
Ils en
perdent lors de leur désintégration :
Proton " Neutron + b+ + 1
neutrino
Au
dessus de la zone de stabilité, les noyaux sont riches en neutrons.
Ils en perdent lors de leur désintégration :
Neutron " Proton + bˉ +
1 antineutrino
Pour
un noyau lourd, il y a une perte de matière avec l’émission d’une
particule ¸a
(= noyau
d’Hélium : pas d’électron !!)
 Z
Z
N
= Z
Même nombre Z
= isotopes
Vallée
de stabilité
Même
masse
=
isomère
N
Même nombre de N
= isotones
§ Réactions nucléaires :
Il
s’agit du passage (ou transformation) d’un état initial « i » à un
état final « f ».
![]()
Diffusion
élastique : « i » Û « f » Exemple :
![]() Diffusion inélastique : « i » ¹ « f » Exemple :
Diffusion inélastique : « i » ¹ « f » Exemple :
a +
A " b + B
Bilan
énergétique : Q =
ma.c2 + mA.c2 – mb.c2 – mB.c2
= c2 (ma
+
mA – mb – mB)
" Le bilan
énergétique consiste en fait en un bilan de masse.
Q
> 0 : mi > mf " Production
d’énergie
(souvent sous forme d’énergie cinétique des
produits)
= réaction exothermique.
Q
< 0 : mi < mf " Apport
d’énergie cinétique par les réactifs
et consommation de cette énergie
v
Énergie
de liaison des noyaux :
¿ X " Z . p
+ (A–Z) . n
L’énergie
de liaison E, E
l A–Z ,est nécessaire
pour éclater un noyau en Z protons et (A–Z) neutrons.


Comment
la calculer ?
mx.c2 + E l A–Z = Z .
mp.c2 + (A–Z) mn.c2
E l A–Z = Z .
mp.c2 + (A–Z) mn.c2 – mx.c2
On
a besoin de connaître mx (= la masse du noyau
X) Or, on ne connaît que Mx (= masse de
l’atome, donnée dans les tables)
Atome X " noyau X + Z . meˉ
Mx.c2 + E l Ze = mx.c2 + Z me.c2
mx.c2 = Mx.c2 + E l Ze –
Z me.c2
Pour
l’Hydrogène : (1 proton
et 1 électron) mp.c2 = MH.c2 + E l (eH) – me.c2
![]()
![]() E l A ;
Z = Z.MH.c2 + Z.E l Ze –
Z.me.c2 + (A–Z) mn.c2 – Mx.c2 – E l Ze +
Z me.c2
E l A ;
Z = Z.MH.c2 + Z.E l Ze –
Z.me.c2 + (A–Z) mn.c2 – Mx.c2 – E l Ze +
Z me.c2
E l A ;
Z = Z.MH.c2 +
(A–Z) mn.c2 – Mx.c2 + Z.E l Ze – E l Ze
![]()
?
E l A ;
Z
/A = énergie moyenne par nucléon

8
Le
noyau le plus stable est le Fer.
" Il a la plus
forte énergie par nucléon.
Fusion Fission
symétrique
1
16O 26Fe 54Xe 234U
ZA
X " Z1A1
X1 + Z2A2
X2 A = A1 + A2 ; Z
= Z1 + Z2
Mx.c2 = Mx1.c2 + Mx2.c2 + DE
![]() DE
= Mx.c2 – Mx1.c2 +
Mx2.c2
DE
= Mx.c2 – Mx1.c2 +
Mx2.c2
=
Z.Mx.c2 –
(A–Z).mn.c2 + E l A ; Z +
E l A1 ; Z1 – Z.Mx.c2 – (A1–Z1).mn.c2 + E l A2 ; Z2 + Z.Mx.c2 – (A2–Z2).mn.c2
DE = E l A1 ; Z1
+ E l A2 ; Z2 – E l A ; Z
DE = A1.E l A1 ; Z1 /A1+ A2 .E l A2 ; Z2 /A2 – A.E l A ; Z/A
![]()
E l A1 ; Z1 /A1 > E l A ; Z/A
DE > 0
E l A2 ; Z2 /A2 > E l A ; Z/A
E l A–Z = Z .
MH.c2 + (A–Z) mn.c2 – MA ;
Z.c2
= Dm.c2
" Énergie = Masse Cette formule rappelle celle d’Einstein : E = m.c2
E l A–Z correspond à
l’organisation (ou configuration) des nucléons dans le noyau.
v
Radioactivité
:
Pour
une énergie E
l A–Z, il y a un
grand nombre de configurations des nucléons possibles.
Soit : nS : le
nombre de configurations stables,
nIS : le
nombre de configurations instables.
 Particule
a
Particule
a
Sur
un temps infini, la probabilité totale de transformer sa configuration = nIS /(nS+nIS)
La
constante radioactive l est la
probabilité pour un noyau de se désintégrer par unité de temps.
Si l = 0 , le noyau est rigoureusement stable ;
Si l ¹ 0 , le noyau est instable (ou radioactif),
c’est–à–dire avec une certaine probabilité de se désintégrer.
Ø Processus
de désintégration :
§ Processus a :
Cela
concerne les noyaux lourds.
¿ X " ¿––¸
Y* + ¸
a
Cette
désintégration entraîne une pagaille dans les nucléons qui restent dans le
noyau. Donc celui–ci est sûrement dans un état excité (l’organisation des
nucléons n’est pas idéale)
La
durée de vie de cet élément excité est très courte (10–15 s) Il y a des
cas où elle est plus longue (supérieure à 10–9 s) On parle
d’état isomère ou métastable (vu avec le laser)
Retour
à un état stable :
¿––¸
Y* " ¿––¸
Y + g
Les
particules a
sont arrêtées dans l’air ; il n’y a un problème que s’il y a un contact
direct avec la peau, en cas d’ingestion ou en cas d’inhalation.
Les
photons g sont plus
dangereux car ils traversent de grandes épaisseurs d’air.
" Ea ?
Principe
de conservation de l’énergie :
Mx.c2 = MY.c2 + Ma.c2 + Ta + TY + E Y*
Qa = Mx.c2 – MY.c2 – Ma.c2 = Ta + TY + E Y*
![]()
![]()
![]() Principe de conservation de la masse : 0 = Pa + PY
Principe de conservation de la masse : 0 = Pa + PY

PY
Pa
T = P2/2M Pa = PY
Qa = PY2/2MY + Pa2/2Ma + E Y* = Pa2/2Ma (1 + Ma/MY) + E Y*
![]() Qa
= Ta (1 +
Ma/MY) + E Y* .
Qa
= Ta (1 +
Ma/MY) + E Y* .
![]()
![]()
![]() Mesuré
Mesuré
Donné pour les tables
Mesuré Donné pour les tables
§ Processus bˉ :
![]() ¿ X " ¿+1
Y* + –1
bˉ + u
¿ X " ¿+1
Y* + –1
bˉ + u
Un
neutron est transformé en un proton.
Neutron
" Proton
+ bˉ +
1 antineutrino
 N(Tbˉ)
N(Tbˉ)
Le
bˉ
peut avoir toutes les énergies possibles
![]() de 0 à Tbˉmax à cause de
la présence de u dont l’énergie
varie
de 0 à Tbˉmax à cause de
la présence de u dont l’énergie
varie
Tbˉmax
Tbˉ
¿––¸
Y* " ¿––¸
Y + g
§ Processus b+ :
¿ X " ¿+1
Y* + –1
b+ + u
Un
proton est transformé en un neutron.
Proton
" Neutron +
b+ +
1 neutrino
¿––¸
Y* " ¿––¸
Y + g
Ø Décroissance
radioactive :
Le
noyau est le seul objet capable de se transformer.
0 t t+dt
N0 N(t) N(t+dt)
= ?
dN
= N(t+dt) – N(t) = – l . N(t) . dt
dN/N = – l dt " ¦dN/N = ln N
ln N = – l.t + C C = constante
N(t)
= eln[N(t)] = e–l
t
+ C = eC . e–l
t
N(t)
= eC . e–l
t
Détermination
de eC :
N(t=0) = eC . e–l
. 0
N0 = eC
" N(t) = N0 . e–l
t
D l
ressemble à la probabilité d’interaction du photon dans la matière : N(x) = N0 . e–µ x x correspond alors à l’épaisseur de la matière ; alors qu’ici t correspond à l’évolution dans le temps.
Ø Nomenclature
:
§ Activité :
Il s’agit du nombre de désintégrations par unité de
temps à la date t.
Son unité est le Becquerel : 1 Bq = 1 désintégration par seconde.
1
Ci = 3,7 . 1010 Bq
Historiquement, 1 Curie correspond au nombre de
désintégrations d’un gramme de Radium (Rn) par seconde.
0 t t+dt
N0 N(t) N(t+dt)
A0 A(t) A(t+dt)
A(t) = l.N(t) = l . N0
.
e–l
t
= A0
.
e–l
t
Avec
A0 : l’activité d’un échantillon à t = 0
§ Période :
Elle
correspond au temps au bout duquel la moitié des noyaux se sont désintégrés.
0
T½
N0 N0/2
![]()
![]() N(t=
T½)
= N0/2 = N0 . e–l
T½
N(t=
T½)
= N0/2 = N0 . e–l
T½
e–l
T½ = y " ln e–l
T½ = – ln
2
l
. T½
= ln 2 " T½ = ln 2/l.
|
troponine |
0 |
T½ |
2 T½ |
… |
10 T½ |
|
N |
N0 |
N0
/2 |
N0
/4 |
… |
N0
/1024 |
À
t = n T½ N(t) = N0 /2n
![]()
N(t = nT½) = N0 . e–l
n.T½ = N0 . e–ln2/T½ n.T½
= N0 . e–n.ln2 = N0 . 2–n = N0 /2n
Exemple
de Tchernobyl :
Le 137Cs dans
l’environnement a une période de 30 ans.
De
1986 à 2005, il y a eu 19 ans. Il reste plus de la moitié Césium initial
dans l’environnement.
§ Période biologique :
Soit
un échantillon liquide avec quelques noyaux radioactifs.

t = 0
A0 A0 (mesurable)
N0
À
une date t : À
une date t :
A’(t) A(t)
N’(t) N(t)
A’(t) <
A(t)
parce
que des noyaux radioactifs se sont échappés de l’individu par la transpiration,
les excrétions et les urines.
Dans
le bonhomme :
0
t t+dt
N0 N(t) N(t+dt)
dN = – lp . Ndt – lb . Ndt
lp : Constante
radioactive physique.
lb : Probabilité
pour un noyau radioactif (l’élément chimique correspondant) d’être éliminé par
l’organisme.
dN = – (lp + lb) . Ndt = – leffectif . Ndt
Intégration :
N(t) = N0
.
e–leffectif
t
= N0
.
e –(lp
+ lb)
t
Application
médicale :
L’injection
de produits radioactifs dans le sang permet de déterminer le volume du sang par
un rapport de dilution (qui se fait en quelques secondes)
Exemple
de l’Iode, le rapport de dilution dans le sang est très faible. En effet,
quasiment tout l’Iode se fixe dans la tyroïde et donc il est sorti su système
sanguin.
Donc
si l’on calcule le rapport de dilution dans le sang, il sera faussé et on
trouvera quelques centaines de m3.
L’injection
de produits radioactifs constitue une contamination ; donc il faut faire
attention aux doses.
Exemple : L’élément 131I :
Tb : 139 jours Tp : 8,04 jours
Tb : la période
biologique ; c’est le temps mis par l’organisme pour rejeter la moitié de
l’élément (au sens chimique)
Tb = ln
2/l Tp = ln
2/l
![]()
![]()
![]() Donc leffective = lp + lb =
ln2/Tp + ln2/Tb =
ln2/Teffective
Donc leffective = lp + lb =
ln2/Tp + ln2/Tb =
ln2/Teffective
" ln2/Teffective = 1/Tp + 1/T DEt
pas une somme directe !
Ø Filiation
radioactive :
A " B " C
Noyau père Noyau fils
Noyau petit–fils
(pas forcément (considéré stable
stable) dans notre cas)
Exemple : L’examen médical :
Sur
le temps d’étude, il faut que l’on ait un phénomène produit, donnant lieu à une
observation médicale.
Souvent :
lA ; TA
lB ; TB
A " B " C
Période longue Période courte
= Réserve (que l’on injecte au patient
chaque jour ou heure)
Il
faut connaître : NA(t) ; NB(t) et NC(t)
0
t t+dt
N0 NA(t) NA(t+dt)
NB(t) NB(t+dt)
NC(t) NC(t+dt)
À
t = 0 :
On suppose que NA(t=0) = N0 " Il n’y a que
des noyaux A
NB(t=0) = 0
NC(t=0) = 0
À
une date t quelconque :
NA(t) + NB(t) + NC(t) = N0
Nombre
de noyaux A :
dNA = – lA NA dt " dNA
/NA = – lA dt
Intégration : lnNA = – lA . t + a
NA(t) = e–lA
t
+ a
= e–lA
t
. e a NA(t=0) = N0 = 1
. e a
NA(t) = N0
. e–lA
t
Nombre
de noyaux B :
dNB = lA NA dt – lB NB dt
Solution
partielle : dNB = – lB NB dt " NB(t) = B1
. e–lB
t
Solution
générale : NB(t) = B1(t)
. e–lB
t
On
accepte que B1 ne soit pas une constante et
dépende du temps pour prendre en compte lA NA dt.
On va donc
bidouiller B1 pour qu’elle
soit valable tout le temps.
Dérivation
de B1(t)
. e–lB
t :
![]()
![]() dB1/dt . e–lB
t + B1 (–lB) e–lB
t
= B1 (–lB) e–lB
t + lA N0 e–lA
t
dB1/dt . e–lB
t + B1 (–lB) e–lB
t
= B1 (–lB) e–lB
t + lA N0 e–lA
t
dB1/dt . e–lB
t
= lA N0 e–lA
t
" dB1/dt = lA N0 e–
( lA
–lB
) t
Intégration :
lA N0
![]() B1 = e– ( lA
–lB
) t + B2 avec
B2 = constante
B1 = e– ( lA
–lB
) t + B2 avec
B2 = constante
lB –
lA
NB(t) = B1(t)
. e–lB
t = (lA N0)/(lB –
lA) . e–
lA
t + B2
. e–
lB
t
NB(t=0) = 0
= (lA N0)/(lB – lA) . 1 + B2 . 1
" B2 = – (lA N0)/(lB – lA)
NB(t) = (lA
N0)/(lB –
lA)
[e– lA
t
– e– lB
t]
Nombre
de noyaux C :
NC(t) = N0
– NA(t)
– NB(t)
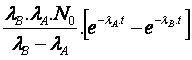 Activité :
Activité :
AA(t) = lA NA(t) = ± lA N0 e–
lA
t de même : AB(t) = lB NB(t) =
AC(t) = 0 (les noyaux sont stables)
lA ; TA
lB ; TB
A " B " C
Cas
particulier : TA >> TB
AB(t) = lB
(lA
N0)/(lB –
lA)
[e– lA
t – e–
lB
t]
Si TA >> TB ;
alors lA << lB.
Donc
il existe un temps t tel que : TA >> t >> TB
e–
lA
t
= e–
ln2
t /TA
e–
lB
t
= e–
ln2
t /TB qui tend vers 0
![]()
![]() AB(t) = lB
lA
N0 /(lB – lA) . e–
lA
t = lA
N0 e–
lA
t = AA(t)
AB(t) = lB
lA
N0 /(lB – lA) . e–
lA
t = lA
N0 e–
lA
t = AA(t)
négligeable
Autre
cas de figure :
Soit TA et TB quelconques
(avec des valeurs standard)
À
t = 0 : NA(t=0) = N0
NB(t=0) = 0
NC(t=0) = 0
Quand
t tend vers ¥ : NA tend vers 0
NB tend vers 0
NC tend vers N0
N(t)
 NA(t)
NA(t)
N0
NC(t)
N0/2
NB(t)
TB Tm
NB(t) = (lA
N0)/(lB –
lA)
[e– lA
t – e–
lB
t]
dNB(t)/dt = (lA
N0)/(lB –
lA)
[–lA
. e– lA
t + lB
. e– lB
t]
Pour
le temps t = Tm : dNB/dt = 0
Donc : –lA . e– lA Tm = lB . e– lB Tm
Tm = 1/(lB – lA) . ln( lA /lB ) e– lB Tm = ( lA /lB ) e– lA Tm
AB(t=Tm) = (lB lA N0)/(lB – lA) [e– lA Tm – (lA /lB) e lA Tm]
= (lB lA N0)/(lB – lA) . e– lA Tm [ 1 – (lA /lB) ]
![]()
![]()
![]()
![]() = (lB lA N0)/(lB – lA) . e– lA Tm [ (lA –lB)/lB ]
= (lB lA N0)/(lB – lA) . e– lA Tm [ (lA –lB)/lB ]
= lA
. N0 . e–
lA
Tm
=
AA(t=Tm)
A(t)
 AA(t)
AA(t)
A0
NC(t)
Tm
Pour
les filiations des grandes familles de radioéléments, les désintégrations
amènent à chaque fois vers le plomb Pb.
Cet
élément présente un nombre de nucléons dit « magique » qui le rend
très stable.